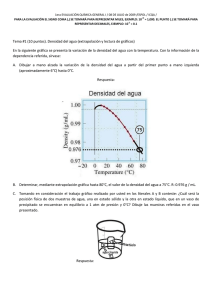
PRACTICA DE LABORATORIO Identificación de ácidos y bases GRADO 10. . Objetivo: Desarrollar en el estudiante un espíritu investigativo con el cual pueda expresar y fortalecer sus conocimientos y conceptos desarrollados en las clases de química. MATERIALES Y REACTIVOS: 1 trípode metálico. 1 mechero Malla de asbesto. 1 Balanza. 4 vasos de precipitado. 1 matraz aforado de 100 ml 1 Beacker de 500 ml Pinza para crisol. 1 gradilla 1 pipeta de 25 ml. 1 pipeta de 10 ml 1 gotero 4 tubos de ensayo 1 espátula Cuchara de ignición. Erlenmeyer. Tapón de caucho. Azufre en polvo Agua Hidróxido de sodio Sodio metálico Ácido nítrico. Fenolftaleína Hojas de Repollo morado hipoclor. Vinagre. limón jabón lava loza. Mechera Trapo para limpiar. PROCEDIMIENTO 1. (solución 1) En un recipiente metálico, deposite pequeños trozos de hojas de repollo morado y vierta sobre ellos una taza (aproximadamente) de agua caliente. 2. (solución 2) en un vaso de precipitado prepare una solución de jabón lava loza 3. (solución 3) en un vaso de precipitado deposite jugo de limón.. 4. (solución 4) en un vaso de precipitado deposite un poco de vinagre. 5. (solución 5) en un vaso de precipitado prepare una solución diluida de hidróxido de calcio. Practica 1 1. adicione a cuatro tubos de ensayo (tubo 1, tubo 2, tubo 3 y tubo 4), 3 ml de solución 1 y colóquelos en la gradilla. 2. adicione al tubo 1 un poco de solución 2, al tubo 2 un poco de solución 3, al tubo 3 un poco de solución 4 y al tubo 4 un poco de solución 5. 3. apunta las observaciones y los resultados de la práctica. 4. Lave y seque el material. Practica 2 1. coloque 3 ml de solución 2, solución 3, solución 4 y solución 5, cada una en un tubo de ensayo y colóquelos en una gradilla. 2. agregue dos gotas de fenolftaleína a cada uno de los tubos. 3. apunta las observaciones y los resultados de la práctica. 4. Lave y seque el material. Practica 3 1. Tome un vaso de precipitado y vierta 3 gotas de fenolftaleína y agregue agua hasta la mitad del vaso. 2. con mucho cuidado, tome una porción pequeña de sodio con una pinza e introdúzcala en el vaso de precipitado, tapando inmediatamente con el vidrio de reloj. 3. Repita la experiencia utilizando potasio metálico. 4. apunta las observaciones y los resultados de la práctica. 5. Lave y seque el material. Practica 4. 1. Tome un trozo de cinta de magnesio de 2 cm con una pinza para crisol y exponga uno de sus extremos a la llama de un mechero. (evite mirar la luz de la reacción). 2. Con mucho cuidado deposite el residuo de la reacción en el vaso de precipitado. 3. Agregue 10 ml de agua y una o dos gotas de Fenolftaleína. 4. Agite la mezcla con la ayuda de una varilla de vidrio. 5. apunta las observaciones y los resultados de la práctica. 6. Lave y seque el material. Practica 5. 1. Coloque una porción de azufre en polvo en una cuchara de ignición. 2. Caliente la cuchara hasta que el azufre produzca una llama azul. 3. Recoja los vapores en un Erlenmeyer. 4. Tápelo rápidamente con la mano. 5. Agregue un poco de agua, cierre el recipiente rápidamente con un tapón de caucho y agite vigorosamente el recipiente. 6. Apunta las observaciones y los resultados de la práctica. 7. Lave y seque el material. Practica 6. 1. En un Beacker coloque 20 ml de solución 1 2. Introduzca el pitillo y sople dentro de la solución hasta que observe algún cambio. 3. Apunta las observaciones y los resultados de la práctica. 4. Lave y seque el material. Cuestionario. El repollo contiene un pigmento llamado lombarda, que parentesco tiene este con la fenolftaleína. a que crees que se deba la variación de color en la practica 1? que características físicas presenta el sodio, el potasio y el azufre? escriba la ecuación química que represente la reacción en cada una de las practicas Escriba el nombre de las sustancias que participan y se producen en cada reacción. Explique con sus propias palabras lo sucedido en la practica 6. Que es una sustancia indicadora y como funciona, Teniendo en cuenta el esquema anterior, cuál sería el pH de las sustancias estudiadas. Determine el número de oxidación de cada elemento en los reactivos y los productos. considerarías que este elemento (Na) al igual que todos los de su grupo son altamente reactivos? Por qué? 11. Como calificaría el comportamiento de su grupo durante la práctica? 12. Podría esta práctica ser de utilidad en la vida real? ¿de qué manera? 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 1. REALICE UN INFORME DE LABORATORIO QUE CONTENGA: A. PORTADA. B. INTRODUCCIÓN. C. OBJETIVOS. D. MATERIALES Y PROCEDIMIENTO. E. OBSERVACIONES Y RESULTADOS. F. ANÁLISIS DE RESULTADOS. G. CUESTIONARIO. H. CONCLUSIONES. CALIFICACIÓN: Trabajo en el laboratorio: Comportamiento: Informe de práctica: 40% 20% 40% Cada grupo debe velar por la buena conducta en el laboratorio y el cumplimiento de las normas. Los integrantes no podrán salirse de su espacio de trabajo sin autorización. La indisciplina de un integrante del grupo se verá reflejada en la nota de comportamiento. Si el grupo considera que un integrante le afecta demasiado, estará en libertad para excluirlo del informe. El estudiante excluido por indisciplina podrá presentar de manera individual su informe de laboratorio, pero sus notas de trabajo en el laboratorio y de comportamiento serán mínimas. El informe se debe presentar puntualmente. Este aspecto se tendrá en cuenta en la nota del mismo.