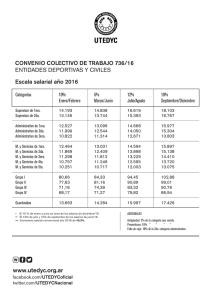
MÉTODOS Muestreo del suelo y obtención de nódulos Se obtuvo una muestra de 100 g de suelo agrícola invernadero de leguminosas (Phaseolus vulgaris) de la Facultad de Ciencias Agrarias de la Escuela Profesional de Agronomía de la Universidad Nacional de San Cristóbal de Huamanga. Para la toma de nódulos, se seleccionaron en el campo las mejores plantas en estado de floración, se excava con una pala hasta exponer las raíces de las leguminosas se procedió a recolectar dos plantas cuya raíz alcanza los 5 cm, los nódulos presentaron tamaño pequeño (<5mm), con formas redondas, superficies lisas, y la mayoría ubicados principalmente en la raíz secundaria y se las empaca en una funda ziploc. Las muestras fueron trasladadas al laboratorio de Microbiología ambiental de la Universidad Nacional de San Cristóbal de Huamanga. Aislamiento e identificación bacteriana de cepas de Rhizobium etili El aislamiento e identificación bacteriana se realizará en el laboratorio de Microbiología ambiental de la Universidad Nacional de San Cristóbal de Huamanga: Los nódulos tenían un tamaño de 4 mm y se colocaron en sobres de papel de filtro para hidratarse en agua estéril destilada durante 30 minutos, se desinfectaron en alcohol 70% por 1 minuto en un frasco estéril, luego se transfirió los sobres a un frasco con hipoclorito de sodio 3% por espacio de 3 minutos. Se lavaron con agua estéril destilada hasta cinco veces. A cada nódulo se agregó una gota de agua destilada estéril por nódulo. Luego con la ayuda de una bagueta se aplastaron lo nódulos y el macerado se diseminó en placas de Petri por agotamiento. Las placas fueron llevadas a la incubadora a 28 ºC de 2 a 4 días. Adicionalmente se realizó tinción Gram. Posteriormente se cultiva en el medio YMA en un pH 5.5, con una concentración de microorganismos de 0.50 g. Para Rhizobium etili de crecimiento rápido, el medio acidifica, y para Rhizobium etili de crecimiento lento, el medio alcaliniza. Adicionalmente se realizó tinción Gram. Las cepas de Rhizobium etili, presentaron crecimiento rápido, con un tiempo promedio de aparición de tres días, tanto en medio de cultivo sólido. Ensayo de germinación de semillas de Lupinus mutabilis (tarwi) en el Laboratorio de Microbiología ambiental (UNSCH) Se desinfectaron las semillas con hipoclorito de sodio 2%, por 3 min. A continuación, se lavaron tres veces consecutivas hasta retirar todas las impurezas. Luego se realizó la inbibición de las semillas en frascos de vidrio de 250 mL, por un tiempo de 35 min y luego se secaron por 40 min. Finalmente, se colocaron en bandejas de 310 mm de largo x 210 mm de ancho, de manera que se colocaron 5 semillas por fila y 5 semillas por columna, hasta obtener 25 semillas en total. (5 semillas para cada tratamiento), donde se evaluó el porcentaje de germinación a los 7 días y biomasa seca a los 18 días de crecimiento en las bandejas. En este ambiente la temperatura fue de 20 a 24 °C. Preparación de la solución de bacterias de Rhizobium etili en base a la Escala de McFarland La escala de McFarland tiene una aplicación especial en la preparación de inóculos bacterianos para la realización de pruebas de sensibilidad antimicrobianas y se encuentra al alcance en el laboratorio de Microbiología. Los patrones de McFarland se utilizan como patrones de turbidez en la preparación de suspensiones de microorganismos. La realización de pruebas de sensibilidad requiere el uso de inóculos estándar. El patrón 0,5 de McFarland se utiliza para la preparación de inóculos en dilución de agar estandarizado, procedimientos de macro y microdilución de caldo, de difusión en disco y pruebas de sensibilidad para organismos anaerobios.46 (National Committee for Clinical Laboratory Standards, 2003). Principios del método. El patrón 0,5 de McFarland corresponde aproximadamente a una suspensión homogénea de Rhizobium de 1,5 x 108 células por mL (Pérez, 2011). Emplear una técnica aséptica y seguir las precauciones habituales contra riesgos microbiológicos durante todo el proceso. Después de su utilización, los tubos preparados, los recipientes de muestras y otros materiales contaminados deben esterilizarse en autoclave antes de ser desechados. Instrucciones para el almacenamiento: En el momento de la entrega, guardar los tubos en un lugar oscuro a una temperatura de 2 – 25 °C. Evitar la congelación y el sobrecalentamiento. Permitir que alcancen la temperatura ambiente antes de utilizarlos. (National Committee for Clinical Laboratory Standards, 2003). Procedimiento y evaluación Después de agitar vigorosamente en un vórtex mecánico, se comprobó la densidad del patrón de turbidez determinando la absorción mediante un espectrofotómetro con un haz luminoso de 1 cm y la cubeta correspondiente. La absorción a 625 nm debe ser de 0,08 a 0,10. (National Committee for Clinical Laboratory Standards, 2003) La exposición del patrón a la luz durante el almacenamiento puede afectar a las mediciones de turbidez. Aplicación de la solución obtenida en la escala de Mc Farland Las muestras (X, Y, Z, P) fueron sometidas a las soluciones que implicaron las suspensiones bacterianas de Rhizobium etili. El número de cepas utilizadas fueron 4 concentraciones y un control correspondientes en la escala de Mc Farland. Estas soluciones se trabajaron colocadas a la solución de 15 ml de agua destilada por medio del asa de cultivo. El procedimiento se detalla con mayor énfasis en lo siguiete: Concentraciones muestra M, Testigo muestra X, se utilizaron concentración estándar (0.5) 1,5 x 108 células por mL muestra Y, se utilizaron concentración estándar (3) 9 x 108 células por mL muestra Z, se utilizaron concentración estándar (6) 1,8 x 109 células por mL muestra P, se utilizaron concentración estándar (9) 2,7 x 109 células por mL Dosis 1era, 2da y 3ra y un control Evaluación del crecimiento Lupinus mutabilis (tarwi) tratamiento: muestra P Altura de la plántula (AP) : Centímetro(cm) Índice de área foliar (IAF): Adimensional Número de hojas (NH): Unidades(U) Diámetro de tallo (DT): Centímetro(cm) Evaluación del crecimiento Lupinus mutabilis (tarwi) tratamiento: estándar (0.5) 1,5 x 108 células por mL, (1era, 2da y 3ra Dosis) Altura de la plántula (AP) : Centímetro(cm) Índice de área foliar (IAF): Adimensional Número de hojas (NH): Unidades(U) Diámetro de tallo (DT): Centímetro(cm) Evaluación del crecimiento Lupinus mutabilis (tarwi) tratamiento: estándar (3) 9 x 108 células por mL, (1era, 2da y 3ra Dosis) Altura de la plántula (AP) : Centímetro(cm) Índice de área foliar (IAF): Adimensional Número de hojas (NH): Unidades(U) Diámetro de tallo (DT): Centímetro(cm) Evaluación del crecimiento Lupinus mutabilis (tarwi) tratamiento: estándar (6) 1,8 x 109 células por mL, (1era, 2da y 3ra Dosis) Altura de la plántula (AP) : Centímetro(cm) Índice de área foliar (IAF): Adimensional Número de hojas (NH): Unidades(U) Diámetro de tallo (DT): Centímetro(cm) Evaluación del crecimiento Lupinus mutabilis (tarwi) tratamiento: concentración estándar (9) 2,7 x 109 células por Ml, (1era, 2da y 3ra Dosis) , (1era, 2da y 3ra Dosis y un control) Altura de la plántula (AP) : Centímetro(cm) Índice de área foliar (IAF): Adimensional Número de hojas (NH): Unidades(U) Diámetro de tallo (DT): Centímetro(cm) DOSIS NÓMINA N°PLANTAS SOLUCIÓN (ml) CONCENTRACIÓN 1ra 2da M 5 15 Testigo X 5 15 (0.5) 1,5 x 108 células por mL Y 5 15 (3) 9 x 108 células por mL Z 5 15 (6) 1,8 x 109 células por mL P 5 15 (9) 2,7 x 109 células por mL 3ra 2da 3ra 1ra 2da 3ra 2da 3ra 1ra 2da 3ra 2da 3ra tabla: l