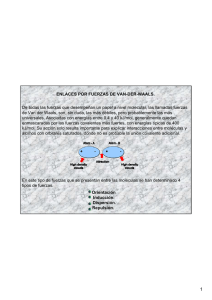
TEMA 2: Nanomateriales y nanoestructuras 1. 2. 3. Tipos de enlaces a. Enlace iónico b. Enlace covalente c. Enlace metálico d. Fuerzas intermoleculares: Fuerzas de van der Waals Estructuras cristalinas: Redes de Bravais. Silicio. Nanoestructuras a. Nanopartículas b. Hilos c. Películas y recubrimientos d. Materiales porosos e. Materiales policristalinos f. Estructuras cuánticas: pozos, hilos y puntos cuánticos g. Moléculas i. Fullerenos ii. Nanotubos iii. Grafeno ENERGÍA DE LOS ENLACES 2 2 2 Energía Distancia de enlace Ar2 0.3 kcal/mol =0.013eV 3.76 Å He2 0.022kcal/mol=9.5·10-4eV 3.0 Å H2 4.5 eV 0.74 Å kBT = 0.026 eV=0.6 kcal/mol a temperatura ambiente ENLACES QUÍMICOS ENLACE IÓNICO 4 ENLACE METÁLICO ENLACES QUÍMICOS ENLACE COVALENTE ENLACES QUÍMICOS HIBRIDACIÓN ENLACES QUÍMICOS ORBITALES HÍBRIDOS Hibridación sp2 Hibridación sp3 CH4 Hibridación sp ENLACES QUÍMICOS ESTRUCTURA ELECTRÓNICA DEL BENCENO Grafeno FUERZAS DE VAN DER WAALS Fuerzas de Van der Waals 1. Fuerza dipolo-dipolo, o fuerza de Keesom: Interacción entre dipolos permanentes. 2. Fuerza de inducción o de Debye: dipolo dipolo inducido 3. Fuerza de dispersión de London: Interacción entre dipolos ocasionales MOMENTO DIPOLAR DE UNA MOLÉCULA Ácido clorhídrico: HCl Electronegatividad: H ‐> 2.2 Cl ‐> 3.16 Agua: H2O Anhídrido carbónico: CO2 FUERZAS DE VAN DER WAALS Fuerzas de van der Waals 1. Fuerza dipolo-dipolo, o fuerza de Keesom: Interacción entre dipolos permanentes. Ejemplo Enlaces de Hidrógeno Nitrógeno, Oxígeno, Fluor FUERZAS DE VAN DER WAALS Fuerzas de Van der Waals 2. Fuerza de inducción o de Debye: dipolo dipolo inducido Por ejemplo: HCl y Ar o H2O y CCl4 3. Fuerza de dispersión de London: Interacción entre dipolos ocasionales Por ejemplo: metano, gases nobles, etc. Elemento Número atómico Punto de ebullición (K) He 2 27 Ne 10 87 Ar 18 120 Kr 36 165 Xe 54 211 compuesto Punto ebullición °C Momento dipolar D % dipolo‐dipolo Ar CO HCl HBr HI NH3 H2 O –186 –190 –84 –67 –35 –33 100 0 0.1 1.0 0.8 0.4 1.5 1.8 0 0 14.4 3.3 0.1 44.6 77.0 % dipolo‐ dipolo inducido 0 0 4.2 2.2 0.4 5.4 4.0 % dispersion 100 100 81.4 94.5 99.5 50.0 19.0 Tipo de enlace Energía de la red iónica Energía del enlace covalente Enlaces de hidrógeno Dipolo–Dipolo Fuerzas de dispersión de London 2 2 Tipo de enlace ions ion – molécula polar Dos moléculas polares ion ‐ molécula no polar Molécula polar y no polar moléculas no polares Energía de disociación (kcal/mol) 250‐4000 30‐260 1‐12 0.5–2 <1 to 15 2 2 2m 2 Tipo de fuerza Coulomb ion‐dipolo dipolo‐dipolo ion – dipolo inducido dipolo ‐ dipolo inducido dispersión n 12 12 12 12 12 12 m 1 2 3 4 6 6 Fuerzas de Van der Waals: geckos - salamanquesas 1 mm2: 14000 microapéndices (setae) de 5µm que acaban en 100 o 1000 spatulae de 200nm de largo ESTRUCTURAS CRISTALINAS Redes de Bravais 2. Nanoestructuras a. Nanopartículas b. Hilos c. Películas y recubrimientos d. Materiales porosos e. Materiales policristalinos f. Estructuras cuánticas: pozos, hilos y puntos g. Moléculas i. Fullerenos ii. Nanotubos iii. Grafeno NANOPARTÍCULAS Nanoparticles of Titanium Oxide Porcentaje de átomos superficiales en una nanopartícula en función del número total de átomos NANOPARTÍCULAS ‐ propiedades Oro (Au) Color Amarillo Conductividad eléctrica Conductor Magnetismo No magnético Reactividad química Químicamente inerte (a) (b) Oro Nano rojo Pierde la conductividad a 1‐3 nm Se hace magnético a 3 nm Explosivo; actúa como catalizador (c) Nanotecnología romana de hace 1600 años: La copa de Licurgo. Los efectos de color están hechos con nanopartículas de oro y plata: (a) luz reflejada. (b) luz transmitida. (c) Una disolución de nanopartículas de oro en agua. NANOPARTÍCULAS ‐ propiedades , 1 1 NANOPARTÍCULAS ‐ funcionalización 1-Mercapto-(triethylene glycol) methyl ether functionalized 5 nm gold nanoparticles: Soluble in a variety of solvents including toluene, chloroform, ethyl acetate, acetone, water and alcohols. (1-Mercaptoundec-11-yl) tetraethyleneglycol functionalized 5 nm gold nanoparticles: Soluble in alcohol and water Dodecanethiol functionalized 5 nm gold nanoparticles: Use in organic solvents such as toluene. nano‐HILOS PELÍCULAS AUTOENSAMBLADAS SAM ‐ Self‐Assembled Monolayers MATERIALES POROSOS Zeolitas MATERIALES POLICRISTALINOS ESTRUCTURAS CUÁNTICAS: POZOS, HILOS Y PUNTOS CUÁNTICOS FULLERENOS Y NANOTUBOS Premio Nobel de Química 1996 H. Kroto, R. Curl, R. Smalley Nanopartículas de carbono: fullereno C60 Premio Nobel de Química 1991 Sumio Iijima Estructura de los nanotubos de carbono NANOTUBOS Pared simple (Single Wall nanotube ‐ SWNT) Pared múltiple (Multiwall nanotube ‐ MWNT) NANOTUBOS ‐ ESTRUCTURA ( , 0) ( , ) NANOTUBOS – PROPIEDADES Y APLICACIONES Mechanical performances of CNT compared to carbon fibers, Kevlar and stainless steel Transistor FET con puerta de nanotubos NANOTUBOS – FABRICACIÓN Fig. 22.14 An ordered array of MWCNTs grown using an alumina template (From J. Li et al., Appl. Phys. Lett. 75, 367 (1999) Fig. 22.15 Vertically alligned CNTs from a DC plasma enhanced process Handbook of nanoscience, 2007 Nanotube arrays grown on Ni dots: (b) Single nanotubes on Ni dot of 100 nm, as only a single nanoparticle is formed from such a dot. (c) Demonstration of high yield, uniform, and selective growth of nanotubes at different densities. Copyright 2001 American Institute of Physics. (Functionalization of vertically aligned carbon Nanotubes, E. Van Hooijdonk et al., Beilstein J. Nanotechnol. 2013, 4, 129–152) GRAFENO GRAFENO MOLÉCULAS ORGÁNICAS K. Stokbro et al., Theoretical study of the nonlinear conductance of Di‐thiol benzene coupled to Au(1 1 1) surfaces via thiol and thiolate bonds, Computational materials Science 27, 151 (2003) MOLÉCULAS ORGÁNICAS S. Lenfant et al., Electron Transport through Rectifying Self‐Assembled Monolayer Diodes on Silicon: Fermi‐Level Pinning at the Molecule‐Metal Interface, J. Phys. Chem. B, Vol. 110, No. 28, 2006 MOLÉCULAS ORGÁNICAS H. He, Nanotechnology 19, 505203 (2008) Electronic conduction in a novel three-terminal molecular transistor MOLÉCULAS ORGÁNICAS Nano. The essentials (2007) MOLÉCULAS ORGÁNICAS