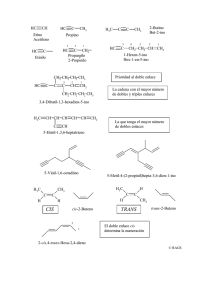
REACCIONES DE SÍNTESIS DE ALCOHOLES 1.- A partir de los alquenos. a) Hidratación de alquenos.Al tratar el tema de los alquenos vimos que se pueden obtener alcoholes por hidratación de los mismos, teniendo en cuenta que por este procedimiento se obtienen alcoholes de acuerdo con la regla de Markovnikov. R CH2 CH + H2O H calor CH3 CH R OH CH2 + H2O CH H3C H calor H3C CH CH3 pero no H3C CH2 CH2OH OH b) Hidroboración seguida de oxidación. Mediante este procedimiento se pueden tener alcoholes anti-Markovnikov. R CH2 CH + H2O 1) BH3.THF 2) H2O2. OH R CH CH2 OH H CH H3C CH2 + H2O 1) BH3.THF 2) H2O2. OH H3C CH2 CH2OH 2.- A partir de haluros de alquilo. Este proceso tiene lugar mediante una sustitución nucleofílica. En los haluros primarios y algunos secundarios tiene lugar mediante una SN2. Mientras que en los haluros de alquilo terciarios tiene lugar mediante una SN1. R H3C CH2 CH CH3 CH2 Br CH2 CH2Br KOH H2O KOH H2O R CH2 H3C CH2 OH CH CH2 CH2OH CH3 3.- Reacción de adición nucleofílica de reactivos de Grignard al grupo carbonilo y epóxidos. Los reactivos nucleofílicos se pueden adicionar al grupo carbonilo (aldehidos, cetonas y derivados de ácido) así que como a epóxidos (óxido de etileno) dando lugar a alcoholes. R MgX O C + éter C R H3O O C R OH a) Alcoholes primarios. Cuando la adición se lleva a cabo sobre el metanal. H R MgX + (X = Cl ó Br) C H O éter C R H H H3O O H CH2 MgX H3C H H3C C + OH H H H3C CH C R CH O H3C H H3C CH O CH2 C CH2 CH2OH H3C H b) Alcoholes secundarios. Cuando la adición se lleva a cabo sobre cualquier otro aldehído. R1 R MgX + (X = Cl ó Br) O C R1 éter H CH2 MgX C R CH3 H3C H CH3 H3C CH O CH2 C CH O OH H H3C C + H3C O H H3C H3C CH C R R1 H3O CH2 CH OH H3C H c) Alcoholes terciarios. Cuando la adición se lleva a acabo sobre una cetona. R1 R MgX + (X = Cl ó Br) R1 éter CH CH2 MgX H3C C R H O C R CH3 CH O CH2 C H3C H2C OH R2 H3C C + R1 H3O R2 H3C H3C H3C O C CH3 H3C CH O CH2 CH3 H3C CH2 CH CH2CH3 d) Reacciones con epóxidos. Dan lugar a la formación de alcoholes primarios. O R MgX (X = Cl ó Br) + H2C CH2 H2O R CH2 CH2 OH OH O H3C CH MgX + H2C H3C CH CH2 CH2 CH2 O H3C H2O H3C H3C CH2 CH2 OH CH H3C e) Reacciones con derivados de ácido (haluros y ésteres). Los reactivos de Grignard reaccionan con estos derivados de ácido dando alcoholes terciarios. La reacción transcurre con un cetona como intermedio por lo que se requieren dos equivalentes de reactivo de Grignard por cada equivalente de ácido. O R MgX C 2 R1 + (X = Cl ó Br) R1 H2O Y (Y = Cl ó OR) + OH C R O CH3 MgCl R O O CH3 C Cl H3C H3C Cl C C CH3 CH3 CH3 MgCl OH H3C C O H2O CH3 H3C CH3 CH2 MgCl + CH3 C CH3 CH3 O O H3C C OCH3 H3C C O OCH3 H3C CH2CH3 CH2CH3 H3C CH2 MgCl O OH H3C C C CH2CH3 CH2CH3 H2O H3C C CH2CH3 CH2CH3 4.- Reducción de compuestos carbonílicos. Para la reducción de los compuestos carbonílicos se suelen emplear hidruros como el NaBH4 que es muy selectivo y no reduce los ácido o ésteres o el LiAlH4 que es un reactivo más energico y reduce también los ácidos, ésteres y otros derivados de ácido. Normalmente los aldehídos se reducen a alcoholes primarios y las cetonas a alcoholes secundarios. Los ácidos y ésteres se reducen a alcoholes primarios. R R H O C + C H R1 R O H3O C H R1 OH R1 O H3C H3C H3C C H NaBH4 o LiAlH4 etanol O NaBH4 o LiAlH4 éter O O C CH2 C O O C CH2 C H3C CH2OH H OH O NaBH4 éter OCH2CH3 H3C CH CH2 C OCH2CH3 OH OCH2CH3 1) LiAlH4 2) H2O H3C CH CH2 CH2OH OH 5.- Reacción de alquenos con KmnO4 para dar dioles. Los alquenos reaccionan con el KMnO4 en medio alcalino, diluido y en frío para dar dioles vecinales (glicoles). También se puede emplear OsO4 en H2O2. R CH CH2 KMnO4 OH , frío R CH CH2 OH OH estereoquímica sin H H OH KMnO4 H ciclohexeno OH , frío OH H cis-1,2-ciclohexanodiol REACCIONES DE LOS ALCOHOLES 1.- Reacciones de oxidación. Los alcoholes primarios se reducen a ácidos carboxilicos cundo se emplean oxidantes enérgicos como el Na2Cr2O o H2CrO4, mientras que los alcoholes secundarios se oxidan a cetonas. Para reducir los alcoholes primarios a aldehídos se emplea el reactivo de Collins (CrO3 + piridina) o una variante del mismo CCP(CloroCromato de Piridinio, CrO3 + piridina + HCl). O R CH2 CH2OH H2CrO4 acetona R CH2 CH2OH CrO3 piridina R CH2 C O OH R CH2 C H O R Na2Cr2O7, H acetona CH CH3 R C CH3 OH 2.- Reacciones que implican la ruptura del enlace entre el carbono y el grupo OH. a) Deshidratación de alcoholes. R CH CH H OH R´ H calor R CH C R´ CH3 CH3 H3C CH CH CH3 H calor CH3 OH H3C C C CH3 CH3 (Recordar que la dishidratación de un alcohol dará el alqueno más sustituido según la regla de Saitzev y que la reacción de deshidratación transcurre por medio de carbocationes y puede haber transposiciones) b) Reacciones con HBr y HCl. Los alcoholes reaccionan con los ácidos hidrácidos para dar haluros de alquilo. Esta reacción esta favorecida (SN1) para los alcoholes terciarios y algunos secundarios. El rendimiento disminuye cuando se pasa a los alcoholes primarios (SN2). CH2 OH R HBr + CH2 Br R CH3 CH3 C H3C OH HBr + C H3C Br H2O + CH3 CH3 Algunas veces para que el HCl reacciones con alcoholes primarios y algunos secundarios se necesita la presencia de un ácido de Lewis como el ZnCl2. CH2 OH H3C + HCl ZnCl2 CH2 Cl H3C A la mezcla HCl/ZnCl2 se le denomina Reactivo de Lucas y se puede utilizar como un ensayo para determinar que tipo de alcohol se trata. Los alcoholes 3º reaccionan inmediatamente, los alcoholes 2º tardan 2-5 minutos en reaccionar. Los alcoholes 1º reaccionan muy lentamente y pueden tardar horas. c) Reacciones con los haluros de fósforo. Los alcoholes reaccionan con los haluros de fósforo para dar haluros de alquilo. Esta reacción esta condicionada por el impedimento estérico y da buenos rendimientos preferentemente con alcoholes 1º y 2º. 3R CH2OH CH2 OH H3C 3R PCl3 + + PCl3 CH2Cl + P(OH)3 CH2 Cl H3C d) Reacción de los alcoholes con SOCl2. R CH2OH + R SOCl2 CH2Cl + SO2 + HCl 3.- Reacciones que implican la ruptura del enlace entre el oxígeno y el hidrógeno del grupo hidroxilo. a) Reacciones de esterificación de Fischer. O R O C OH ácido + H HO R1 alcohol R O H3C C C OR1 éster + H2O O OH + HO CH2CH3 H H3C C O CH2CH3 + H2O Esta reacción tiene el incoveniente de que se trata de un equilibrio pero se puede favorecer la formación del éster transformando el ácido en un cloruro de ácido. O H3C C O O OH SOCl2 H3C C Cl + H3C CH3OH C O a) Reacciones con metales para formar alcóxidos. R CH2OH Na + R CH2O Na + 1/2 H2 alcóxido de sodio H3C CH2OH CH3 + Na H3C CH2O CH3 Na H3C C + K H3C C Na CH3 OH O CH3 --------- ooo0ooo --------- + + 1/2 H2 1/2 H2 CH3 + HCl