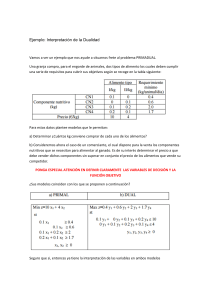
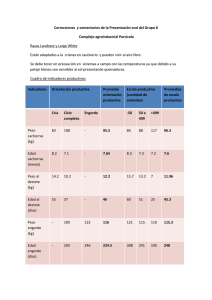
UNIVERSIDAD ESTATAL PENINSULA DE SANTA ELENA CULTIVO DE ATÚN ROJO (Thunnus thynnus) INTEGRANTES: Nataly Aguilar Micaela Loayza Michael Reyes Andrés Sánchez Douglas Tomalá Anatomía Pez óseo de la familia de los escómbridos Cuerpo alargado y fusiforme, delante mas robusto puede superar los 4m y su peso máximo es de 726 kg hasta 900 kg Dorso azul oscuro Zonas laterales inferiores y estómago blancas plateadas y líneas transversales incoloras alternadas con líneas de puntos claros. Posee 39 vertebras: entre 12 a 14 espinas en la aleta dorsal, y de 13 a 15 radios 2 aletas dorsales separadas la 1 sostenida por espinas de color amarillo o azulado la 2 por franjas blandas de color marrón rojizo Migra para desovar en áreas especificas y bien definidas aleta caudal y las pínulas amarillo o gris, contorneadas de negro. Quilla negra en adultos Hábitat y distribución Habita ecosistemas pelágicos del Atlántico norte en principal el mar Mediterráneo. Mas distribuido; vive en aguas templadas del Atlántico Suele encontrarse en zonas de afloramiento como las costas occidentales de Marruecos y Portugal y puede alcanzar hasta los 1000 m de profundidad en busca de alimento Se encuentra en aguas que van desde Terranova hasta Brasil, en el lado occidental, y desde Cabo Blanco (20ºN) hasta Noruega y todo el Mediterráneo y el Mar Negro Se reconocen dos Stocks determinados por sus áreas de puesta Atlántico Pacífico Desde Labrador y Terranova hacua el Golfo de México y Mar del Caribe Desde el Golfo de Alaska hasta el Sur de California Occidente: Venezuela y Brasil Oriental: Baja California Oriental: Islas Lofoten, Noruega hasta el Mar Mediterráneo Occidental: norte de Filipinas Mapa de la distribución espacial del atún rojo atlántico (en azul), principales rutas migratorias (flechas negras) y principales zonas de desove (en amarillo) que se deducen de los datos de pesquerías históricas y actuales, así como de la información sobre marcado tradicional y electrónico. La línea de rayas verticales representa la delimitación del stock entre las dos unidades de ordenación actuales de ICCAT Alimentación Al mantener mucha actividad física necesitan mejor nutrición Se alimentan en zonas costeras de latitud elevada Consumen grandes cantidades de alimentos menos una cuarta parte de su propio peso por día Persiguen a los bancos de pequeños pelágicos: lanzones, boquerones, arenques, caballas, jureles, calamares y pequeños crustáceos. Reproducción Tiene lugar a principios de verano, fundamentalmente en dos zonas: el Mediterráneo y el Golfo de México. En el Mediterráneo, se conocen principalmente tres zonas de puesta; al sur de Italia (alrededor de Sicilia), Baleares y el Mar Levantino (Turquía) MADUREZ Talla de desove sup. a 190 cm / 8 años (Golfo de México) y en el Atlántico a los 4 años dividir stocks Desove y reproducción Ovíparo e iteróparo. Posee un desarrollo de oocitos asíncrono, y es un desovador modal múltiple (1-2 días) Producción de huevos depende de la edad o talla de la hembra (5mil a 45 mil de huevos) Una vez al año Mayo a Junio Fertilización de los huevos en la columna de agua Eclosión sin cuidado parental tras incubar 2 días Desove en aguas cálidas (> 24°C) en zonas específicas (Islas Baleares, Sicilia, Malta, Chipre y algunas áreas en el Golfo de México) Reclutamiento y alimentación Las larvas miden de 3 a 4 mm, son pelágicas saco vitelino y forma corporal poco desarrollada Se alimenta de zooplancotn copépodosOportunistas Ciclo de vida Captura Capturados vivos Artes de cerco Mayo-Junio Mediterráneo Silicia y Malta, Baleares y el Mar Levantino (Turquía). Transporte 45 días Peces enormes Coste económico Términos de biomasa Mantenimiento de reproductores Diferentes stocks Control de las puestas Comportamiento y pautas reproductivas IEO En jaulas flotantes Sardina, caballa, o arenque Huevos fértiles (t) Inducción a la puesta Emigran formando grandes bancos Eligen las áreas apropiadas Hembras: 270 y 300 kg Desarrollo embrionario 32h Estadíos larvarios 30 días Diámetro 1mm Dos vías Calidad Nutricional Factores bióticos y abióticos Parámetro Rango Temperatura 12 - 18 °C ocasional + de 20°C 5 -10 mg/l 0.02 – 0.25 mg/l <0.1 mg/l <0.1 mg/l <1.0 mg/l 7.8 - 8.1 20 mg/l Oxígeno disuelto Amonio Nitrito Nitrito Nitrato pH Sólidos en suspensión Larvicultura ALIMENTACION Y DESAROLLO Pre-engorde y engorde INICIO DEL PRE-ENGORDE EL PRE-ENGORDE INICIA CUANTO FINALIZA LA ETAPA LARVARIA Y LOS ORGANISMOS SE ALIMENTAN DE EJEMPLARES VIVOS PARA AUMENTAR Pre-engorde y engorde o Engrase España fue de los primeros en la maricultura de Atún Rojo y sus resultados en cuanto al engorde es estos organismos a sido creciente en todos los años después de su control de captura, con pocas disminución las cuales pueden deberse a factores ambientales o externos. DISMINUCION POR FACTORES NO HUMANOS O AMBIENTALES Pre-engorde y Engorde 6 Meses Post Captura Se Sacrifica El Organismo 10 Al 15% De Peso Ganado En Engorde JUVENILES DE 150 A 500 Gr DE PESO FINAL Adultos 300 A 380 Kilos (Producto De Gran Calidad) 3 A 6 Meses De Engorde Ganando De 100 A 200 Kilos Por Atun ENGORDE O ENGRASE ENGORDE DE JUVENILES A ADULTOS CONTROL DE CALIDAD ELEVADO ALTA CALIDAD SEPARADA DE OTROS TALLAS MAXIMAS PARA EXPORTACION Y MINIMAS PARA CONSUMO PRUEBAS QUIMICAS ESPECIALIZADAS INICIO PARA COMERCIALIZACION TALLA OPTIMA DE CALIDAD LIMITE DE EDAD Y TALLA Sistema de producción Mantenimien to y engorde Captura en época de reproducció n Presión por la comida Periodo de engrase 6 meses 10-15% de biomasa ganada Se reduce a una estabulación A través de un tubo desde un barco que se dirige al centro de la jaula Despesque: se recogen con malla y se sacrifican Alimentados una vez al día/ rica en grasa Atunes de -100k mecánicos, pero los de + en el mar arpones Forma y tamaño de jaulas Produccion 20,000tn entre 2001/2002 50ª 90 m de diametro 120*160m Prof: 25 a 35m Luz de malla 12cm Para transporte: jaulas de polietileno de50m de diámetro o rectangulares de 40*25m Patología Parasitas Adultos bastante resistentes Bacterias: estrés, traumas Australia Vientos fuertes :X Mucus en branquias Micro algas toxicas Carnadas: tiaminasas lípidos oxidados Sinopoli, M.; Pipitone, C.; Campagnuolo, S.; Campo, D.; Castriota, L.; Mostarda, E. y Andaloro, F. (2004). Diet of young-of-the-year bluefi n tuna, Thunnus thynnus (Linnaeus, 1758), in the southern Tyrrhenian (Mediterranean) Sea. J. Appl. Ichthyol. 20: 310-313. Smith-Vaniz, W. F. (1986). Scombridae. In Fishes of the Northeastern Atlantic and the Mediterranean. Iiwhitehead, P. J. P., Bauchot, M. L., Hureau, J. C., Nielsen, A., y Tortonese, E. (eds.), UNESCO Paris : 981 - 997. CHASE, B. C. (2002). Differences in diet of Atlantic tuna (Thunnus thynnus) at five seasonal feeding grounds of the New England continental shelf. . Fishery Bulletin 100, 168-180. FROMENTIN, J.-M. a. (2005). Atlantic bluefin tuna: population dynamics, ecology, fisheries and management. Fish and Fisheries, 281-306. KARAKULAK, S. I. (2004). First information on the reproductive biology of the bluefin tuna (Thunnus thynnus) in the eastern Mediterranean. . Collect.Vol. Sci. Pap; ICCAT, 1158. MATHER, F. J. (1995). Historical document: life history and fisheries of Atlantic bluefin tuna. Miami, NOAA Technical Memorandum NMFSSEFSC-370. , 165 pp. MEDINA, A. F. (2002). Stereological assessment of the reproductive status of female Atlantic northern bluefin tuna during migration to Mediterranean spawning grounds through the Strait of Gibraltar. ournal of Fish Biology , 203-217. RODRIGUEZ-RODA, J. (1964). Biologia del Atun, Thunnus thynnus (L.), de la costa sudatlantica de España. . Investigacion Pesqua, 33. SCHAEFER, K. M. (2001). Reproductive biology of tunas. B. A. and E. D. Stevens, eds. Tuna. Physiology, ecology, and evolution. San Diego, Academic Press. , 225-270. UOTANI, I. T. (1990). Feeding habit of bluefin tuna Thunnus thynnus larvae in the western North Pacific Ocean. Bulletin of the Japanese Society of Science and Fisheries 56, 713.