SEMINARIO DE GUADALAJARA “ANACLETO GONZÁLEZ FLORES
Anuncio

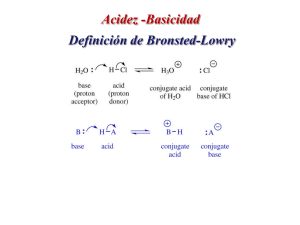
SEMINARIO DE GUADALAJARA “ANACLETO GONZÁLEZ FLORES” PROTOCOLO DE PRÁCTICA DE LABORATORIO DE QUÍMICA 1. DATOS GENERALES: ASIGNATURA: Ciencias III – Química PROFESOR: M. en C. Víctor M. Quezada Navarro GRUPO: _______ BIMESTRE: III PRÁCTICA No.: 12 Elaboró: M. en C. Víctor M. Quezada Navarro NOMBRE DE LA PRÁCTICA: “Prueba de la acidez o basicidad (alcalinidad) de diversos materiales” FECHA DE REALIZACIÓN: ________________ FECHA DE ENTREGA: ___________________ 2. DATOS DEL EQUIPO: No. EQUIPO: _________ INTEGRANTES: (1) _____________________________________________________________________________ (2) _____________________________________________________________________________ (3) ______________________________________________________________________________ (4) ______________________________________________________________________________ 3. PLANTEAMIENTO DEL PROBLEMA: La aplicación de la química en todos los ámbitos del quehacer humano es prácticamente interminable. Se desea identificar si un material es ácido, alcalino o ninguno de los dos (neutro). 4. OBJETIVOS: 1. Aplicar uno de los procedimientos más importantes en la química, como es la determinación del pH (potencial de hidrógeno). 2. Elaborar su propio indicador de acidez o basicidad. 5. MARCO TEÓRICO: (Investiga) Acidez: ____________________________________________________________________________________________ __________________________________________________________________________________________________ __________________________________________________________________________________________________ Basicidad: _________________________________________________________________________________________ __________________________________________________________________________________________________ __________________________________________________________________________________________________ pH: _______________________________________________________________________________________________ __________________________________________________________________________________________________ __________________________________________________________________________________________________ Indicador de pH: ____________________________________________________________________________________ __________________________________________________________________________________________________ __________________________________________________________________________________________________ 6. HIPÓTESIS: 1 7. MATERIALES: Hojas de col morada, 1 filtro de cafetera, alcohol etílico, flanera, base y malla de calentamiento, mechero de alcohol. 8. PROCEDIMIENTO: I. Deberemos obtener primeramente el extracto de la col morada por cualquiera de los dos métodos siguientes. Método 1: 1. Pica las hojas del repollo y colócalas en la flanera adicionando agua (casi a llenar). Las hojas no necesitan estar finamente picadas. 2. Coloca la flanera en la base de calentamiento, sobre la malla y el mechero encendido. 3. Calienta hasta que hierva y déjalo así por 10 – 15 minutos. El agua deberá tornarse color violeta y las hojas color verde. 4. Retira la flanera del fuego con cuidado. 5. Filtrar el líquido usando el papel filtro, recibiendo el líquido en un recipiente. El líquido es el indicador de pH y lo deberás conservar para tu uso en tu laboratorio portátil. Las hojas pueden desecharse. El papel filtro no lo tires: imprégnalo bien con el indicador y déjalo secar, obteniendo de esta forma papel indicador de pH. Córtalo en tiras pequeñas para que puedas emplearlo más eficientemente. Método 2: 1. Pica muy finamente las hojas del repollo y colócalas en la flanera adicionando alcohol etílico. 2. Deja reposar durante unos 15 minutos. 3. Haz el paso 5 del Método 1. II. Recolecta diversas muestras (líquidos o sólidos) y coloca una poca cantidad (unos cuantos mililitros o gramos) de cada muestra en vasos de plástico pequeños TRANSPARENTES (no translúcidos). Agrégale unas gotas del líquido indicador (o pónlo en contacto con el papel indicador) y ANOTA LO QUE OBSERVES en base a la siguiente escala de color: rojo intenso = 2 (muy ácido), rosa = 4, violeta = 6, azul violeta = 7 (neutro), azul = 7.5, azul verde = 9, verde azulado = 10, verde = 12 (muy básico), amarillo > 13. III. Verifica lo que obtuviste con los valores dados en tu libro de texto en las pp. 226 y 227. IV. Verifica algunos de tus valores con los obtenidos en el aula por el profesor usando papel indicador profesional y un pH-métro (se pronuncia “peachímetro”) portátil. 9. OBSERVACIONES Y RESULTADOS: (llena la tabla) Muestra Color pH aproximado 2 10. CUESTIONARIO: 1. Ordena en orden ascendente las sustancias que investigaste por acidez – basicidad: ____________________________ __________________________________________________________________________________________________ __________________________________________________________________________________________________ __________________________________________________________________________________________________ 2. ¿Coincidieron tus mediciones con las del libro y las del maestro?_________ En caso negativo, ¿a qué crees que se deba? _____________________________________________________________________________________________ 3. ¿Se podría producir indicador de pH a partir de otras plantas o vegetales? ________ ¿Como cuáles?______________ __________________________________________________________________________________________________ 11. CONCLUSIONES: 12. BIBLIOGRAFÍA: 1. http://www14.brinkster.com/aleatoriedad/ph.htm. Fecha de última revisión: 11/11/2012. 2. http://cosasdequimicos.blogspot.mx/2009/02/indicador-de-repollo-morado.html. Fecha de última revisión: 29/10/2012. 13. EVALUACIÓN: Evaluación por parte del profesor: _______________ Auto evaluación: (1) _______________ Coevaluación: (2) _____________ (3) _____________ (4) _____________ Auto evaluación: (2) _______________ Coevaluación: (1) _____________ (3) _____________ (4) _____________ Auto evaluación: (3) _______________ Coevaluación: (1) _____________ (2) _____________ (4) _____________ Auto evaluación: (4) _______________ Coevaluación: (1) _____________ (2) _____________ (3) _____________ 3