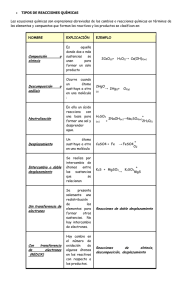
AJUSTE DE ECUACIONES REDOX. Método del ión-electrón. 1. - Ajustar, por el método del ion electrón, la siguiente reacción redox y nombrar todas las sales y ácidos que aparecen en la reacción. - Indicar las especies que actúan como oxidante y como reductor a) FeSO4 + HBrO + H2SO4 HBr + Fe2(SO4)3 + H2O b) KMnO4 + HCl MnCl2 + KCl + Cl2 + H2O c) NaIO3 + Na2SO3 + NaHSO3 I2 + Na2SO4 + H2O d) KBiO3 + Mn(NO3)2 + HNO3 e) Cr2(SO4)3 + K2S2O8 + H2O f) KMnO4 + KCl + H2SO4 Bi(NO3)3 + KMnO4 + KNO3 + H2O H2CrO4 + K2SO4 + H2SO4 MnSO4 + K2SO4 + Cl2 + H2O g) KMnO4 + K2SO3 + HCl MnO2 + K2SO4 + KCl + H2O h) K2Cr2O7 + HI + H2SO4 K2SO4 + Cr2(SO4)3 + I2 + H2O i) P + HNO3 + H2O H3PO4 + NO j) NaNO2 + NaMnO4 + H2SO4 MnSO4 + NaNO3 + Na2SO4 + H2O k) K2Cr2O7 + SnCl2 + HCl SnCl4 + CrCl3 + H2O + KCl l) H2O2 + KMnO4 + H2SO4 O2 (g) + K2SO4 + H2O