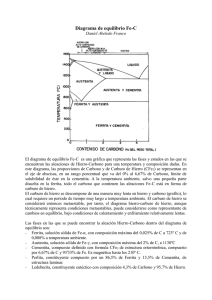
Más del 90% de los materiales metálicos que se emplean, son aleaciones ferrosas. Estas representan un enorme grupo de materiales de ingeniería con amplio rango de microestructuras y sus correspondientes propiedades. La mayor parte de los diseños de ingeniería que requieren del soporte estructural de cargas o de transmisión de potencia, involucran aleaciones ferrosas. Los diferentes materiales metálicos para un mejor aprovechamiento, en algunas ocasiones requieren de tratamientos que puedan conferirles mejores propiedades y adecuarlos de esa manera a los requerimientos provenientes de todos y cada uno de los usos específicos de los mismos. De ahí que en muchos casos estos materiales no sean empleados únicamente en su estado metálico, sino constituyendo aleaciones; es decir, combinaciones de varios de ellos. Sin embargo, en algunos casos aún esto no es suficiente y por ello, tanto los metales como sus aleaciones requieren de ciertos tratamientos a alta temperatura. Es decir, los mismos deben ser sometidos a procedimientos denominados tratamientos térmicos. Para realizar un estudio sistemático de esta temática se dividirá su tratamiento en dos campos fundamentales. Inicialmente se tocará el campo correspondiente al hierro y sus aleaciones y luego se complementará el mismo con el correspondiente a los principales metales no ferrosos y sus aleaciones. EL HIERRO Este material solidifica a 1536°C y sufre tres transformaciones durante su enfriamiento hasta la temperatura ambiente. Desde 1536°C hasta 1392°C, (punto crítico A4) existe en la forma cúbica de cuerpo centrado, o hierro delta. A partir de los 1392°C hasta los 911°C posee la estructura cúbica de cara centrada, llamada hierro gamma. A los 911°C ( punto crítico A3) se transforma en hierro alfa, cambiando su estructura nuevamente a la cúbica de cuerpo centrado. El hierro alfa se convierte en ferromagnético al enfriarse por debajo de los 770°C ( punto crítico A2). La figura 1 muestra estas transformaciones. Los puntos de transformación del hierro se simbolizan con una A (arrêt = detención) y una letra c (chauffage = calentamiento), cuando se producen las transformaciones durante el calentamiento y una letra r ( refroidissement = enfriamiento) si e presentan en el enfriamiento. La figura 2 muestra curvas de temperatura – tiempo, en las que se observan los puntos de transformación del hierro (puntos críticos). Cabe destacar que la aparición y/o desaparición del ferromagnetismo no son más que variaciones de las propiedades del hierro alfa. Los puntos en que se producen estas transformaciones durante el enfriamiento son algo más bajos que aquellos que ocurren en el calentamiento. La diferencia de temperatura que los separa se denomina histéresis térmica y es tanto mayor cuanto más grandes son las velocidades de enfriamiento. Sin embargo, desde el punto de vista tecnológico, el hierro puro no tiene mucha significancia, por lo que en su aplicación es necesario que el mismo se encuentre combinado formando aleaciones. La aleación base más importante es aquella, producto de su combinación con el carbono. De ahí la importancia de profundizar en el estudio de este sistema. EL DIAGRAMA HIERRO – CARBONO Al alearse el hierro con el carbono se desplazan las temperaturas de solidificación y transformación a valores más bajos, tanto mayor es el contenido de carbono. Aparecen también los puntos críticos AC1 y Ar1 que corresponden respectivamente, a la formación de la solución sólida γ a partir de la perlita, o a la descomposición de dicha solución γ en perlita. En el diagrama hierro carbono, figura 3, las líneas continuas y las denominaciones de las estructuras se refieren al sistema metaestable, y las líneas de trazos al estable. En las aleaciones hierro – carbono que no contiene silicio, las transformaciones se realizan según el sistema metaestable y sólo con grandes contenidos de Si y enfriamientos muy lentos se produce la solidificación de las aleaciones en el sistema estable. En el sistema estable no se encuentra el carbono en forma de compuesto o fase cementita, (Fe3C), sino como grafito. Como quiera que el sistema metaestable tiene una mayor importancia práctica, a continuación se enfatizará éste. Las líneas que separan entre sí los distintos campos, son los límites de la transformación de unos constituyentes en otros. Por encima de la línea ABC, todo se encuentra al estado líquido; por lo que esta línea se denomina línea líquidus. Por debajo de ella comienza la solidificación, de la fusión a lo largo de un intervalo de temperaturas. Sólo en el hierro puro y en el caso de la composición eutéctica, (aleación Fe – C con 4.3% de carbono), se produce la solidificación a una temperatura constante; en el caso de la aleación eutéctica se obtiene una estructura del sólida denominada ledeburita, en honor al metalurgista Ledebur. Esta reacción eutéctica procede a 1130°C, temperatura por ello denominada temperatura eutéctica. Salvo las dos excepciones mencionadas, la solidificación se produce en todas las aleaciones a lo largo de un intervalo de temperatura. Por debajo de la línea ABC, se producen primeramente a partir del líquido, soluciones sólidas Fe-C (soluciones delta o gamma), mientras que al alcanzar la línea CE solidifican también cristales de cementita, Fe3C. Por debajo de la línea ABC, se producen primeramente a partir del líquido, soluciones sólidas Fe-C (soluciones delta o gamma), mientras que al alcanzar la línea CE solidifican también cristales de cementita, Fe3C. A lo largo de la línea AHJEC, termina la solidificación, la estructura está constituida debajo de la línea AE por solución sólida gamma; bajo la EC, por solución sólida gamma, cementita secundaria y ledeburita; con mayores contenidos de C, por cementita primaria y ledeburita. Continuando posteriormente las transformaciones en el estado sólido. A continuación, en la figura 4 se presentan por separado ambos sistemas; en la parte superior es sistema metaestable hierro cementita y en la parte inferior el sistema hierro grafito. Figura 4: Diagrama de estado hierro carbono Superior: Sistema metaestable Inferior: Sistema estable DENOMINACION DE LOS CONSTITUYENTES ESTRUCTURALES FERRITA Está constituida por los cristales de hierro alfa o delta (estructura cristalina cúbica de cuerpo centrado) y puede contener 0.10%C a 1492°C, 0.025% a 723°C y menos de 0.006% a la temperatura ambiente. La zona de estabilidad de la ferrita está delimitada en el diagrama de equilibrio por el eje de ordenadas y las líneas GPQ y AHN. AUSTENITA Es el hierro gamma. Cúbico de cara centrada, que puede disolver carbono y otros elementos de aleación. En el diagrama Fe-C se encuentra la región de la austenita pura limitada por el polígono NJESG. A 1130°C puede disolver un máximo de carbono de 2%. El hierro gamma no es magnético. CEMENTITA Es un carburo de hierro con 6.67% de C, es extremadamente dura. Cuando la cementita solidifica, directamente del líquido, se denomina, cementita primaria y cuando la precipitación se produce a partir de cementita secundaria. la austenita se la PERLITA Se denomina a los agregados laminares, formados por láminas alternas de ferrita y cementita. La perlita de equilibrio tiene un contenido de carbono de 0.8%, lo que corresponde aproximadamente al 12% de cementita y al 88% de ferrita. La perlita suele clasificarse según el espesor de sus láminas, en perlita gruesa, perlita fina (antes denominada sorbita), y perlita finísima (antes llamada trostita). La perlita no es una fase, sino una mezcla de fases, y se encuentra en el diagrama de equilibrio por debajo de la línea PKS como denominación de una forma especial de mezcla de los verdaderos constituyentes de equilibrio ferrita y cementita. LEDEBURITA Se denomina así a la estructura eutéctica. MARTENSITA Se conoce con este nombre al producto no estable de transformación de la austenita, que se forma cuando la velocidad de enfriamiento es tan grande que no da tiempo a la formación de perlita. En tanto que en la formación de perlita el carbono disuelto en la red gamma se precipita antes de que ésta se convierta en alfa; en la formación de martensita no hay tiempo para que el carbono salga de la red, por lo que sus átomos quedan atrapados, sobresaturándola, originando tensiones internas elevadas. En este hecho se basa la posibilidad de endurecer los aceros por el procedimiento de temple. EFECTOS DE LOS ELEMENTOS ALEANTES CARBONO Es el elemento aleante más importante, al analizar el diagrama de equilibrio Fe-C, se han mencionado ya los efectos que produce sobre el hierro. SILICIO Sirve para desoxidar el acero y para limitar la segregación de los lingotes. Estrecha la región gamma, por lo que los aceros bajos en carbono y con más de 2% de Si son ferríticos. Al aumentar el contenido de carbono, se hace menos intenso el efecto del Si y la región gamma vuelve a extenderse hacia la derecha. El Si disminuye además el contenido de C de la perlita y desplaza la temperatura de formación de ésta a valores más altos. Favorece la formación de grafito, con lo que disminuyen la resistencia y la templabilidad y se produce con frecuencia fractura negra. Incrementa la resistencia a la tracción, el límite elástico, la dureza, la resistencia mecánica en caliente, la resistencia al desgaste y las resistencias a la corrosión y la formación de cascarilla ( oxidación en caliente). Aminora, la resilencia, la maquinabilidad, la forjabilidad, la densidad, las conductividades eléctrica y térmica y la sensibilidad al sobrecalentamiento. MANGANESO En la fabricación del acero se emplea para la desoxidación y la desulfurización. El manganeso ensancha la región gamma, por lo que los aceros que contienen más del 12% de Mn son austeníticos. Desplaza a valores más bajos la temperatura de formación de la perlita y aminora el contenido de C de ésta. La presencia de Mn incrementa la solubilidad de C en la austenita y con ello favorece la formación de carburos. El Mn aminora las velocidades críticas de enfriamiento del acero, por lo que con más de 3% de Mn, aún el enfriamiento en aire del tratamiento de normalizado produce estructuras bainíticas. Si el contenido es mayor, se llega a suprimir completamente la formación de perlita y bainita y se forma martensita en el enfriamiento en aire. Incrementa: la resistencia a la tracción, el límite elástico, la resistencia a la fatiga, la resistencia al desgaste, la formación de carburos y la dilatación térmica. Aminora: la maquinabilidad, las conductividades térmica y eléctrica, la sensibilidad a la fractura frágil. NIQUEL Es soluble en el hierro y ensancha la región gamma, por lo que los aceros con 1.5% y más del 15% de Ni son completamente austeníticos. Además el níquel desplaza el punto de la perlita a temperaturas más bajas y contenidos de carbono inferiores. CLASIFICACION DE LAS ALEACIONES DE HIERRO Las aleaciones hierro – carbono, pueden ser clasificadas en función del contenido de carbono que poseen. Para ello se las divide inicialmente en dos grandes grupos. Aquellas con contenidos de C entre 0.05% y 2%, se denominan aceros. En tanto que las aleaciones con contenidos comprendidos entre el 2% y el 6.67% de C, se denominan fundiciones. A su vez, los aceros se clasifican en función del punto de la reacción eutectoide, en: Aceros hipoeutectoides: Aquellos con contenidos de carbono menores al 0.8% de C Aceros eutectoides: Aquellos con 0.8% de C exactamente Aceros hipereutectoides: Aquellos con contenidos de carbono entre 0.8% y 2% de C. Por su parte las fundiciones, se subdividen en función de la reacción eutéctica en: Fundiciones hipoeutécticas: Aquellas con contenidos entre 2% y 4.3% de C Fundiciones eutécticas: Aquellas con 4.3% de C exactamente Fundiciones hipereutécticas: Aquellas con contenidos entre 4.3% y 6.67% de C A su vez, los aceros, en función de la cantidad de elementos aleantes que contengan, se pueden clasificar en: Aceros de baja aleación Aceros altamente aleados Aquellos aceros que contienen más del 5% en peso total de adiciones distintas al carbono, se denominan aceros altamente aleados. Las adiciones de estos elementos aleantes, tienen un incremento importante en los costos, que sólo se justifican si con ello se logra aumentar sustancialmente las propiedades tales como resistencia estructural o una mayor resistencia a la corrosión. ACEROS AL CARBONO Y DE BAJA ALEACIÓN La mayor parte de las aleaciones ferrosas corresponden a esta categoría. Esto debido a su precio moderado y a la ausencia de grandes cantidades de elementos aleantes, además de ser lo suficientemente dúctiles para moldearse con facilidad. El producto final es resistente y durable. Sus aplicaciones van desde la producción de cojinetes de bolas hasta las láminas de metal que forman la carrocería de los automóviles. En la tabla siguiente se presenta un sistema de designación de éstos. Este es el sistema AISI ( American Iron and Steel Institute) – SAE ( Society of Automotive Engineers). En este sistema, los dos primeros números dan un código para designar el tipo de adiciones de aleación y los dos o tres últimos números dan el contenido promedio de carbono en centésimas de porcentaje de peso. La nomenclatura se da en tablas o listas que son convenientes pero arbitrarias y por lo general son estandarizadas por organizaciones profesionales. ACEROS DE ALTA ALEACIÓN En los aceros, las adiciones de elementos aleantes, deben ser hechas con cuidado y justificación, debido a que éstas son muy costosas. Por ejemplo, en los aceros inoxidables, se requiere adicionar otros elementos, con el fin de prevenir el daño a ser causado por una atmósfera corrosiva. En éstos la acción más importante se debe al cromo, que por lo general fluctúa entre el 4 y el 10%, excepcionalmente se emplea un 30%. En la tabla siguiente se encuentran cuatro grupos principales de estos tipos de aceros. Los aceros de herramientas requieren de adiciones con el propósito de alcanzar suficiente dureza para aplicaciones de maquinado. Este tipo de aceros se emplean para cortar, moldear o para dar forma a otro material Las llamadas superaleaciones requieren adiciones para proporcionar estabilidad en aplicaciones a alta temperatura como las paletas de las turbinas. Este término se emplea para designar a una amplia variedad de materiales, en especial aquellos con resistencia a alta temperatura. HIERROS FUNDIDOS O FUNDICIONES Se denominan también así a las fundiciones; es decir, aleaciones hierro – carbono con contenidos mayores al 2% de C. Por lo general, estas aleaciones contienen también alrededor del 3% de Si para controlar la cinética de la formación de carburo. Las fundiciones tienen puntos de fusión relativamente bajas, no forman películas indeseables en la superficie cuando se vierten y sufren una contracción moderada durante la solidificación y enfriamiento. Existen cuatro variedades de hierro fundido El hierro blanco, tiene una superficie de fractura cristalina de color blanco. Durante el fundido se forman grandes cantidades de carburo de hierro, Fe3C, dando lugar a un material duro quebradizo. El hierro gris, tiene una superficie de fractura gris con una estructura finamente faceteada. Un contenido significativo de Si ( 2 a 3% en peso), provoca la precipitación de grafito, C, en lugar de cementita, ( Fe3C). Las hojuelas de grafito putiagudas y afiladas contribuyen a la fragilidad característica de este tipo de material. El hierro dúctil, recibe este nombre, debido al mejoramiento de sus propiedades mecánicas. La ductilidad se incrementa en un factor de 20 y la resistencia es del doble. El hierro maleable, primero se funde como hierro blanco y luego se somete a un tratamiento térmico para producir precipitados nodulares de grafito.