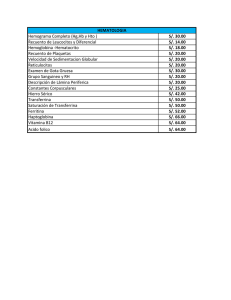
Absorción y metabolismo del Hierro Martín Gustavo Vitale ABSORCIÓN DEL HIERRO Empezamos diciendo que los requerimientos diarios varían con la edad y con algunas circunstancias patológicas y fisiológicas (como el embarazo), pero en un adulto sin deficiencias oscila entre 1 y 2 mg/día. Se absorbe principalmente en el duodeno, a través de mecanismos que vamos a discutir en detalle. El hierro está presente en la dieta de dos formas: como hierro hemo (es decir, el grupo hemo completo, con el Fe adentro), orgánico; y como hierro no-hemo, inorgánico. Sólo los alimentos de origen animal (incluyendo lácteos y huevos) tienen hierro hemo, mientras que los vegetales tienen hierro no-hemo. El hierro hemo se absorbe muy fácilmente: ingresa al enterocito a través de endocitosis mediada por receptor. Por lo tanto decimos que es un hierro "altamente biodisponible". En la dieta de la mayor parte de los seres humanos la cantidad de hierro obtenida del grupo hemo termina siendo una minoría, debido a que la mayoría de las poblaciones no tienen una ingesta abundante y frecuente de carne y otros derivados de origen animal Así que, si queremos mantener la homeostasis del hierro, necesitamos aprovechar bien el hierro que está en su forma más difícil de absorber: el hierro inorgánico. Recordemos lo siguiente: Catión FERROSO - Fe2+ Catión FÉRRICO - Fe3+ El hierro se transporta y se almacena en estado férrico (Fe3+), pero atraviesa las membranas y se utiliza en estado ferroso (Fe2+) El problema principal es que el hierro inorgánico está presente en su mayor parte en estado férrico (Fe3+). Así que... para lograr meterlo dentro del enterocito, ¡necesitamos reducirlo! Hay varios factores que permiten reducir el hierro con facilidad, como ser el pH ácido y la vitamina C... Pero sería completamente imposible lograr absorber una parte significativa del hierro no-hemo si no fuera por una enzima que se encarga de reducirlo de férrico (Fe 3+) a ferroso (Fe2+). ¿Sabés cómo se llama? FERRIREDUCTASA. Una vez reducido por la ferrireductasa ingresa al enterocito a través de un canal que se llama DMT1 (Divalent Metal Transporter), transportador de metales divalentes. Ya te acordaste todo... si el DMT, se llama transportador de metales DIVALENTES, ¡Tiene que atravesar metales divalentes! ¿El hierro férrico es divalente? ¡No, es TRIvalente! Entonces, el hierro que atraviesa la membrana es el ferroso, que fue reducido a este estado por la Ferrireductasa, que se llama como lo que hace. -1- Una vez dentro del enterocito puede seguir dos caminos: a) Almacenarse como FERRITINA, que cuando se encuentra en exceso y almacenando grandes cantidades de hierro se puede ver al microscopio óptico como "grumos pigmentados" de hemosiderina. Cuando se almacena unido a Ferritina, espontáneamente vuelve a su estado original: Fe férrico (Fe3+). b) Salir a la circulación sistémica. Para eso debe atravesar un canal que se encuentra en la membrana basolateral, que se llama FERROPORTINA. Éste canal puede ser bloqueado por una hormona de síntesis hepática, la HEPCIDINA; y este bloqueo constituye el principal mecanismo de regulación del metabolismo del Fe. Ahora... ¿no dijimos que el Hierro se transportaba como férrico (Fe3+)? Existe una última proteína de membrana, la HEFESTINA (por Hefesto, dios griego del metal y del fuego), que se encarga de oxidar el hierro ferroso a férrico para unirlo a su predilecta proteína de transporte: la TRANSFERRINA. Pueden ver el proceso completo en el siguiente gráfico, obtenido de “Disorders of Iron Metabolism” (N Engl J Med 341(26):1986-1995, 1999): -2- -3- Factores que favorecen la absorción: pH ácido Ácido cítrico (incluye la ingesta de limón, naranjas, pomelos, etc) Vitamina C Factores que inhiben la absorción: Fitatos: son compuestos que están habitualmente presentes en las verduras. Por eso algunas verduras como la espinaca tienen cantidades groseras de Hierro... en su mayoría inabsorbibles, porque están quelados ("capturados") por estos fitatos. Taninos, alcaloides: el té, el café, tienen compuestos que también impiden la absorción del Hierro PRESENCIA DE HIERRO EN LA DIETA: A continuación presento dos gráficos obtenidos de la “Guía de Diagnóstico y Tratamiento de Anemia Ferropénica”; Arch Argent Pediatr 107(4):353-361, 2009. Como ven, las carnes rojas son el alimento que más hierro absorbible tiene, si bien las verduras, dijimos, son las que tienen más hierro total. A la hora de pensar si una dieta es -4- rica o pobre en hierro, no nos importa casi nada la "cantidad total" de hierro, sino cuánto podamos absorber. La leche materna es, por lejos, el alimento que más hierro biodisponible tiene de todos; lo cual garantiza que los niños tengan una fuente segura de hierro durante el primer año de vida, en el cual el ingreso de alimentos de otras fuentes es mínimo. Nos sirve para reforzar, además, la importancia de la lactancia materna para una adecuada nutrición del niño. DESTINO DEL HIERRO El hierro se deposita en los siguientes tejidos: Enterocitos, que van a "liberar" este depósito en función de las necesidades del organismo. Macrófagos de la MO, que van a cederlo a la progenie eritrocitaria para la síntesis de hemoglobina. Hígado, que necesita hierro para hacer funcionar los citocromos, enzimas que requieren Hemo como grupo prostético. El hierro no sólo se utiliza en la Hemoglobina, sino en todos los citocromos y en algunos procesos biológicos que se dan en el sistema nervioso central. Por eso, la Anemia Ferropénica es una enfermedad más grave de lo que creen, sobre todo si se da en chicos. Para que se den una idea, a medida que voy perdiendo hierro, el organismo va a seguir diversos pasos: Primero agota los depósitos (lo primero que va a bajar es, entonces, la ferritina sérica) Segundo sacrifica la funcionalidad de los citocromos y de procesos sofisticados del SNC. Tercero, y último, sacrifica la eritropoyesis. Por eso, si en un chico encontramos anemia ferropénica, ¡ya depletó sus depósitos y perdió funcionalidad tanto hepática como neurológica! La anemia es lo último que ocurre en una ferropenia. Una de las principales causas que hay de retraso madurativo en chicos es el déficit nutricional... de hierro. REGULACIÓN DEL METABOLISMO DEL HIERRO El gran concepto acá es que podemos regular la cantidad de Fe que absorbemos en la dieta, pero no la que excretamos: la excreción de Fe es siempre constante, fija, y no es regulable. Eso significa que si tenemos una sobrecarga de Fe ¡no vamos a poder incrementar la excreción para sacarlo de nuestro organismo! -5- Esto permite hacer una gran diferencia con la regulación de la mayoría de los iones en el organismo. Mientras que, como vieron o verán en Fisiología Renal, los cationes como el Sodio y el Potasio se regulan por su excreción (y no por su absorción), el Hierro se regula por su absorción (y no por su excreción). Por este motivo es que existen mecanismos muy estrictos de regulación. En grandes líneas, el gran factor regulador del ingreso de hierro es el mismo depósito de Hierro del organismo, a través de su molécula de transporte: la TRANSFERRINA (Tf). Esta regulación se hace efectiva en dos niveles: intracelular y sistémico. A nivel intracelular, el Fe unido a Tf circulante es captado y endocitado por los Receptores de Transferrina (TfR) presentes en los tejidos que demandan Hierro ¿Cuáles eran esos tejidos? Los que mencionamos antes: Enterocitos, Médula Ósea e Hígado. El Fe intracelular, ahora libre de su proteína transportadora, puede unirse a una serie de proteínas respondedoras al hierro que se llaman, justamente, IREs (Iron Responding Elements). Así, además de usarse para las funciones particulares a cada tejido (síntesis de Hemoglobina, síntesis de citocromos), estos IREs cambian su conformación ante aumentos de la concentración intracelular de Hierro y migran al núcleo, donde modifican el patrón de expresión génica de las células en cuestión. Lo que el complejo Hierro-IRE realice en el núcleo va a depender, a partir de ahora, de la célula de la que estemos hablando: En el duodeno el incremento en los niveles plasmáticos de hierro va a generar, a través del mecanismo descripto anteriormente, la disminución en la expresión génica de todas las proteínas que mencionamos antes, que estaban relacionadas con la absorción de Hierro. Es decir, el complejo Hierro-IRE va a generar la downregulation de los canales DMT, ferrireductasas, Hefestina, etc. Para entender un poco mejor este proceso tenemos que recordar que las células precursoras del enterocito viven en el fondo de las criptas intestinales y van migrando progresivamente hacia la punta de las vellosidades, mientras paralelamente va sintetizando todas las proteínas de transporte y absorción. Una vez que se transforma en el enterocito maduro vellositario vive alrededor de unos diez días y muere. Son justamente estas células precursoras de las criptas las que son sensibles al exceso de hierro, y si se da esa situación ya van modificando el tipo de enzimas que van a expresar cuando sean una célula madura. El siguiente gráfico de “Disorders of Iron Metabolism” (N Engl J Med 341(26):1986-1995, 1999) representa esta situación: -6- Por otro lado, en el hígado también existen IREs, y también modifican el patrón de expresión génica… pero con un sentido totalmente distinto. Ante un incremento en los niveles plasmáticos de Fe, el hígado empieza a sintetizar (nuevamente, como resultado del mecanismo sensor a través de IREs previamente descripto) una hormona llamada HEPCIDINA. Esta hormona viaja a través de la circulación sistémica y bloquea a la FERROPORTINA, que, recordemos, es el canal basolateral del enterocito maduro que permite la salida de Fe hacia la circulación sistémica. De este modo, la Hepcidina logra inhibir la absorción sistémica de Fe; y este es el mecanismo sistémico de regulación de los niveles de Hierro en el organismo. El -7- siguiente gráfico representa esta situación: EVALUACIÓN DEL METABOLISMO DEL HIERRO: LABORATORIO Antes que nada, les dejo acá los valores de laboratorio que más usamos... Puede haber algunas sutiles diferencias con el libro del cual estudien ustedes, es normal; don't worry. Hemograma Hto: Varones 42 a 52 % Mujeres 37 a 47 % Hb: Varones 13 a 17 g/dl Mujeres 12 a 16 g/dl Eritrocitos: Varones 4,5 a 5,5 millones/mm3 Mujeres 4 a 5 millones/mm3 Reticulocitos: 0,5 a 2% VCM: 85 a 95 fl - indica qué volumen ocupa cada glóbulo rojo HCM: 27 a 32 pg - indica cuanta Hb tiene cada glóbulo rojo RDW: 0 a 16% - no es tan importante... nos dice cuán distintos son los tamaños de los GR entre sí Eritrosedimentación: 12 a 15 mm (en una hora). Valor muy inespecífico; básicamente, sepan para la vida que la eritrosedimentación puede aumentar siempre que haya algún proceso inflamatorio agudo o crónico (cáncer, infecciones) -8- Ahora sí, los siguientes cuatro parámetros son los que estudiamos cuando solicitamos un PERFIL FÉRRICO: Ferremia: Varones 70 a 120 ug/dl, Mujeres 60 a 120 ug/dl Ferritina sérica: alrededor de 100 ng/dl CTFH (TIBC, Capacidad Total de Fijación del Hierro): 250 a 400 ug/dl Saturación de Transferrina: 20 a 35 % (siempre da valores inversos a los de CTFH) Estas cuatro pruebas de laboratorio sirven para conocer cómo está el metabolismo y el flujo del Fe en nuestro paciente. Vamos a comentarlas un poco: Las pruebas de laboratorio del hierro se basan en la existencia de dos proteínas muy relevantes: la FERRITINA y la TRANSFERRINA. La Ferritina es la proteína de depósito del hierro... Como el Fe es un metal muy tóxico para el organismo, no se deposita solo, sino unido a esta proteína. De este modo, los tejidos que almacenan hierro en el organismo van a tener concentraciones importantes de esta proteína. Recordemos que estos tejidos son primordialmente tres: Enterocito, que almacena el hierro y lo "libera" al organismo a medida que se hace necesario. Macrófagos de la médula ósea; que como vimos almacenan el hierro necesario para la eritropoyesis. Hígado, que necesita Fe como cofactor de los citocromos, enzimas involucradas en la transformación metabólica de xenobióticos: fármacos, drogas de abuso, productos de la dieta. El hígado, como ya vimos, es también un sensor de los niveles plasmáticos de Hierro. Una parte de esta FERRITINA se "escapa" de las células hacia el plasma, y es lo que podemos medir nosotros. La Ferritina Sérica es un indicador directo de cómo están los depósitos de Hierro: si están altos, habrá Ferritina sérica elevada; si están bajos, estará disminuida. La TRANSFERRINA es la proteína que transporta el Fe. Como ya dijimos, al ser un elemento tóxico para el organismo necesitamos transportarlo de esta manera; no puede circular "libre" por la sangre. La FERREMIA es la prueba de laboratorio que mide la Transferrina que está unida al hierro (¡no la Transferrina libre!). Salvo casos muy especiales, la ferremia aumenta y disminuye por los mismos motivos que la Ferritina sérica: se eleva si hay sobrecarga de hierro, disminuye si hay déficit. Los otros dos valores de laboratorio son menos importantes. La SATURACIÓN DE TRANSFERRINA nos dice qué porcentaje de la Transferrina que está circulando está unida al Fe; parecido a lo que significa la Saturación de Hemoglobina (sin curva alostérica ni nada, no se preocupen!). Por último, la CTFH, o Capacidad Total de Fijación de Hierro, es algo así como la medición de la Transferrina Libre. Es decir: si hay sobrecarga de hierro, gran -9- parte de la transferrina estará unida al hierro... entonces ¡tendrá menos capacidad para fijarla! La CTFH estará baja. Con toda esta información en la cabeza, podemos tratar de contestarnos las siguientes preguntas: 1- ¿Cómo estarán los niveles de Hierro en un paciente que tiene una disminución congénita en la función de los IREs? ¿Qué valores de su Perfil Férrico estarán alterados, y en qué sentido? 2- ¿Qué ocurrirá en otro paciente que tiene un déficit congénito de Hepcidina? ¿Cómo estarán los valores de su Perfil Férrico? ¿Qué diferencia hay entre esta situación y la anterior respecto de los mecanismos fisiológicos de generación del problema? Las dos preguntas anteriores son dos variantes de una enfermedad congénita llamada Hemocromatosis Hereditaria. 3- ¿Qué ocurrirá, en cambio, en un paciente que tiene los niveles de Hepcidina crónicamente elevados? Esto ocurre en una situación altamente frecuente llamada Anemia de los Procesos Crónicos: la hepcidina aumenta en las situaciones de inflamación crónica (ejemplo: infecciones crónicas, enfermedades autoinmunes) con la función adaptativa de evitar que algunos grupos de bacterias utilicen el hierro para su metabolismo. Traten de ver cómo se modifica el metabolismo del hierro en una situación en la cual la Hepcidina estará crónicamente elevada, y cómo estará el Perfil Férrico. Bibliografía Recomendada: Forrellat Barrios M, Gautier du Défaix Gómez H, Fernández Delgado N, Metabolismo del Hierro Rev Cubana Hematol Inmunol 16(3):149-160, 2000 Forrellat Barrios M, Fernández Delgado N, Hernández Ramírez P, Nuevos Conocimientos sobre el Metabolismo del Hierro. Rev Cubana Hematol Inmunol Hemoter 21(3):1561-2996, 2005 Comité Nacional de Hematología, Anemia Ferropénica: Guía de Diagnóstico y Tratamiento. Arch Argent Pediatr 107(4):353-361, 2009 Andrews NC, Disorders of Iron Metabolism. N Engl J Med 341(26):1986-1995, 1999 Camaschella C, Pagani A, Iron and erythropoiesis: a dual relationship. Int J Hematol 93:21–26, 2011 Fleming RE, Ponka P, Iron Overload in Human Disease. N Engl J Med 366(4):348-359, 2012 -10-