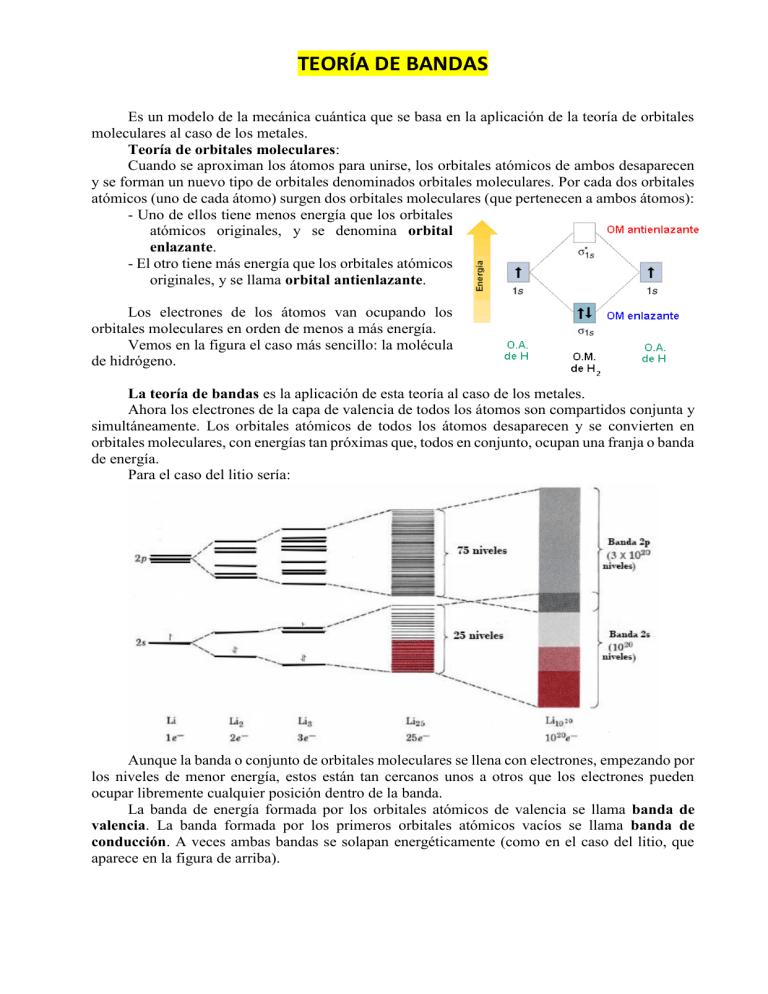
TEORÍA DE BANDAS Es un modelo de la mecánica cuántica que se basa en la aplicación de la teoría de orbitales moleculares al caso de los metales. Teoría de orbitales moleculares: Cuando se aproximan los átomos para unirse, los orbitales atómicos de ambos desaparecen y se forman un nuevo tipo de orbitales denominados orbitales moleculares. Por cada dos orbitales atómicos (uno de cada átomo) surgen dos orbitales moleculares (que pertenecen a ambos átomos): - Uno de ellos tiene menos energía que los orbitales atómicos originales, y se denomina orbital enlazante. - El otro tiene más energía que los orbitales atómicos originales, y se llama orbital antienlazante. Los electrones de los átomos van ocupando los orbitales moleculares en orden de menos a más energía. Vemos en la figura el caso más sencillo: la molécula de hidrógeno. La teoría de bandas es la aplicación de esta teoría al caso de los metales. Ahora los electrones de la capa de valencia de todos los átomos son compartidos conjunta y simultáneamente. Los orbitales atómicos de todos los átomos desaparecen y se convierten en orbitales moleculares, con energías tan próximas que, todos en conjunto, ocupan una franja o banda de energía. Para el caso del litio sería: Aunque la banda o conjunto de orbitales moleculares se llena con electrones, empezando por los niveles de menor energía, estos están tan cercanos unos a otros que los electrones pueden ocupar libremente cualquier posición dentro de la banda. La banda de energía formada por los orbitales atómicos de valencia se llama banda de valencia. La banda formada por los primeros orbitales atómicos vacíos se llama banda de conducción. A veces ambas bandas se solapan energéticamente (como en el caso del litio, que aparece en la figura de arriba). En los metales, sustancias conductoras, la banda de valencia está o semillena (como el caso del litio), o bien llena, pero solapada con la banda de conducción que está vacía (como el caso del magnesio). En ambos casos los electrones disponen de orbitales vacíos que pueden ocupar con un mínimo aporte de energía, son electrones casi libres y por eso los metales son muy buenos conductores eléctricos. En los semiconductores y en los aislantes, la banda de valencia está llena y la de conducción vacía, pero no solapan. Hay una zona intermedia, llamada banda prohibida, que no puede alojar electrones. En los semiconductores, como el Si y el Ge, la anchura de la banda prohibida no es muy grande, y siempre hay electrones con energía cinética suficiente para promocionarse a la banda de conducción. Estos electrones, no muchos, y los huecos positivos que han dejado en la banda de valencia, permiten cierta conductividad eléctrica. Sin embargo, en los aislantes, como por ejemplo el diamante (C) y del óxido de silicio (SiO2), la banda prohibida es tan ancha que ningún electrón puede saltarla. La banda de conducción está siempre vacía y la de valencia siempre llena. No hay cargas libres y el sólido no conduce la corriente, aunque apliquemos un campo eléctrico externo.