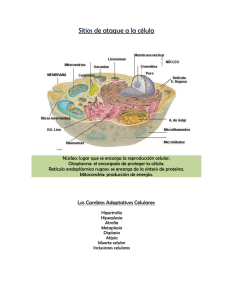
PATOLOGÍA CELULAR Introducción Homeostasis: Mecanismos que mantienen constantes las condiciones del medio interno de un organismo, a pesar de grandes oscilaciones en el medio externo. Enfermedad de Parkinson: Comparación en tinte, evidencia la disminución de la actividad de los receptores de dopamina; Se atribuye a muerte de neuronas mesencefálicas productoras de dopamina. ¿Por qué las células se enferman?: Adaptación y Lesión Celular LESIÓN CELULAR: Variedad de situaciones de estrés que una célula encuentra como resultado de cambios en su entorno interno y externo. Cuando la célula no puede adaptarse a la exposición o al agente lesivo (o este perdura), la lesión celular es producida. Lesión reversible: Las alteraciones o daños provocados por una noxa, pueden ser compensados y provocar cambios transitorios, los cuales se detienen una vez cesa la acción de la noxa. Lesión irreversible: Si los mecanismos de adaptación son superados se produce daño celular permanente, irrecuperable y letal, siendo este tipo de daño una antesala a la muerte celular. Pueden ser de 2 tipos: Apoptosis: Programada, fisiológica/inducida. Necrosis: Patológica, genera procesos inflamatorios. ETIOLOGÍA: Se desarrolla con 2 mecanismos principales. Genéticos: Proteínas expresadas de manera inadecuada (tratado detalladamente próxima clase). Adquiridos: o Hipoxia e isquemia: La hipoxia interfiere en la respiración oxidativa aerobia, siendo una causa común de lesión celular. Por su parte, la isquemia es la causa más común de hipoxia. o Agentes físicos: Traumatismos, T° extremas, radiación, descargas eléctricas, cambios súbitos en la presión atmosférica. o Químicos y drogas: Sustancias que alteren la homeostasis, permeabilidad de membrana, contaminantes, insecticidas, CO, etanol, oxígeno, etc. o Agentes microbianos: Desde virus a Tenias, rickettsias, bacterias, hongos y protozoos. o Agentes inmunológicos: Reacciones autoinmunes y alérgicas. o o Trastornos nutricionales: Insuficiencia proteico-calórica, vitamínicas, trastornos nutricionales, etc. Envejecimiento: Senescencia celular. Hipertrofia Es el aumento del tamaño de las células, que conlleva al aumento del tamaño del órgano. Las células que son capaces de dividirse pueden responder ante el estrés con hiperplasia e hipertrofia, mientras que las células incapaces de dividirse (p. ej., las fibras miocárdicas) sólo pueden aumentar su masa tisular mediante hipertrofia. La hipertrofia puede ser fisiológica o patológica, y se debe a un aumento de las exigencias funcionales o la estimulación por hormonas o factores de crecimiento. El estímulo más habitual para la hipertrofia muscular es el aumento del esfuerzo. Mecanismos de la hipertrofia: Es consecuencia de un aumento de proteínas celulares; Se puede inducir por las acciones coordinadas de mecanismos biomecánicos, neuro-humorales, factores de crecimiento, citocinas, quimiocinas y agentes vasoactivos (agonistas aadrenérgicos, ET 1 y Ang II). Las dos vías bioquímicas más importantes implicadas en la hipertrofia muscular son: o Fosfoinositol 3-cinasa/Akt: Se considera la más importante en condiciones fisiológicas, como la hipertrofia por ejercicio. o Señales distales de los receptores acoplados a la proteína G: Se inducen por muchos factores de crecimiento y agentes vasoactivos, que se consideran más importantes en la hipertrofia patológica. Ejemplo: Hipertrofia cardiaca: concéntrica (aumento del tamaño de las células, debido a un mayor esfuerzo generado por aumento del “Volumen de Eyección”, sin embargo, de manera compensatoria el espacio ventricular se ve disminuido, por ende, el corazón aumenta la FC, para así bombear más sangre) y excéntrica. Atrofia Es una reducción del tamaño de un órgano o tejido secundario a una reducción del tamaño y el número de células. La atrofia puede ser fisiológica o patológica. La atrofia fisiológica es bastante común, un ejemplo de atrofia fisiológica es la que sufre el útero luego del parto. En cambio, la atrofia patológica depende de la causa de base y puede ser local o generalizada. Las causas frecuentes de atrofia son las siguientes: o Desuso: Ej. Inmovilización del usuario. La reducción inicial del tamaño celular es reversible cuando se reinicia la actividad. Cuando el desuso es más prolongado, disminuye el tamaño y n° de fibras musculares esqueléticas (por apoptosis). Se puede asociar a un aumento de la reabsorción ósea. o Denervación: El metabolismo y fisiológica del músculo esquelético dependen de la inervación. Las lesiones nerviosas determinan una atrofia de las fibras musculares esqueléticas inervadas. o Reducción de la irrigación: La isquemia como consecuencia de una enfermedad oclusiva arterial de lento desarrollo determina la atrofia del tejido. o Nutrición inadecuada: Una malnutrición proteico-calórica importante (ej. Marasmo) se asocia al uso del músculo esquelético como fuente energética cuando las otras reservas (tejido adiposo) se han agotado. o Pérdida de estimulación endocrina: Tejidos como la mama y órganos reproductores, dependen de la estimulación endocrina para su homeostasis. Ej. La pérdida de estimulación estrogénica tras la menopausia determina una atrofia fisiológica del endometrio, epitelio vaginal y mama. o Presión: La compresión tisular (cualquier duración) puede ser causa de atrofia. Ej. Un tumor benigno puede provocar atrofia de los tejidos sanos que lo rodean. Hiperplasia Puede ser fisiológica o patológica. o Tipos de hiperplasia fisiológica: 1) la hiperplasia hormonal, ej. proliferación epitelio-glandular de la mama femenina en la pubertad y durante el embarazo, y 2) la hiperplasia compensadora, es decir, la que se produce cuando una porción del tejido es eliminada o está enferma. Ej. Cuando se realiza una resección parcial del hígado, la actividad mitótica en las células restantes comienza ya a las 12h, restableciendo a la larga el peso normal del hígado. o Tipos de hiperplasia patológica: Mayoritariamente están causadas por una estimulación excesiva ya sea de tipo hormonal o de factores de crecimiento. Ej. Después de un período menstrual normal hay un brote de proliferación epitelial uterina, estimulada por hormonas hipofisarias y estrógenos ováricos, e inhibida por la progesterona. Sin embargo, si se altera el equilibrio entre el estrógeno y la progesterona, se produce una hiperplasia endometrial, causa común de un sangrado menstrual anómalo. El proceso hiperplásico es controlado; si cede la estimulación hormonal o de los factores de crecimiento, desaparece la hiperplasia. Es esta sensibilidad a los mecanismos reguladores normales lo que distingue las hiperplasias patológicas benignas del cáncer, en el que los mecanismos del control del crecimiento se vuelven desregulados o inefectivos. Metaplasia La metaplasia es un cambio reversible en el que un tipo de célula adulta (epitelial o mesenquimatosa) es sustituido por otro tipo de célula adulta. En este tipo de adaptación celular, las células sensibles a un estrés particular son sustituidas por otros tipos celulares con mayor capacidad de resistir el entorno adverso. La metaplasia epitelial se ve ejemplificada por el cambio escamoso que se produce en el epitelio respiratorio en los fumadores habituales. Las células epiteliales cilíndricas ciliadas normales de la tráquea y de los bronquios son sustituidas focal o ampliamente por células epiteliales escamosas estratificadas. Displasia Crecimiento y maduración desordenados de los componentes celulares de un tejido. Causas: o Variaciones del tamaño y forma de la célula. o Disposición desordenada de las células del epitelio. Acumulaciones Intracelulares Representan la acumulación de sustancias que las células no pueden usar o eliminar inmediatamente, acumulándose en el citoplasma, orgánulos y núcleo. Se desarrolla por 4 vías: o Eliminación inadecuada de sustancias, por fallas en mecanismos de empaquetado y transporte, ej. Esteatosis hepática. o Acumulación endógena de sustancias anómalas, debido a errores genéticos y/o adquiridos en el plegamiento, empaquetado, transporte o secreción. o Defecto hereditario de una enzima Mecanismos de Lesión Celular Son complejos y múltiples Las reacciones de las células a una noxa dependen del tipo de noxa, su duración e intensidad. El tipo, estado y adaptabilidad de la célula afectada también determinan las consecuencias del daño. Depleción de ATP: Se requiere de fosfato de alta energía en forma de ATP y totalidad de los procesos de síntesis y degradación que ocurren en el interior de la célula, como son el transporte a través de la membrana, la síntesis de proteínas, la lipogenia y las reacciones de desacilación-reacilación necesarias para el recambio de fosfolípidos. Se produce una disminución de la actividad de las Na+ y Ca++ATPasa, por ende, habrá un aumento intracelular de Ca++ y Na+, además de egreso de K, asimismo hinchazón celular y la dilatación del RE. Aumento compensador en la glucólisis anaerobia con el fin de mantener las fuentes de energía de la célula. En consecuencia, se consumen rápidamente los depósitos intracelulares de glucógeno y se acumula ácido láctico, lo que lleva a una disminución del pH intracelular y a una menor actividad de muchas enzimas celulares. La depleción del ATP prolongada o empeorada causa una desestructuración del aparato sintético de proteínas, que se manifiesta en forma de desprendimiento de los ribosomas del RER y de una disociación de polisomas en monosomas, con la consiguiente reducción en la síntesis de proteínas. En último término, se produce un daño irreversible en las membranas mitocondriales y lisosómicas, y las células sufre necrosis. Lesión y disfunción mitocondrial: Las mitocondrias resultan sensibles a muchos tipos de estímulos lesivos, como la hipoxia, toxinas químicas y radiación. Las alteraciones mitocondriales pueden ocasionar varios cambios bioquímicos: o El fallo de la fosforilación oxidativa condiciona el progresivo agotamiento del ATP, que culmina en la necrosis de la célula. o Las alteraciones de la fosforilación oxidativa también condicionan que se formen especies reactivas de oxígeno, con muchos efectos perniciosos. o El daño mitocondrial se suele asociar a un canal llamado “poro de transición de permeabilidad mitocondrial”. La apertura de este canal determina la pérdida del potencial de membrana mitocondrial y cambios del pH, lo que altera todavía más la fosforilación oxidativa. o En las mitocondrias también existen distintas proteínas, cuya liberación hacia el citoplasma avisa a las células de la existencia de lesiones internas y activa una vía de apoptosis. Acumulación de radicales libres derivados del oxígeno (estrés oxidativo): Estos estados químicos son extraordinariamente inestables y reaccionan fácilmente con sustancias químicas inorgánicas y orgánicas; Atacan ADN, proteínas, y lípidos celulares. Además, los radicales libres dan comienzo a reacciones auto catalíticas, propagando así la cadena de daño. Las especies reactivas del oxígeno (ERO), son un tipo de radical libre derivado del O2. En condiciones normales, las ERO, se producen en pequeña cantidad en todas las células durante las reacciones redox, como resultado de esta reacción se produce super óxido, peróxido de hidrógeno, etc. Las lesiones ocasionadas por los radicales libres dependen de la velocidad con que se producen y eliminan. Cuando la producción de ERO aumenta o el sistema de eliminación resulta ineficaz, se observa un exceso de estos radicales libres, situación conocida como estrés oxidativo. Las ERO, provocan lesiones celulares mediante tres mecanismos principalmente: o Peroxidación lipídica de las membranas: Los enlaces dobles en los lípidos poliinsaturados de la membrana son vulnerables al ataque por los radicales libres derivadas del oxígeno. Las o o interacciones de los radicales con los lípidos producen peroxidasas, que son inestables y reactivas, y a continuación, tiene lugar una reacción autocatalítica en cadena. Enlaces y otros cambios entre proteínas: Los radicales libres promueven los enlaces cruzados de las proteínas por mediación de sulfhidrilos, lo que da lugar a un aumento de la degradación o de pérdida de la actividad enzimática. Las reacciones de los radicales libres pueden también causar de modo directo fragmentación de polipéptidos. Fragmentación del ADN: Las reacciones de los radicales libres con la timina en el ADN nuclear y mitocondrial producen roturas en las cadenas sencillas. Se ha implicado este daño del ADN en la muerte, el envejecimiento y la transformación maligna de las células. Apoptosis Es una vía de muerte celular en la que células activan enzimas capaces de degradar su propio ADN, así como proteínas nucleares y citoplásmicas. La apoptosis se produce en muchas situaciones fisiológicas y sirve para eliminar células potencialmente dañinas y otras que han sobrevivido a su utilidad. Asimismo, es un acontecimiento patológico cuando las células son dañadas más allá de una posible reparación, sobre todo cuando el daño afecta al ADN o a las proteínas de la célula; en estas situaciones, la célula dañada irreparablemente es eliminada. El acontecimiento fundamental en la apoptosis es la activación de las caspasas y esta depende de un equilibrio muy bien ajustado entre las vías moleculares proapoptósicas y antiapoptósicas. Convergen dos vías en la activación de las caspasas, mitocondrial y de los receptores de muerte. Vía mitocondrial (intrínseca) de la apoptosis: Las mitocondrias contienen varias proteínas capaces de inducir la apoptosis, por ejemplo, citocromo c, además de otras proteínas que neutralizan los inhibidores endógenos de la apoptosis. La permeabilidad de las mitocondrias es decisiva y es controlado gracias a una familia de proteínas, siendo la más importante la Bcl-2. Cuando las células son privadas de los factores de crecimiento u otras señales de supervivencia, o se exponen a sustancias que provocan daños en el ADN, o acumulan una cantidad inaceptable de proteínas mal plegadas, se activan una serie de sensores. Vía de los receptores de muerte (extrínseca) de la apoptosis: Muchas células expresan receptores de muerte (perteneciente a los TNF), que desencadenan la apoptosis. Los receptores de muerte proapoptósicos son el receptor de tipo I para TNF y Fas (CD95). Fas-ligando (FasL) es una proteína de membrana expresada principalmente en los linfocitos T activados. Cuando estos linfocitos T reconocen dianas que expresan Fas, las moléculas Fas se entrecruzan por FasL, y se unen a proteínas adaptadoras, que a su vez se unen a la caspasa 8. En muchos tipos celulares, la caspasa 8 puede cortar y activar un miembro proapoptósico de la familia Bcl-2 denominado Bid, alimentando así la vía mitocondrial. La activación combinada de ambas vías asesta un golpe letal a la célula. Las proteínas celulares, en especial una antagonista de las caspasas denominada FLIP, bloquean la activación de las caspasas en fases posteriores de los receptores de muerte. Necrosis Se refiere a la muerte celular en un órgano o tejido que aún es parte de un organismo vivo. Se diferencia de la Apoptosis, ya que, provoca la pérdida de la integridad de la membrana celular y descomposición enzimática de las partes celulares, generando el proceso inflamatorio, además de interferir con el reemplazo celular y la regeneración de tejido. Es desencadenado por toxinas, hipoxia, severa, agresión masiva y cualquier otra condición que genere caída de ATP. Cambios principalmente histológicos: desorganización y lisis del citoplasma, dilatación del RE y mitocondrias, disolución de cromatina además de pérdida de la continuidad de la membrana citoplásmica. Producto de la pérdida de continuidad, el material del citoplasma se vierte al espacio extracelular, esto genera “atracción” de las células inmunes, generando así inflamación. Gangrena: Tipo de manifestación clínica de la necrosis, potencialmente mortal; Se desarrolla cuando hay un grado avanzado de tejido muerto en el cuerpo.