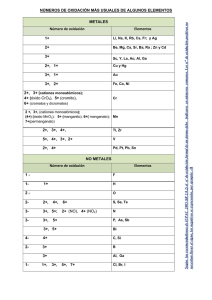
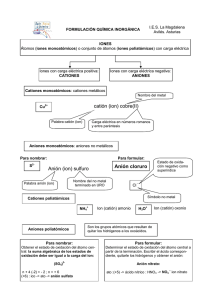
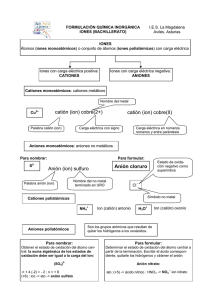
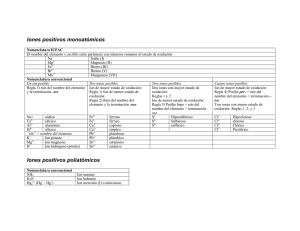
NOMENCLATURA QUÍMICA INORGÁNICA 2019 M. E. Guadalupe Monserrat Torres Quiroz Ing. Víctor Manuel Feregrino Hernández Ing. José Clemente Reza García M. C. Laura Rocío Ortiz Esquivel Dra. Ma. Elena Navarro Clemente Departamento de Formación Básica Contenido NOMENCLATURA QUÍMICA .................................................................................................................. 3 INTRODUCCIÓN .................................................................................................................................. 3 1.- CONCEPTOS PREVIOS ................................................................................................................. 4 2.- NOMBRES Y SÍMBOLOS DE LOS ELEMENTOS QUÍMICOS ..................................................... 5 EJERCICIOS PROPUESTOS .......................................................................................................... 6 3.- TABLA PERIÓDICA ....................................................................................................................... 8 4.- MOLÉCULAS HOMONUCLEARES. .............................................................................................. 9 5.- CATIONES MONOATÓMICOS .................................................................................................... 11 6.- ANIONES MONOATÓMICOS....................................................................................................... 12 EJERCICIOS PROPUESTOS ........................................................................................................ 13 7.- COMPUESTOS QUÍMICOS INORGÁNICOS ............................................................................... 16 8.- HIDRÓXIDOS ................................................................................................................................ 17 9.- ÓXIDOS METÁLICOS .................................................................................................................. 17 10.- PERÓXIDOS ............................................................................................................................... 18 11.- SUPERÓXIDOS .......................................................................................................................... 18 12.- ÓXIDOS NO METÁLICOS .......................................................................................................... 18 EJERCICIOS PROPUESTOS ........................................................................................................ 19 13.- SALES BINARIAS ...................................................................................................................... 20 EJERCICIOS PROPUESTOS ........................................................................................................ 22 14.- HIDRÁCIDOS .............................................................................................................................. 23 15.- NOMBRES TRIVIALES .............................................................................................................. 24 EJERCICIO PROPUESTO ............................................................................................................. 24 16.- ANIONES OXIGENADOS ........................................................................................................... 25 EJERCICIOS PROPUESTOS ........................................................................................................ 27 17.- SALES OXIGENADAS ............................................................................................................... 28 EJERCICIOS PROPUESTOS ........................................................................................................ 30 18.- OXIÁCIDOS................................................................................................................................. 32 19.- OTROS ÁCIDOS OXIGENADOS ............................................................................................... 33 EJERCICIOS PROPUESTOS ........................................................................................................ 36 2 NOMENCLATURA QUÍMICA INTRODUCCIÓN La NOMENCLATURA química consta de las reglas y recomendaciones que nos permiten asignar un nombre y una fórmula (representación simbólica) a cada una de las sustancias químicas. A diferencia de otras disciplinas, la nomenclatura química plantea reglas para la asignación de nombres y fórmulas que se han modificado con el tiempo y se seguirán modificando a medida que se obtengan nuevos compuestos o se establezcan acuerdos internacionales para designar a los ya existentes. Las reglas o recomendaciones de nomenclatura actuales provienen de los acuerdos internacionales tomados en una asociación mundial de químicos, denominada International Union of Pure and Applied Chemistry, conocida como IUPAC, por sus siglas en inglés. Al margen de las reglas emitidas por la IUPAC, la nomenclatura química es tolerante con los nombres que se han arraigado y que persisten, en la mayoría de los casos, a nivel comercial. El nombre y la fórmula que se da a una sustancia química, la debe distinguir con claridad y sin ambigüedad de todas las otras sustancias que se conocen. El objetivo de este material, es presentar de una manera resumida, fácil y práctica, la nomenclatura de Química Inorgánica, siguiendo las reglas y recomendaciones de la IUPAC con el propósito de desarrollar un sistema lógico y metódico de dicha nomenclatura. Cabe mencionar que, en algunos casos, los compuestos utilizados en los ejemplos son hipotéticos, pero que ilustran la aplicación de las recomendaciones. El docente de Química reconoce lo complicado que resulta para el estudiante aprender sistemáticamente los distintos nombres y fórmulas de los compuestos, ya que los métodos tradicionales para el aprendizaje de la nomenclatura son demasiado elaborados. Una ventaja de este material es que el estudiante aprenderá a nombrar y escribir las fórmulas de muchos compuestos rápidamente y sin exceso de cansadas reglas memorísticas, considerando que en la ciencia todo tiene un orden y una aplicación lógica. El ejercicio constante de las recomendaciones de la IUPAC sobre la nomenclatura química, permitirá comprender e incorporar el “vocabulario” básico de este lenguaje, adoptado en todo el mundo. De manera similar a la situación de aprendizaje de un nuevo idioma, en una primera etapa se presentan las “letras”, que en nuestro caso son los símbolos de los elementos, para continuar con las “palabras” y “oraciones”; cuya contraparte son las fórmulas de los compuestos y las ecuaciones de las reacciones. En cada sección se presentan las recomendaciones establecidas y se dan ejemplos de las mismas, al final de cada sección, se incluye un grupo de ejercicios propuestos, mismos que podrán modificarse para ampliar las oportunidades de aplicación de los temas presentados. En algunos casos aparece una zona sombreada, en la que se muestra la manera en que se sugiere resolver el ejercicio. 3 1.- CONCEPTOS PREVIOS La base de la nomenclatura de los COMPUESTOS químicos reside necesariamente en los nombres de los ELEMENTOS que constituyen dichos compuestos. Por otra parte, la expresión gráfica de un compuesto por medio de una fórmula se realiza por medio de los SÍMBOLOS de los elementos que lo constituyen. ELEMENTO.- Son sustancias puras que no pueden descomponerse en otras más simples. Para representar a los elementos se emplea un conjunto de símbolos. SÍMBOLOS.- Letra o grupo de dos letras que representa a un elemento. Estos símbolos se forman comúnmente con una o dos letras tomadas del nombre del elemento. La primera (o única) letra se escribe con mayúscula. Ejemplo: Hidrógeno Carbono Boro (H) (C) (B) Oxigeno Nitrógeno Vanadio (O) (N) (V) Cuando los nombres de varios elementos empiezan con la misma letra, su símbolo específico se formará con dos letras, la primera letra de su nombre, escrita con mayúscula y la segunda o bien una letra intermedia, escrita con minúscula Ejemplos: Calcio Cadmio (Ca) (Cd) Cobalto Cesio (Co) (Cs) Cromo (Cr) Cloro (Cl) Algunos símbolos se toman de los nombres de los elementos en otro idioma como el latín ó el griego, y el tungsteno, W de la palabra en alemán Wolfram, por lo que no existe una correspondencia directa del símbolo con el nombre. Ejemplos: Sodio Plata (Na) (Ag) Azufre Potasio (S) (K) Cobre (Cu) Fósforo (P) Los nombres de los elementos pueden variar al ser pronunciados en diferentes idiomas, por lo que con frecuencia se añaden u omiten letras que faciliten la pronunciación. En todo caso, será necesario recordar las raíces del nombre original para establecer la relación entre nombre y símbolo. El reconocimiento de los símbolos de los elementos es una habilidad que debe desarrollarse de manera similar que lo requiere el aprendizaje de las letras de un nuevo alfabeto. Al principio será necesario apoyarse en la memoria y posteriormente, el reconocimiento será inmediato. A continuación se encontrará un listado de los elementos conocidos, así como sus símbolos aceptados: 4 2.- NOMBRES Y SÍMBOLOS DE LOS ELEMENTOS QUÍMICOS Número atómico 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 Nombre Símbolo Hidrógeno Helio Litio Berilio Boro Carbono Nitrógeno Oxígeno Flúor Neón Sodio Magnesio Aluminio Silicio Fósforo Azufre Cloro Argón Potasio Calcio Escandio Titanio Vanadio Cromo Manganeso Hierro Cobalto Níquel Cobre Zinc* Galio Germanio Arsénico Selenio Bromo Kriptón* Rubidio Estroncio Itrio Zirconio* Niobio H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Número atómico 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 Nombre Símbolo Molibdeno Tecnecio Rutenio Rodio Paladio Plata Cadmio Indio Estaño Antimonio Telurio Yodo* Xenón Cesio Bario Lantano Cerio Praseodimio Neodimio Prometio Samario Europio Gadolinio Terbio Disprosio Holmio Erbio Tulio Iterbio Lutecio Hafnio Tantalio Tungsteno Renio Osmio Iridio Platino Oro Mercurio Talio Plomo Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb 5 83 84 85 86 87 88 89 90 91 92 93 94 95 96 Bismuto Polonio Astato Radón Francio Radio Actinio Torio Protactinio Uranio Neptunio Plutonio Americio Curio Bi Po At Rn Fr Ra Ac Th Pa U Np Pu Am Cm 97 98 99 100 101 102 103 104 105 106 107 108 109 Berkelio Californio Einstenio Fermio Mendelevio Nobelio Laurencio Rutherfordio Dubnio Seaborgio Bohrio Hassio Meitnerio Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt * Elementos en cuyo nombre, la letra inicial se puede sustituir por la correspondiente letra en castellano. EJERCICIOS PROPUESTOS 1.- Escribe el nombre del elemento que corresponde al símbolo que se presenta: Te _____________ Al ______________ Ga _____________ Na ______________ Mg _____________ S ______________ Cs _____________ Zn ______________ Ag _____________ O ______________ 2.- Escribe el símbolo de los elementos cuyo nombre aparece en la siguiente lista: Bismuto Cadmio Cobre Antimonio Mercurio _________ _________ _________ _________ _________ Molibdeno Potasio Bromo Platino Manganeso _________ _________ _________ _________ _________ 3.- Escribe el nombre y el símbolo de todos los elementos cuyo nombre en castellano empiece con la letra T. 4.- Escribe el nombre y el símbolo de todos los elementos cuyo símbolo comience con la letra C. 6 5.- Relaciona el nombre del elemento de la columna de la izquierda con el símbolo del mismo en la columna derecha: 1. Plutonio 2. Renio 3. Fósforo 4. Manganeso 5. Arsénico 6. Estroncio 7. Estaño 8. Cobalto 9. Berilio 10. Nitrógeno 11. Cloro 12. Azufre 13. Vanadio 14. Silicio 15. Carbono 16. Cromo 17. Potasio 18. Hierro 19. Antimonio 20. Plata ( ( ( ( ( ( ( ( ( ( ( ( ( ( ( ( ( ( ( ( ) ) ) ) ) ) ) ) ) ) ) ) ) ) ) ) ) ) ) ) Si S Cl Sr Pu C Re V Cr Fe P Sn As Co N Be Ag Sb K Mn 6.- Escribe el nombre de todos los elementos cuyo símbolo pueda obtenerse por la combinación adecuada (mayúscula y/o minúscula) de las letras A, S, C y R 7.- Elabora una lista de aquellos elementos que no presenten una relación directa entre su nombre y su símbolo 8.-Selecciona un texto de una cuartilla de extensión en el periódico o en alguna revista. Señala con un marcatextos las palabras que se encuentran al inicio de cada oración o nombres propios. Enlista aquellas palabras cuya primera letra o primeras dos letras corresponden al símbolo de un elemento químico. Anota a continuación el símbolo y el nombre del elemento identificado en cada palabra. NOTA: Es necesario que respetes las recomendaciones para la escritura de los símbolos. 7 9.- Encuentra los nombres de quince elementos y anota su símbolo: M N B V C S F G R T P U I O P A E R N I A A O E O E L E O L L R D S L R I E I O R F R A S M I C A A T R O D I O T R Q M G P I G U A T T M N E O Q M O I E C F O W N L G O L I O A E N I R G H S E C L A V E F E L N Q M R E U D R D I O E A M N O L R R O I M I G A L A O I R N A L C L A N I M U T R I S U R N Z C A U B C R E C A N F E R X N I O N A O U E O N I R O S O C C L O M I N A X V I G F G E O N O T A P L A G S O I T R O D O U R A M O I Q O U E L E G A M E N P L E S C E C R A B I S F A N T E X O A C I N P A S E F G H S A V L O I R U C R E M A G N E S I O E A C E S O D I O B R I E S I O M H N I P T L A C A G E N I C N E T A N S T I O 1.- ___________ 2.- _________ 3.- ________ 4.- ___________ 5.- _________ 6.- ________ 7.- ___________ 8.- _________ 9.- ________ 10.- __________ 11.- ________ 12.- _______ 13.- __________ 14.- ________ 15.- _______ P O A G O V A L E C A R R A S Z E R F R O P L I M E R O I R U L E T N X I O D E C A S L S I M C E G R R N O T A B A N C O M P A N E R I O I N S T R A M E D H H 3.- TABLA PERIÓDICA Si los elementos se acomodan en orden creciente de su NÚMERO ATÓMICO (número igual al de protones en el núcleo del átomo del elemento), se encuentra que sus propiedades químicas y físicas muestran un patrón repetitivo, periódico. El acomodo de los elementos en este orden se conoce como TABLA PERIÓDICA como la que se muestra a continuación: 8 IA 1 IIA IIIB IVB VB VIB VIIB VIIIB IB IIB IIIA IVA VA VIA VIIA VIIIA 2He H 3Li 4Be 11Na 12Mg 19K 20Ca 37Rb 38Sr 5B 21Sc 39Y 22Ti 40Zr 7N 8O 9F 10Ne 18Ar 13Al 14Si 15P 16S 17Cl 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn 31Ga 32Ge 33As 34Se 35Br 36Kr 41Nb 42Mo 43Tc 44Ru 45Rh 46Pd 47Ag 48Cd 49In 50Sn 51Sb 52Te 53I 54Xe 75Re 76Os 77Ir 78Pt 79Au 80Hg 82Pb 83Bi 84Po 85At 86Rn 55Cs 56Ba 57-71 72Hf 73Ta 74W 87Fr 88Ra 89-103 104Ku 105Ha 106Mt 6C 81Tl 57La 58Ce 59Pr 60Nd 61Pm 62Sm 63Eu 64Gd 65Tb 66Dy 67Ho 68Er 69Tm 70Yb 71Lu 89Ac 90Th 91Pa 92U 93Np 94Pu 95Am 96Cm 97Bk 98Cf 99Es 100Fm 101Md 102No 103Lw Los elementos en una columna de la tabla periódica se conocen como Familia o Grupo, y presentan similitudes en sus propiedades físicas y químicas. Los grupos de la tabla periódica se designan con un número romano seguido de la letra A (elementos representativos) ó B (elementos de transición). Existe otra nomenclatura para los grupos, la cual consiste en numerarlos en forma consecutiva de izquierda a derecha. Así, se tendrán grupos desde el 1 hasta el 18. Una línea escalonada que va desde el boro (B) hasta el astato (At), separa a los METALES de los NO METALES (sombreado). Todos los elementos que están del lado izquierdo de esa línea en la tabla periódica (excepto el hidrógeno, H) son METALES. El Hidrógeno, por su comportamiento químico, se considera un no metal, a pesar de que se ubica en el primer grupo. Los metales tienen lustre y alta conductividad térmica y eléctrica. Todos los metales son sólidos a temperatura ambiente de 25ºC, excepto el mercurio (Hg). Cabe mencionar que el cesio (Cs), el galio (Ga) y el francio (Fr), se encuentran en forma líquida a temperaturas ligeramente mayores: 28.5, 29.8 y 27ºC, respectivamente. En cambio, los no metales existen en cualquier estado de agregación a temperatura ambiente y no son buenos conductores del calor y la electricidad. Los semimetales o metaloides tienen propiedades semejantes a ambos tipos de elementos y son los elementos que se encuentran cercanos a la línea escalonada. La ubicación de un elemento en la tabla periódica proporciona información útil para predecir el comportamiento químico que tendrá y el tipo de compuestos que puede formar cuando se combine con otros elementos. 4.- MOLÉCULAS HOMONUCLEARES. Son las formadas por un solo tipo de átomos en número determinado. De acuerdo con esto, la fórmula de la molécula homonuclear consta del símbolo de dicho elemento, indicando el número de átomos asociados para formar la molécula, mediante un índice que se anota a la derecha en forma de subíndice. 9 Ejemplos: El elemento oxígeno se escribe: La molécula de oxígeno se escribe: La molécula de ozono se escribe: El elemento cloro se escribe: La molécula de cloro se escribe: O O2 O3 Cl Cl2 Generalmente las moléculas de los gases nobles y las de algunos elementos no metálicos que no son gaseosos en condiciones normales, son moléculas monoatómicas, por ejemplo el helio (He), el neón (Ne), el argón (Ar), el boro (B) y el arsénico (As). Algunos no metales gaseosos existen en forma de moléculas diatómicas en condiciones normales. Por ejemplo: N2, H2, O2, etc. Para facilitar el aprendizaje de la nomenclatura de especies químicas más complejas, se puede partir de la idea de que los compuestos están constituidos por una porción positiva y otra negativa, por lo que es importante conocer los iones más comunes junto con sus nombres y cargas. Un ION es cualquier átomo o grupo de átomos que haya ganado o perdido electrones. Los átomos son eléctricamente neutros, es decir, tienen en el núcleo el mismo número de protones que electrones en la periferia. Cuando un átomo o un grupo de átomos atrae electrones queda cargado negativamente y cuando pierde electrones queda cargado positivamente. Los iones cargados positivamente, se llaman CATIONES y los cargados negativamente, se llaman ANIONES. Se pueden encontrar iones monoatómicos (derivados de un sólo átomo) o poli atómicos (conjunto de átomos). La mayoría de los cationes son iones monoatómicos formados por átomos metálicos, mientras que los aniones monoatómicos están formados por átomos de no metales. Los átomos muestran ciertas tendencias a ganar o perder los electrones que poseen en el nivel más externo de sus sistemas, dependiendo de la estabilidad energética que pueden alcanzar con ello. Así, los elementos metálicos, tienden a perder esos electrones, mientras que los no metales tienden a ganar los necesarios. El número de electrones disponibles en el nivel (y/o subnivel) de energía más externo de cada átomo es el criterio que se utiliza para ubicarlo en cada grupo de la tabla periódica; así, el Li, Na, K, Rb, Cs, y Fr, son elementos del grupo IA que tienden siempre a perder un electrón para estabilizar su energía total, convirtiéndose en iones positivos (cationes) de carga 1+ (monovalentes).Situación similar se tiene con los elementos metálicos de los grupos IIA y IIIA, los cuales pierden sus electrones y adquieren cargas 2+ y 3+, respectivamente Por otro lado, los elementos no metálicos que se ubican en los grupos IVA, VA, VIA y VIIA, tienden a ganar electrones hasta completar 8; así, un elemento del grupo VIA (que posee 6 electrones) podrá ganar 2 electrones, convirtiéndose en un anión de carga 2-; mientras que un elemento del grupo VIIA (que posee 7 electrones) tiende a ganar 1 electrón para convertirse en un anión de carga 1-. 10 La carga eléctrica que resulta de la pérdida o ganancia aparente de electrones de un átomo, recibe el nombre de estado de oxidación, el cual es un valor asignado, arbitrario, relativo y que en ocasiones puede ser fraccionario. La IUPAC ha adoptado la convención al escribir las cargas, de indicar en primer lugar el valor numérico y en seguida el signo, por ejemplo (2-) y los estados de oxidación en el orden inverso, esto es, primero el signo y después el número: (-2). Para efectos de este material, se considerará la escritura de los estados de oxidación con el formato de carga. El estado de oxidación de un ion monoatómico es igual a su carga y se escribe en el lado superior derecho del símbolo de dicho elemento. En los iones poliatómicos, la suma de los estados de oxidación de los átomos integrantes, da por resultado la carga del ion. 5.- CATIONES MONOATÓMICOS La mayoría de los cationes se forman cuando los metales pierden electrones. Para nombrarlos, se pueden considerar dos conjuntos de recomendaciones, dependiendo del número de cationes que puede formar un elemento. Por lo tanto, resulta conveniente clasificar a los metales en función del número de cationes que pueden formar en: Metales que presentan generalmente un solo estado de oxidación en todos sus compuestos. Por ejemplo: los del grupo IA (1+), IIA (2+), Sc (3+), Zn (2+), Cd (2+), Al (3+) Metales que presentan dos estados de oxidación en sus diferentes compuestos. Por ejemplo: Fe (2+ y 3+), Cu (2+ y 1+), Ni (2+ y 3+), etc. Metales que presentan más de dos estados de oxidación en sus diferentes compuestos. Por ejemplo: Cr (6+, 3+ y 2+), Mn (7+, 6+, 4+, 3+ y 2+) La nomenclatura de los cationes de un solo estado de oxidación es muy sencilla: es el mismo nombre del elemento, anteponiéndole la palabra ion; ejemplo: Elemento Nombre ion Nombre del ion K Ca Sc H potasio calcio escandio hidrógeno K+ Ca2+ Sc3+ H+ ion potasio ion calcio ion escandio ion hidrógeno 11 Cuando un elemento forma dos cationes con diferente estado de oxidación, se puede aplicar un sistema de terminaciones, -OSO e -ICO para distinguirlos. El menor de ellos se identifica con la terminación –oso y el mayor con la terminación –ico, añadidas a la raíz del nombre original del elemento: Elemento Fe Fe Nombre actual Hierro Hierro Nombre original Ferrum Ferrum ion Fe2+ Fe3+ Nombre del ion ion ferroso ion férrico Un sistema alternativo (Stock) considera el empleo de un número romano escrito entre paréntesis, inmediatamente después del nombre del elemento, para indicar el estado de oxidación. No se deben mezclar ambas formas de nomenclatura. Elemento Fe Fe Nombre actual Hierro Hierro Nombre original Ferrum Ferrum ion Fe2+ Fe3+ Nombre del ion ion hierro (II) ion hierro (III) Cuando un elemento forma más de dos cationes diferentes, es recomendable utilizar la nomenclatura Stock, para evitar confusiones con prefijos y terminaciones. Los cationes poli atómicos son poco frecuentes. Dos de los más conocidos se forman por la asociación de un ion hidrógeno (H+) a la molécula de un compuesto. Para nombrarlos se utiliza la palabra ion, la raíz del nombre del compuesto y se adiciona la terminación –ONIO. Por ejemplo: Compuesto H2O NH3 Nombre agua amoniaco ion H3O+ NH4+ Nombre del ion ion hidronio ion amonio 6.- ANIONES MONOATÓMICOS Los no metales tienden a perder electrones cuando se combinan con el oxígeno, pero cuando el oxígeno no se encuentra presente, tienden a ganar electrones, convirtiéndose en aniones. Dicha situación se refleja en el nombre de los aniones resultantes: a la raíz del nombre del no metal se añade la terminación –URO. Por ejemplo: Elemento S N Br H Nombre azufre nitrógeno bromo hidrógeno Raíz sulfnitrbromhidr- ion S2N3Br1H1- Nombre del ion ion sulfuro ion nitruro ion bromuro ion hidruro 12 Es necesario recordar que la pronunciación de los nombres en castellano, hace que en ocasiones se supriman letras o se añadan otras, con el propósito de facilitarla o de suavizarla. Esta nomenclatura se puede aplicar a aniones poli atómicos que no contengan oxígeno: CN1- (ion cianuro) SCN1- (ion sulfocianuro) Un caso aparte es el: ion azida S22- (ion bisulfuro) (N3- ) que no sigue estas recomendaciones. Las especies derivadas del oxígeno (O2- y O22-) reciben el nombre de óxido y peróxido, respectivamente. El ion OH1- se conoce con el nombre de ion oxidrilo o ion hidroxilo. La carga que aparece en la parte superior de un ion poli atómico, corresponde a la suma algebraica de los estados de oxidación asignados a los elementos que lo forman (en el oxidrilo, al oxígeno y al hidrógeno, 2- y 1+, respectivamente). EJERCICIOS PROPUESTOS 10.- Completa la siguiente información según el ejemplo: Símbolo Elemento Carácter metal/no metal Grupo Fórmula del Ion Nombre Co Cobalto Metal VIIIB Co3+ Ion cobalto(III) Nitrógeno Au3+ Ion platino (IV) Pb Magnesio Se2Ion siliciuro P Estaño Be2+ Ion cúprico 13 11.- Escribe los nombres de los siguientes iones: a) In3+ ____________________ d) Mn2+ ____________________ b) B3- ____________________ e) Cs1+ ____________________ c) CN1- ____________________ 12.- Escribe las fórmulas de los siguientes iones: a) Ion hidruro _______________ d) Ion cadmio _______________ b) Ion cromo (III) _______________ e) Ion niquélico _______________ c) Ion arseniuro __________________ 13.- Identifica en la tabla periódica, entre los elementos de transición, al menos a cinco elementos que presentan dos estados de oxidación en sus diferentes compuestos. Anota la fórmula de cada uno de sus iones con las dos versiones de su nombre: Elemento Iones Nombres Elemento Iones Nombres Elemento Iones Nombres 14 Elemento Iones Nombres Elemento Iones Nombres 14.- Relaciona las dos columnas: nombre con fórmula. a) Ion potasio b) Ion bario c) Ion óxido d) Ion plata e) Ion cobalto (II) f) Ion telururo g) Ion plúmbico h) Ion platino (IV) i) Ion arseniuro j) Ion mercúrico k) Ion aluminio l) Ion boruro m)Ion talio (I) n) Ion niquel (III) o) Ion antimoniuro ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ ______ Tl3+ As3Tl1+ Ba2+ Sb3Au3+ Ag1+ O22Hg2+ Pb2+ O2K1+ Ni3+ B3Pt4+ Pb4+ Te2Co2+ Al3+ 15 7.- COMPUESTOS QUÍMICOS INORGÁNICOS Los compuestos químicos son sustancias puras formadas por la combinación de átomos de diferentes tipos en proporciones variables, sencillas y enteras. Pueden clasificarse según el número de elementos que lo forman, siendo: BINARIOS, formados por dos elementos químicos diferentes, por ejemplo el NaCl está formado por sodio (Na) y cloro (Cl). TERNARIOS, formados por tres elementos químicos diferentes, por ejemplo: HClO 4 formado por hidrógeno, (H), cloro, (Cl) y oxígeno, (O). CUATERNARIOS, formados por cuatro elementos químicos diferentes, por ejemplo: NaHCO3 está formado por sodio (Na), hidrógeno (H), carbono © y oxígeno (O). De acuerdo a la presencia de un grupo característico de átomos (llamado grupo funcional), los compuestos químicos inorgánicos más comunes también se pueden clasificar en: COMPUESTO 1. hidruros 2. hidróxidos 3. óxidos metálicos no metálicos 4. ácidos hidrácidos oxiácidos 5. sales sin oxígeno o binarias oxigenadas hidrogenadas dobles hidratadas ÁTOMOS QUE LO IDENTIFICAN hidrógeno y metal metal y grupo OH metal y oxígeno no metal y oxígeno hidrógeno y no metal (con excepciones) hidrógeno, no metal y oxígeno metal y no metal metal, no metal (o metal) y oxígeno metal, hidrógeno, no metal (metal) y oxígeno metal, metal, no metal y oxígeno cualquiera anterior con agua asociada Además de esta clasificación, existe un grupo de compuestos cuyo nombre y fórmula no se sujeta a reglas sistemáticas; por ser sustancias conocidas desde la antigüedad, sus nombres triviales se aceptan sin modificación 16 NOMENCLATURA DE COMPUESTOS En las fórmulas de los compuestos químicos (con algunas excepciones), el constituyente electropositivo (catión) se escribe primero, seguido del electronegativo (anión), indicando con subíndices numéricos enteros, los iones necesarios de cada tipo para establecer arreglos eléctricamente neutros. En el caso de iones poli atómicos (cationes o aniones), se utilizarán paréntesis y los subíndices numéricos correspondientes en la parte externa. Los nombres de los compuestos se forman, en la mayoría de los casos, iniciando con el nombre del anión y al último el del catión. 8.- HIDRÓXIDOS Son compuestos de fórmula general M(OH)n, donde n es el estado de oxidación del metal (carga del catión), e indica el número de grupos OH 1- que deben aparecer, con el propósito de compensar la carga del catión y formar un compuesto eléctricamente neutro. Estos compuestos se nombran con las palabras hidróxido de y el nombre del catión. Cuando se trate de un catión metálico, se aplicarán las recomendaciones mencionadas para nombrarlo (de un solo estado de oxidación, dos estados, etc.) Ejemplos: Ca(OH)2 hidróxido de calcio Ni(OH)2 hidróxido de níquel (II) ó hidróxido niqueloso LiOH hidróxido de litio Co(OH)3 hidróxido de cobalto (III) ó hidróxido cobáltico Ti(OH)4 hidróxido de titanio (IV) ó hidróxido titánico 9.- ÓXIDOS METÁLICOS De acuerdo con la convención relativa a la escritura de las fórmulas, se escribe primero el símbolo del metal y después el símbolo del oxígeno. Se deberán escribir los subíndices necesarios para formar un compuesto eléctricamente neutro, según el estado de oxidación del metal y el estado (2-) para el oxígeno. Para nombrar estos compuestos se emplean las palabras óxido de seguidas del nombre del metal. En este punto también se aplican las recomendaciones correspondientes al estado de oxidación del catión. Ejemplos: MnO óxido de manganeso (II) MnO2 óxido de manganeso (IV) Na2O óxido de sodio Fe2O3 óxido de hierro (III) ú óxido férrico FeO óxido de hierro (II) ú óxido ferroso 17 10.- PERÓXIDOS La forma estable del oxígeno en la naturaleza es el O 2, que puede representarse como O=O (se indica que ambos átomos están enlazados entre ellos). Sin embargo existe una forma estabilizada por medio de otros donadores de electrones que permiten que estos átomos de oxígeno se enlacen con otros elementos metálicos. La especie O22-, se denomina peróxido y se puede representar como –O-O-, en la que se indica que ambos átomos continúan enlazados pero ahora con la posibilidad de enlazarse con otros. En realidad son pocos los peróxidos importantes en química inorgánica, la mayoría se forma con metales alcalinos (grupo IA) y con el hidrógeno. La forma de nombrarlos consiste en las palabras peróxido de, seguido del nombre del metal. Para efectos de la nomenclatura se incluirán varios ejemplos, algunos de ellos hipotéticos: H2O2 peróxido de hidrógeno (agua oxigenada) Na2O2 peróxido de sodio BaO2 peróxido de bario FeO2 peróxido de hierro (II) 11.- SUPERÓXIDOS En el campo de la Química, en ocasiones nos encontramos con sorpresas. Los óxidos metálicos del grupo IA, aunque se conocen, no constituyen el producto principal de las reacciones entre los elementos del grupo IA y el oxígeno. El producto primario de la reacción del sodio con el oxígeno es el peróxido de sodio Na 2O2, mientras que el producto principal de la reacción del potasio con oxígeno es KO 2, superóxido de potasio, de donde se identifica al ion superóxido O2-. 12.- ÓXIDOS NO METÁLICOS Para nombrar estos compuestos se sigue la técnica de “leer la fórmula” y se utilizan prefijos numéricos para describir la cantidad de átomos presentes de cada elemento, comenzando por leer al oxígeno y al último al no metal. Los prefijos utilizados son: (1) (5) mono penta (2) (6) (9) di hexa nona (3) (7) (10) tri hepta deca (4) (8) tetra octa El prefijo mono se omite en la mayoría de los casos. Ejemplos: N2O NO2 óxido de dinitrógeno dióxido de nitrógeno NO óxido de nitrógeno N2O5 pentóxido de dinitrógeno 18 EJERCICIOS PROPUESTOS 15.- Completa la siguiente información: Elemento Iones Cu1+ Hidróxido CuOH Nombre Hidróxido de cobre(I) Óxido Cu2O Nombre Óxido de cobre(I) Cu Sn4+ AuOH Hidróxido de talio(III) Nb2O3 Óxido cérico 16.-Completa la siguiente información: NOMBRE Dióxido de carbono FÓRMULA Br2O5 Trióxido de azufre SiO2 Pentóxido de difósforo As2O3 19 COMPUESTOS NO OXIGENADOS Los aniones no oxigenados forman diferentes compuestos, dependiendo del tipo de catión con que se compensa su carga: Si compensa su carga con cationes metálicos forma sales binarias AniónmNo oxigenado Si compensa la carga con iones H+ forma hidrácidos 13.- SALES BINARIAS La mayor parte de los no metales forman aniones en ausencia de oxígeno y se combinan con los cationes derivados de los elementos metálicos, para dar compuestos sólidos muy estables, llamados sales binarias de fórmula: AxBy donde los valores de x e y se obtienen por el intercambio de estados de oxidación (o en su caso, de cargas). La nomenclatura de estos compuestos se forma a partir del nombre de anión (con su terminación –URO), la preposición “de” y el nombre del metal (según las recomendaciones ya conocidas). Ejemplos: CuS Cu2S FeCl3 CdTe sulfuro de cobre (II) sulfuro de cobre (I) cloruro de hierro (III) Telururo de cadmio sulfuro cúprico sulfuro cuproso cloruro férrico En este apartado se puede incluir al grupo de compuestos derivados del ion hidruro: los hidruros metálicos, los cuales se nombran siguiendo las recomendaciones para las sales binarias, ejemplos: CsH CuH2 PbH4 hidruro de cesio hidruro de cobre (II) hidruro de plomo (IV) hidruro cúprico hidruro plúmbico Del mismo modo, se deberá hacer la interpretación de cada porción del nombre de un compuesto de esta familia, con el propósito de escribir adecuadamente la fórmula. 20 Ejemplo: a) Arseniuro de Cobalto (II) Arsen-, significa que el elemento no metálico es el arsénico. Constituye además, la parte negativa de la molécula por nombrarse al principio. -uro, significa que el arsénico no está combinado con oxígeno, por lo cual ganará electrones en función de su grupo; pertenece al grupo VA, ganará 3 electrones y por lo tanto su estado de oxidación será 3-: As3Cobalto (II), indica el estado de oxidación del cobalto. Al ser un metal, su estado de oxidación será 2+: Co2+ Con esta información se plantean las especies involucradas: As3- y Co2+ Como los estados de oxidación no tienen el mismo valor, habrá que utilizar esos valores como el número de especies opuestas que deberán aparecer en el compuesto para que éste sea eléctricamente neutro: 2 especies As3- y 3 especies Co2+ Se deberá escribir primero la especie positiva y al último la negativa. El número de veces que debe aparecer cada especie se indica como subíndice al lado derecho y ya no se indican los estados de oxidación: Co3As2 b) Yoduro ferroso Yod-, significa que el elemento no metálico es el yodo. Constituye además, la parte negativa de la molécula por nombrarse al principio. -uro, significa que el yodo no está combinado con oxígeno, por lo cual ganará electrones en función de su grupo; pertenece al grupo VIIA, ganará 1 electrón y por lo tanto su estado de oxidación será 1-: I1ferr-, indica que el elemento metálico es el hierro -oso, indica que el estado de oxidación del hierro es el menor de los dos que puede exhibir. En este caso será 2+: Fe2+ Con esta información se plantean las especies involucradas: I1- y Fe2+ Como los estados de oxidación no tienen el mismo valor, habrá que utilizar esos valores como el número de especies opuestas que deberán aparecer en el compuesto para que éste sea eléctricamente neutro: 2 especies I1- y 1 especie Fe2+ Se deberá escribir primero la especie positiva y al último la negativa. El número de veces que debe aparecer cada especie se indica como subíndice al lado derecho y ya no se indican los estados de oxidación. En el caso del subíndice 1, éste no se escribe: FeI2 21 EJERCICIOS PROPUESTOS 17.- Completa La siguiente información: Elemento Ion Elemento Ion No. de cationes No. de aniones Fórmula compuesto Nombre Se Se2N3- Rb Al Rb1+ 2 1 Rb2Se Seleniuro de rubidio V4+ F Au2Te3 Bromuro de zinc ScH3 Cloruro titanoso 18.- Escribe el nombre de los siguientes compuestos: a) SrH2 _______________________________ b) SnS2 _______________________________ c) Ca3P2 _______________________________ d) BeTe _______________________________ e) MnI2 _______________________________ 19.- Escribe la fórmula de los siguientes compuestos: a) Carburo de bario _____________________________ b) Cianuro de potasio _____________________________ c) Hidruro de litio _____________________________ d) Cloruro de amonio _____________________________ e) Fluoruro de calcio _____________________________ 20.- Une mediante líneas las especies que podrían formar un compuesto y anota sobre ella la fórmula eléctricamente neutra que se debe escribir y abajo el nombre correspondiente: P3Mo4+ Tc7+ H1Si4Ga3+ Nb5+ 22 14.- HIDRÁCIDOS Cuando los aniones no oxigenados de los grupos VIA y VIIA compensan su carga con iones hidrógeno (H+), se genera una serie de compuestos llamada hidrácidos. Para nombrarlos, se indica la palabra ácido, la raíz del nombre del anión y la terminación –hídrico. Para la escritura de su fórmula, se anota al inicio el hidrógeno con el subíndice que se requiera para compensar la carga del anión y al último este grupo: Ejemplos: H2S HCN HBr ácido sulfhídrico ácido cianhídrico ácido bromhídrico En el proceso inverso, también se recomienda realizar el análisis de cada porción del nombre, por ejemplo: Ácido selenhídrico Ácido, indica la presencia de hidrógeno como la parte positiva del compuesto (H+), la cual deberá escribirse al principio en la fórmula. Selen-, indica que el no metal es selenio. -hídrico, significa ausencia de oxígeno, por lo que el selenio formará el anión según su grupo. Pertenece al grupo VIA, por lo que ganará 2 electrones. La especie generada será Se2-. Con esta información se deduce que deberán escribirse 2 iones hidrógeno. Con esta información, la fórmula del compuesto se escribe: H2Se CASOS ESPECIALES En ocasiones es necesario señalar la diferencia en el comportamiento de estos compuestos a través del nombre. La mayoría de ellos son compuestos gaseosos (en forma de moléculas) que se manejan en solución acuosa (disociados en iones), por lo que en cada situación recibirán un nombre distinto, pero que nos proporciona la misma información, ejemplos: Fórmula Nombre en estado gaseoso Nombre estando en solución acuosa H2S Sulfuro de hidrógeno Ácido sulfhídrico HBr Bromuro de hidrógeno Ácido bromhídrico HCl Cloruro de hidrógeno Ácido clorhídrico 23 15.- NOMBRES TRIVIALES Existen otros compuestos formados de un no metal e hidrógeno que no se sujetan a las recomendaciones presentadas hasta el momento. Algunos de estos compuestos se conocen desde hace mucho tiempo, por lo que se aceptan sus nombres triviales. Estos son: agua (H2O), amoniaco (NH3), hidracina (N2H4), arsina (AsH3), borano (BH3), diborano (B2H6), estibina (SbH3), fosfina (PH3), ácido hidrazoico (HN3), metano (CH4) y silano (SiH4). En la escritura de muchas de estas fórmulas el H es la parte positiva, aunque se escriba al final. EJERCICIO PROPUESTO 21.- Completa la siguiente información: Elemento Símbolo Anión Compuesto con hidrógeno Nombre Boro B B3- BH3 Borano C Si4NH3 Fosfina Arsénico O S2H2Se Ácido telurhídrico Flúor Cl Br1HI Ácido astathídrico 24 COMPUESTOS TERNARIOS OXIGENADOS Los aniones oxigenados forman diferentes compuestos, dependiendo del tipo de catión con que se compensa su carga: m- Anión oxigenado Si compensa su carga con cationes metálicos forma sales oxigenadas ú oxisales Si compensa la carga con iones H+ forma oxiácidos ó ácidos oxigenados 16.- ANIONES OXIGENADOS Los elementos no metálicos, como se mencionó anteriormente, tienden a ganar electrones cuando no están combinados con oxigeno, con lo cual forman aniones. Sin embargo, la gran mayoría de los no metales forma compuestos muy estables cuando se combinan con el oxígeno. Cuando esto sucede, se considera que el oxigeno es el elemento que tiende a ganar los electrones y el no metal a cederlos, adquiriendo un estado de oxidación positivo. Con esta idea en mente, la escritura de los aniones oxigenados (oxianiones), resulta sencilla, pues únicamente hay que identificar el grupo de la tabla periódica en que se encuentra el no metal y combinarlo con los átomos de oxígeno necesarios hasta que se forme un anión. En una situación de pérdida de electrones, los no metales se encontrarán en una de dos situaciones: perder todos sus electrones externos o perder un número menor en dos unidades, ejemplo: El elemento selenio pertenece al grupo VIA, debido a que tiene 6 electrones externos. Cuando el Se pierda 6 ó 4 electrones, se podrán generar los estados de oxidación Se6+ ó Se4+, respectivamente El elemento nitrógeno pertenece al grupo VA, debido a que tiene 5 electrones externos. Cuando el N pierda 5 ó 3 electrones, se podrán generar los estados de oxidación N5+ ó N3+, respectivamente La escritura de los oxianiones considera estas situaciones: Se parte de una de las dos posibilidades de pérdida de electrones (según el número de grupo ó dos unidades menor), enseguida se anota el número de átomos de oxígeno (estado de oxidación asignado: 2-) necesario para que, al sumar algebraicamente los estados de oxidación de todas las especies, el resultado sea negativo. Ejemplos: Se6+ con 4 átomos de O2- suman (6+) + (4x2-) = 2Así, el oxianión que resulta será: SeO4225 Se4+ con 3 átomos de O2- suman (4+) + (3x2-) = 2Así, el anión que resulta será: SeO32N5+ con 3 átomos de O2- suman (5+) + (3x2-) = 1El anión que resulta será: NO31N3+ con 2 átomos de O2- suman (3+) + (2x2-) = 1El anión resultante será: NO21Para nombrar los aniones oxigenados, la IUPAC recomienda utilizar una nomenclatura convencional y no la sistemática. La nomenclatura convencional consiste en anotar la palabra ion, seguida de la raíz del nombre del no metal y una terminación que indique el estado de oxidación del no metal que se está considerando en la especie: para el estado de oxidación mayor, la terminación –ATO y para el estado menor, la terminación –ITO. Ejemplos: Para el anión SeO42- el nombre sería: ion selenato Para el anión SeO32- el nombre sería: ion selenito Al anión NO31- le corresponde el nombre: ion nitrato Al anión NO21- se le asigna el nombre: ion nitrito Para la escritura de las fórmulas a partir del nombre del oxianión, se debe interpretar cada sección del nombre, por ejemplo: a) Ion carbonato: Ion: debe existir una carga escrita en la parte superior derecha del grupo de átomos. carbon: el elemento no metálico será el carbono, C, ubicado en el grupo IVA ato: el carbono presenta su máximo estado de oxidación (4+) al perder todos sus electrones externos (en función de su grupo), debido a la presencia de oxígeno. La carga, entonces será negativa. Con esta información y con el procedimiento anterior, se plantea la estructura: CO32- b) Ion arsenito: la carga resultó de sumar: (4+) + (3x2-) = 2Ion: debe existir una carga escrita en la parte superior derecha del grupo de átomos. arsen: el elemento no metálico será el arsénico, As, ubicado en el grupo VA ito: el arsénico presenta su estado de oxidación menor (3+) al perder el total menos 2 de sus electrones externos (en función de su grupo), debido a la presencia de oxígeno. La carga, entonces será negativa. 26 Con esta información y realizando el procedimiento descrito, se plantea la estructura: AsO21la carga resultó de sumar: (3+) + (2x2-) = 1Los elementos del grupo VIIA, presentan la posibilidad de perder todos sus electrones o perderlos en otras tres etapas (de dos en dos). Así, se podrán considerar los estados de oxidación: Cl7+, Cl5+, Cl3+ y Cl1+. Para diferenciarlos, se incluye un par de prefijos que se añaden al nombrar el máximo estado (7+, per-) y al nombrar al mínimo (1+, hipo-): ClO41- ion perclorato ClO21- ion clorito ClO31- ion clorato ClO1- ion hipoclorito EJERCICIOS PROPUESTOS 22.- Completa la siguiente información: Elemento Estados de oxidación positivos Anión oxigenado (oxianión) Nombre Te6+ TeO42- Ion telurato Te Br7+ SiO22- Ion sulfato 27 23.- Escribe el nombre de los siguientes iones: a) SiO32b) IO31c) NO21d) BO21e) MnO41- ___________________________ ___________________________ ___________________________ ___________________________ ___________________________ 17.- SALES OXIGENADAS La mayor parte de los no metales (y algunos metales) forman aniones con oxígeno y se combinan con los cationes derivados de los elementos metálicos, para dar compuestos sólidos muy estables, llamados sales oxigenadas de fórmula: Ax(QOy)z donde Q puede ser un metal o no metal y los valores de x y de z se obtienen por el intercambio de estados de oxidación o en su caso, de las cargas de los iones. La nomenclatura de estos compuestos se forma a partir del nombre de anión (con su terminación –ATO ó –ITO incluida), la preposición “de” y el nombre del metal (según las recomendaciones ya conocidas). Ejemplos: CuSO3 Cu2SO4 Fe(ClO)3 CdTeO3 sulfito de cobre (II) sulfato de cobre (I) hipoclorito de hierro (III) Telurito de cadmio sulfito cúprico sulfato cuproso hipoclorito férrico Del mismo modo, con el propósito de escribir adecuadamente la fórmula, se deberá hacer la interpretación de cada porción del nombre de un compuesto de esta familia. Ejemplo: a) Arseniato de Cobalto (II) Arsen-, significa que el elemento no metálico es el arsénico. Forma parte de la porción negativa de la molécula por nombrarse al principio. -ato, significa que el arsénico está combinado con oxígeno, por lo cual perderá el máximo de electrones en función de su grupo; pertenece al grupo VA, perderá 5 electrones y por lo tanto su estado de oxidación será 5+ dentro del anión: AsO31Cobalto (II), indica el estado de oxidación del cobalto. Al ser un metal, su estado de oxidación será 2+: Co2+ Con esta información se plantean las especies involucradas: AsO31- y Co2+ 28 Como la carga del anión y el estado de oxidación del metal no tienen el mismo valor, habrá que utilizar esos valores como el número de especies opuestas que deberán aparecer en el compuesto para que éste sea eléctricamente neutro: 2 especies AsO31- y 1 especie Co2+ Se deberá escribir primero la especie positiva y al último la negativa. El número de veces que debe aparecer cada especie se indica como subíndice al lado derecho y ya no se indican el estado de oxidación ni la carga. Se deberá utilizar paréntesis cuando sea necesario: Co(AsO3)2 b) Yodito ferroso Yod-, significa que el elemento no metálico es el yodo. Es parte de la porción negativa de la molécula por nombrarse al principio. -ito, significa que el yodo está combinado con oxígeno, por lo cual perderá electrones en función de su grupo; pertenece al grupo VIIA, perderá 1, 3, 5 y hasta 7 electrones. Al no aparecer el prefijo hipo, se considera que pierde 3 electrones y por lo tanto su estado de oxidación será 3+ dentro del anión IO21ferr-, indica que el elemento metálico es el hierro -oso, indica que el estado de oxidación del hierro es el menor de los dos que puede exhibir. En este caso será 2+: Fe2+ Con esta información se plantean las especies involucradas: IO21- y Fe2+ Como la carga y el estado de oxidación no tienen el mismo valor, habrá que utilizar esos valores como el número de especies opuestas que deberán aparecer en el compuesto para que éste sea eléctricamente neutro y utilizar paréntesis cuando sea necesario: 2 especies IO21- y 1 especie Fe2+ Se deberá escribir primero la especie positiva y al último la negativa. El número de veces que debe aparecer cada especie se indica como subíndice al lado derecho y ya no se indican el estado de oxidación ni la carga. En el caso del subíndice 1, éste no se escribe: Fe(IO2)2 Cuando los oxianiones compensan su carga con cationes metálicos e hidrógeno, la cantidad de hidrógeno presente se indicará al inicio del nombre del anión con prefijos numerales y disminuirá la carga del anión en tantas cargas negativas como hidrógenos haya. En las sales correspondientes se mantiene esta recomendación. Ejemplos: Compuesto NaHCO3 CaHSO4 KH2PO4 K2HPO4 anión HCO31- ion hidrogenocarbonato HSO41- ion hidrogenosulfato H2PO41- ion dihidrogenofosfato HPO42- ion hidrogenofosfato nombre hidrogenocarbonato de sodio hidrogenosulfato de calcio dihidrogenofosfato de potasio hidrogenofosfato de potasio 29 EJERCICIOS PROPUESTOS 24.- Recorre la ruta de las relaciones entre iones y escribe en el trayecto la fórmula y el nombre del compuesto eléctricamente neutro que resulta de la combinación de cada pareja. Cuando cambies de tramo, sustituye uno de los iones, según corresponda. BrO1- Al3+ HSO41- Zr4+ SiO32- Mn3+ SeO32- Mg2+ ClO21- Pd2+ Tl1+ W4+ Os8+ Cd2+ Ru4+ HCO31IO31NO21AsO31- 30 25.- Completa la siguiente información: CATION ANION Símbolo del Elemento Ion Co Co3+ Fórmula Nombre Oxianión COMPUESTO Fórmula Nombre Compuesto NO21- nitrito Co(NO2)3 Nitrito de cobalto(III) Sulfato paladoso KIO4 TeO32- Ag Pb2+ HCO31Hipoclorito de sodio V(SeO3)2 Sc bromato 26.- Relaciona las dos columnas; nombre con fórmula: a) Yodato de potasio _____ Cu(NO3)2 b) Nitrato de calcio _____ Co2(CO3)3 c) Sulfato de sodio _____ NiSO3 d) Carbonato de cobalto(III) _____ KIO3 e) Sulfito de níquel (II) _____ Mn(ClO4)2 f) Perclorato de magnesio _____ CdTeO4 g) Arseniato de cobre (II) _____ KIO4 h) Telurato de cadmio _____ Ca(NO3)2 i) Nitrato de cobre (II) _____ Na2SO4 j) Telurito de cadmio _____ Co2CO3 _____ Mg(ClO4)2 _____ Cu(AsO3)2 31 18.- OXIÁCIDOS Cuando los oxoaniones compensan su carga negativa con el correspondiente número de iones hidrógeno (H+), se forma la familia de compuestos llamada oxiácidos o ácidos oxigenados. La escritura de su fórmula debe iniciar con el (los) hidrógeno(s) que corresponde a la parte positiva y finalizar con el anión. Para nombrarlos: para indicar la presencia del hidrógeno se utiliza la palabra ácido, a continuación se rescata el nombre del anión y se sustituyen las terminaciones de la siguiente manera: Terminación en el anión -ATO -ITO Terminación en el ácido -ICO -OSO Ejemplos: Ion sulfato Ion perclorato Ion nitrito Ion hipobromito (SO42-) (IO41-) (NO21-) (BrO1-) Ácido sulfúrico Ácido perclórico Ácido nitroso Ácido hipobromoso (H2SO4) (HIO4) (HNO2) (HbrO) La escritura de las fórmulas requiere, de nuevo, la interpretación de cada fragmento del nombre: Ácido telúrico Ácido, indica la presencia de hidrógeno como catión, H+. Se anotarán los necesarios para compensar la carga negativa del anión. telur-, indica que el elemento Telurio (Te) forma parte del anión. -ico, indica que el telurio exhibe su máximo estado de oxidación por pérdida de electrones, debido a la presencia de oxígeno. Esto significa que, al pertenecer al grupo VIA, perderá ese número de electrones. Se debe anotar el número de átomos de oxígeno para formar el anión: TeO42-. Con esta información, se deberán considerar las especies H+ y TeO42-, escribirlas en ese orden y eliminar la carga y el estado de oxidación; por lo que el compuesto eléctricamente neutro que se puede formar es: H2TeO4 32 Ácido yodoso Ácido, indica la presencia de hidrógeno como catión, H+. Se anotarán los necesarios para compensar la carga negativa del anión. yod-, indica que el elemento yodo (I) forma parte del anión. -oso, sin el prefijo hipo, indica que el yodo exhibe su tercer estado de oxidación por pérdida de electrones, debido a la presencia de oxígeno. Esto significa que, al pertenecer al grupo VIIA, perderá 3 electrones. Se debe anotar el número de átomos de oxígeno para formar el anión: IO21-. Con esta información, se deberán considerar las especies H+ y IO21-, escribirlas en ese orden y eliminar la carga y el estado de oxidación; por lo que el compuesto eléctricamente neutro que se puede formar es: HIO2 19.- OTROS ÁCIDOS OXIGENADOS Existen otros ácidos oxigenados que, en el momento de formarse, atrapan moléculas de agua del medio de reacción. Esta adición se realiza siempre en la misma proporción, por lo que se consideran parte de la fórmula. En estos casos, el estado de oxidación del no metal (átomo central), no cambia de estado de oxidación, por lo que el nombre no cambia en su terminación. Los cambios que sufran estos ácidos por asociación de agua, por condensación de moléculas o por sustitución de átomos, se indicarán en el nombre por medio de prefijos. Ácidos por adición de agua. El boro, el silicio, el fósforo y el arsénico son elementos cuyos ácidos asocian una molécula de agua en el momento de su formación. Las recomendaciones para la escritura de las fórmulas, siguen aplicándose hasta obtener un compuesto eléctricamente neutro y después se “adiciona” una molécula de agua: Ejemplo: El fósforo cuando exhibe su máximo estado de oxidación, forma el ion PO 31-. Para formar el ácido correspondiente, se requiere de un ion hidrógeno (H +). Por lo tanto, la fórmula del compuestos eléctricamente neutro será HPO3 Si a esta fórmula le “sumamos” una molécula de agua se tendrá H3PO4, que es la forma estable del ácido fosfórico. Obsérvese que el estado de oxidación del P no ha cambiado. Para distinguir una estructura de otra, se utiliza el prefijo ORTO- para designar a la especie con agua asociada y a la que no la tiene, con el prefijo META-. 33 Así, los nombres completos de estas especies serán: HPO3 ácido metafosfórico H3PO4 ácido ortofosfórico Del mismo modo se podrá desarrollar las fórmulas de los ácidos ortosilícico, ortobórico y ortoarsénico. Para la deducción de las cargas de los iones correspondientes, se recomienda realizar el procedimiento descrito y eliminar el o los hidrógenos necesarios, modificando en cada caso, la carga del anión. Ejemplo: As5+ en el ion AsO31-, conduce a la fórmula del ácido HAsO3, el cual, por adición de una molécula de agua, se convertirá en el ácido H3AsO4. A partir de este compuesto (ácido ortoarsénico), se deriva los iones: AsO43HAsO42H2AsO41- ion ortoarseniato ion hidrógenoortoarseniato ion dihidrógenoortoarseniato Ácidos por condensación de moléculas La pirólisis es un tratamiento a base de calor que propicia el rompimiento de enlaces y la formación de otros nuevos. Algunos compuestos pueden sufrir este proceso con pérdida de agua y originar nuevos compuestos con características propias. El ácido (orto)fosfórico es uno de estos compuestos, el cual, cuando se somete a calentamiento, condensa dos moléculas y pierde una de agua, es decir: H3PO4 + H3PO4 ---------------------H6P2O8 H2O ---------------------H4P2O7 El nuevo ácido recibe el nombre de ácido pirofosfórico. El prefijo PIRO- indica que ha sufrido el proceso de pirólisis descrito. Del mismo modo, de esta especie se pueden derivar los correspondientes iones cuando se eliminen los hidrógenos total o parcialmente: H3P2O71H2P2O72HP2O73P2O74- ion trihidrógenopirofosfato ion dihidrógenopirofosfato ion hidrogenopirofosfato ion pirofosfato 34 Una situación similar se presenta con el ácido derivado del cromo, el cual sufre pirólisis y pérdida de agua: H2CrO4 + H2CrO4 --------------H4Cr2O8 - H2O --------------H2Cr2O7 Este ácido recibe el nombre de ácido dicrómico. El prefijo piro- ha sido sustituido por el prefijo DI-, el cual indica también que el compuesto ha sufrido el proceso de pirólisis. De este compuesto se derivan los iones: HCr2O71ion hidrógenodicromato Cr2O72ion dicromato Ácidos por sustitución de átomos. Algunos compuestos pueden sustituir uno de sus átomos por otro perteneciente a su mismo grupo de la tabla periódica o por uno que tenga características semejantes (carga). Así, se podrá dar el caso de sustitución de un átomo de oxígeno por otro de azufre (ambos del grupo VIA). Ejemplo: El ácido sulfúrico (H2SO4) puede sustituir un átomo de oxígeno por uno de azufre para obtener el compuesto H2S2O3. Para nombrar estos compuestos se añade el prefijo TIO- al nombre original del ácido: ácido tiosulfúrico. Cabe notar que el estado de oxidación del azufre parece haber cambiado, la explicación es que a uno de los átomos se le había asignado el estado 6+ y el nuevo se intercambió por uno de oxígeno de estado 2-, el resultado aparente es 2+ para ambos, sin embargo la referencia continúa siendo el estado 6+ para la asignación del nombre (terminación ICO). La obtención de los iones se realiza de la forma ya mencionada: HS2O31S2O32- ion hidrogenotiosulfato ion tiosulfato Puede ocurrir otro tipo de sustitución: un átomo de oxígeno por un grupo peróxido, dado que ambas especies tienen el mismo valor de estado de oxidación y carga, respectivamente. 35 De nuevo, en el ácido sulfúrico (H2SO4) se puede realizar la sustitución para generar el compuesto H2SO5. Para nombrar estos compuestos se añade el prefijo PEROXIal nombre original del ácido: ácido peroxisulfúrico. La determinación de los estados de oxidación de los elementos de este compuesto indica que el azufre exhibiría un estado de oxidación 8+, situación improbable dado que pertenece al grupo VIA, por lo que este indicio debe tomarse en cuenta para sospechar de una sustitución, proceder a desarrollar la fórmula por el método descrito y proponer las sustituciones que resulten convenientes hasta identificar el nombre correspondiente. Para este ejemplo, los iones asociados serán: HSO51SO52- ion hidrogenoperoxisulfato ion peroxisulfato EJERCICIOS PROPUESTOS 27.- Completa la siguiente información: Elemento Iones oxigenados Ácidos Nombre NO21- Ion nitrito Ácido nitroso N S Cl 36 28.- Escribe el nombre de los siguientes compuestos: a) HBrO2 b) H2SeO3 c) H4SiO4 ____________________ ____________________ ____________________ d) HIO4 ____________________ e) H3SbO4 ____________________ 29.- Escribe las fórmulas de los siguientes compuestos: a) Ácido metabórico b) Ácido sulfuroso c) Ácido ortoarsenioso d) Ácido metasilícico e) Ácido nitroso _____________________ _____________________ _____________________ _____________________ _____________________ 30.- Escribe la fórmula de las siguientes sales: a) dihidrógenoortoarsenato de aluminio b) hidrógenodicromato de sodio c) hidrógenopirofosfato de calcio d) trihidrógenoortosilicato de cadmio e) hidrógenocarbonato de potasio f) hidrógenotelururo de escandio g) hidrógenosulfito de bario ________________________ ________________________ ________________________ ________________________ ________________________ ________________________ ________________________ 31.- Escribe el nombre de los siguientes compuestos: a) Zn(H2BO3)2 b) Sn(H2SiO4)2 c) Mg(HSO5)2 d) Cu3(HP2O7)2 e) Co(HS2O3)3 f) Ti(HS)2 g) AgHCrO4 _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ 37 32.- Escribe en cada casilla la fórmula y el nombre de las especies químicas o del compuesto eléctricamente neutro que resulta de la combinación de los iones que se indican. SO32- Ácido yodhídrico H2O N3- Al(HCO3)3 OH1Cd2+ Cd(ClO)2 HCO31Ion hipoclorito Hidruro de sodio Cu1+ Ni3+ 38 33. .-.- Completa la siguiente clasificación parcial de los compuestos qu ímicos inorgánicos. Utiliza las recomendaciones de la IUPAC para la nomenclatura Función Química Fórmula Nombre Ácido pirofosfórico Cd(ClO) 2 Trióxido de azufre Compuestos inorgánicos NaBH4 Nitruro de níquel(II) H2Te 34 Completa la siguiente clasificación parcial de los compuestos qu ímicos inorgánicos. Utiliza las recomendaciones de la IUPAC para la nomenclatura Función Química Fórmula Nombre K2O2 Hidrógeno carbonato de cobalto (III) Compuestos inorgánicos HIO3 Metano LiAlH4 Ácido selenhídrico 39