Gases Ideales, Compresibilidad y Estados Correspondientes
Anuncio

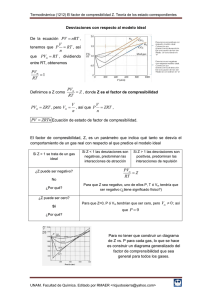
PREGUNTAS ¿Qué es un gas ideal? Se denomina gases ideales a un gas hipotético o teórico, es decir, imaginario, que estaría compuesto por partículas desplazándose aleatoriamente y sin interactuar entre sí. Un gas ideal, como hemos dicho, es una sustancia en estado gaseoso cuyas partículas se mantienen en un número estable, sin efectos electromagnéticos. Su energía cinética es directamente proporcional a la temperatura. Las colisiones entre las moléculas que lo componen (entre sí y con el recipiente o contenedor) son de tipo elástico, conservando el momento y la energía cinética. Los gases reales se aproximan a este comportamiento ideal sólo a temperatura y presión ambiente, cuando se trata de gases monoatómicos. Las principales propiedades de los gases ideales son cuatro: Poseen siempre un mismo número de moléculas No existen fuerzas de atracción o repulsión entre sus moléculas. No existe colapso entre las moléculas ni cambios en su naturaleza física (cambios de fase). Las moléculas del gas ideal ocupan siempre el mismo volumen a las mismas condiciones de presión y temperatura. ¿Qué es un factor de compresibilidad? El factor de compresibilidad Z, es un factor de corrección, que se introduce en la ecuación de estado de gas ideal para modelar el comportamiento de los gases reales, los cuales se pueden comportar como gases ideales para condiciones de baja presión y alta temperatura, tomando como referencia los valores del punto crítico, es decir, si la temperatura es mucho más alta que la del punto crítico, el gas puede tomarse como ideal, y si la presión es mucho más baja que la del punto crítico el gas también se puede tomar como ideal. La desviación de un gas respecto de su comportamiento ideal se hace mayor cerca del punto crítico. Remitiéndonos a la sección de gases ideales tenemos: Pv=RT Introduciendo el factor de corrección Z: Pv=ZRT Por lo tanto: Z=Pv/RT El factor Z también se puede entender como: Z=Vactual/Videal Donde: Vactual: volumen específico que se tiene del gas. Videal: volumen específico del gas tomado de la ec. de gas ideal. Significado del valor de Z Si el valor de Z es igual a 1 esto indica que el gas se comporta como ideal. Si el valor de Z es mayor o menor que 1 el gas se comporta como un gas real. Mientras más grande sea la desviación del valor de Z con respecto a 1, mayor es la desviación del comportamiento respecto al comportamiento ideal del gas. ¿Qué es la presión reducida y la temperatura reducida? Las propiedades reducidas de un fluido son un conjunto de variables de estado normalizadas por las propiedades de estado del fluido en su punto crítico. Estas coordenadas termodinámicas adimensionales, junto con el factor de compresibilidad de una substancia, son la base de la forma más simple del teorema de los estados correspondientes. Las propiedades reducidas también se utilizan para definir la ecuación de estado de Peng-Robinson, un modelo diseñado para obtener una precisión razonable cerca del punto crítico.2 También se usan para los exponentes críticos, los cuales describen el comportamiento de propiedades físicas cerca de las transiciones de fase continuas La presión reducida se define como la presión actual p dividida por la presión crítica Pc La temperatura reducida se define como la temperatura actual dividida por la temperatura crítica. Donde las temperaturas actual y crítica se expresan en escalas de temperatura absoluta (Kelvin o Rankine). ¿A qué se le llama principio de estados correspondientes? Si dos o más gases tiene dos de sus variables reducidas iguales, se encuentran en estados correspondientes. Esto significa que su tercera variable reducida es la misma y por lo tanto tienen el mismo factor de compresibilidad. . Bibliografía S. (2020b, marzo 17). Gases Ideales. Características. https://www.caracteristicas.co/gases-ideales/ Mercado, F. (2017, 20 marzo). Factor de Compresibilidad Z - thefinitelement.com. The Finite Element. https://www.thefinitelement.com/factor-de-compresibilidad-z colaboradores de Wikipedia. (2020, 20 septiembre). Propiedades reducidas. Wikipedia, la enciclopedia libre. https://es.wikipedia.org/wiki/Propiedades_reducidas