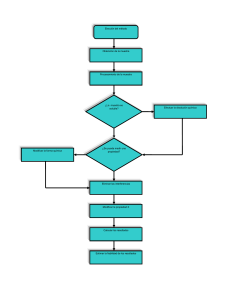
Experiencia 1 - G.I.Electrica. Disoluciones Grupo 112 Objetivos: El objetivo de esta práctica es, la preparación de dos disoluciones y aprender a utilizar el material del laboratorio. En la primera disolución que se va a preparar, vamos a utilizar aparatos de medición de peso y de volumen ya que se trata de una disolución de un sólido(NaOH) y líquidos (H2O). Y en la segunda, vamos a utilizar utensilios de medición volumétrica ya que se tratará de líquidos. Procedimientos: • Disolución 1: ´´Preparación de 0,5 L de una disolución 1 molar de NaOH.´´ : Primero vamos a realizar los cálculos teóricos para obtener el resultado deseado, en este caso una disolución de 1 molar. 𝒎𝒐𝒍𝒆𝒔 M= 𝑳 = 𝒈 𝒑𝒎 𝒈 𝟒𝟎 1= 𝟎,𝟓 ; g= 1 · 0,5 · 40; g=20gramos 𝑳 Como el producto utilizado no es puro al 100%, si se pesan únicamente 20g, no vamos a obtener los resultados deseados ya que esos 20g son NaOH tienen una riqueza del 99,25%; por tanto, para tener los 20g del producto deseado vamos a tener que pesar mayor cantidad de producto. &'' g´=20 · ((,*+ ; g´=20,15gramos Tras realizar los cálculos hemos obtenido un valor teórico de 20g de NaOH, el cual atendiendo a su pureza hemos vuelto a calcular y por lo tanto, para obtener la disolución deseada vamos a tener que pesar 20,15g de NaOH. Para pesar, vamos a colocar el recipiente en el que desea depositar el producto, sobre la balanza y una vez esta haya acabado de pesar el envase, pulsaremos ´´TARA´´; una vez hecho esto ya procederemos a pesar. Pero una vez nos disponemos a pesar la sustancia, para comenzar a preparar la disolución, al ser un sólido el cual se proporciona en trozos grandes e indivisibles se obtiene un valor aproximado al necesario. En este caso la cantidad de NaOH pesada a sido de 20,18g y con este dato procedemos a realizar un recalculo de las operaciones hechas anteriormente. A su vez hay que tener en cuenta que lo que se ha pesado no es puro por lo que se debe calcular la cantidad real de NaOH que se ha pesado. ((,*+ Gramos pesados(NaOH)=20,18 · &'' = 20,02g M= !","! $" ',+ ; M= 1,001 Una vez pesado, le añadiremos H2O hasta 300mL(sin sobrepasarlos) y removeremos la disolución que ira produciendo calor a medida que se vaya disolviendo en el agua. Una vez obtengamos una disolución homogénea, lo dejaremos enfriar. Cuando haya disminuido la temperatura de añadiremos mas agua hasta llegar a los 400mL(sin excederse). Tras hacer esto, vamos a verter la disolución en una probeta y sumarle agua hasta llegar al volumen deseado de 0.5L. Y finalmente tras obtener el volume deseado,lo pondremos en una botella de plastic(ya que ataca al vidrio). • Disolucion 2: ´´Preparacion de 1L de disolución 1 molar de HCL´´ : Al igual que en la disolución anterior, antes de realizar el experimento en si, vamos a hacer los cálculos teóricos: La cantidad de gramos hay que convertirlo a mL ya que al tratarse de un liquido no podemos pesarlo. Además, debemos recalcular la cantidad de producto a tomar debido a su riqueza de un 37% gr =36,5 · En la medición, hemos obtenido un valor de 83,5mL &'' 01 =98,64g 𝑑= 2 3 2 V =4 ; V = (5,67 &,&5 M= , -.,/ * Tras esto, medimos y realizamos el recalculo con las medidas obtenidas. ; V = 83,6mL m = v · d · % ; m = 83,5 · 1,18 · 0,37 ; m = 36,456 ; g=36,5 M= %&,$'& %&,' & ; M= 1,0027 Una vez realizadas las modificaciones, vamos a verter el acido en una probeta de un litro en la que le añadiremos el agua restante hasta el volumen de disolución deseado. Una vez mezcladas ambas sustancias, para concluir, vamos a poner nuestra disolución en una botella de vidrio(ya que ataca al plástico). Conclusión: Para concluir podríamos decir que con esta practica hemos podido aprender las principales normas para trabajar en un laboratorio y algunas nociones básicas sobre los distintos instrumentos que podemos encontrar en el. Además hemos podido recordar y afianzar los conceptos de molaridad, riqueza, densidad.. de forma mucho mas dinámica a través de una practica de disoluciones en la que había que realizar diversos cálculos y mediciones.