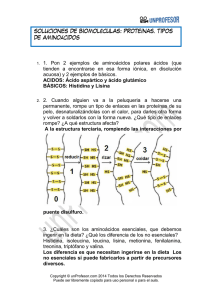
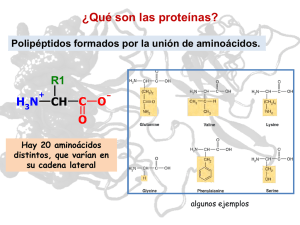
AMINOÁCIDOS Y PROTEÍNAS SILVANA MONTAGNANA AYANEGUI 1° B AMINOÁCIDOS ¿Qué son los aminoácidos? Unidad estructural de las proteínas 20 aminoácidos diferentes en el ADN Intermediarios en rutas metabólicas : citrulina y ornitina en el ciclo de la urea Unidos por enlaces covalentes Precursores de sustancias como neurotransmisores, coenzimas, hormonas… Clasificación 1 aminoácidos estrictamente apolares o hidrofóbicos 2 Aminoácidos polares sin carga 3 aminoácidos ionizables a ph fisiológico • Capacidad de absorber la luz ultravioleta • Cadenas laterales alifáticas AMINOÁCIDOS ESTRICTAMENTE APOLARES O HIDROFÓBICOS • • • • • • • Glicina Valina Isoleucina Metionina Prolina Ala Leucina • Presencia del grupo hidroxilo • Fundamentales en la catálisis enzimática Serina Treonina Cisteína Asparagina Glutamina AMINOÁCIDOS POLARES SIN CARGA AMINOÁCIDOS IONIZABLES A PH FISIOLÓGICO • Grupo carboxilo ionizado • grupos funcionales de carácter básico • pueden captar protones y adquirir carga positiva Ácido aspártico Ácido glutámico Lisina Histidina Arginina ESTEREOQUÍMICA DE AMINOÁCIDOS • son ácidos carboxílicos en que uno de sus hidrógenos ha sido reemplazado por un grupo amino AMINOÁCIDOS ESENCIALES AMINOÁCIDOS NO ESENCIALES • • • • • • • • • • • • • • • • • • • Isoleucina Leucina Lisina Metionina Fenilalanina Treonina Valina Histidina en niños Alanina Arginina Asparagina Ácido aspártico Cistenina Ácido glutámico Glicina Prolina Cerina Tirosina histidina en adultos PROPIEDADES QUÍMICAS • • • • Sólidos Incoloros Cristalizables Elevado punto de fusión (por encima de los 200 ºc) • Solubles en agua • Actividad óptica • Comportamiento anfótero • Pueden estar formados por cualquier cantidad de residuos de aminoácidos FORMACIÓN DE PÉPTIDOS • Dipéptido • Tripéptido • Oligopéptido • Polipéptido PROTEÍNAS ¿Qué son las proteínas ? secuencia de aminoácidos (+50) Estructura tridimensional característica función específica Función estructural en el sitio esqueleto señalización celular como hormonas función mecánica en el músculo FUNCIÓN • Función estructural a nivel celular • función enzimática, actúan como biocatalizadores de reacciones en el metabolismo • función hormonal • función reguladora • función homeostática, Mantenimiento del equilibrio osmótico y pH • función de transporte • función contráctil • función de reserva Cuatro niveles estructurales: • estructura primaria • estructura secundaria • estructura terciaria • estructura cuaternaria CLASIFICACIÓN DE PROTEÍNAS constituida por la secuencia de la cadena polipeptídica ESTRUCTURA PRIMARIA las proteínas se diferencian por: número de aminoácidos tipo de aminoácidos orden en que se encuentran dispuestos los aminoácidos Estructura secundaria • Plegamiento en forma de cadena política • Puentes de hidrógeno entre los átomos que forman enlace peptídico • Se establecen entre los grupos CO y NH del enlace peptídico • Mayor estabilidad • Hélice alfa • Lamina beta HÉLICE ALFA LÁMINA BETA • Se forma cuando la cadena poli peptídica se enrolla de manera helicoidal • estructura en espiral • el grupo carboxilo se une con un puente de hidrógeno a un grupo amino • también conocida como lámina plegada • cadena estirada • en forma de zig zag Estructura terciaria • Cuando existe atracción entre la lámina beta y la hélice Alfa • estructura específica para cada proteína • determinan la función • la estructura terciaria da lugar a 2 tipos de proteínas: • proteínas con estructura terciaria de tipo fibroso • proteínas con estructura terciaria de tipo globular Tipo fibroso • Las hélices Alfa o láminas beta que lo conforman mantendrán su orden, no tendrán grandes modificaciones, presentaron leves giros longitudinales Tipo globular • forma esférica • se forman regiones con estructuras al azar • como hélices Alfa, láminas beta y acotamientos ESTRUCTURA CUATERNARIA • Interacción de más de una cadena polipeptídica • Asociación de diferentes subunidades HOLOPROTEÍNAS O PROTEÍNAS SIMPLES Proteínas formadas sólo por aminoácidos Globulares • prolaminas • gluteninas • Albúminas • Hormonastirotropina • Enzima Fibrosas • Colágenos • Queratinas • Elastinas • Fibroínas HETERO PROTEÍNAS O PROTEÍNAS CONJUGADAS • Formadas por una fracción proteica y por un grupo prostético • Glucoproteínas • Lipoproteínas • Nucleoproteínas • Cromoproteínas • Cuando una proteína pierde su estructura terciaria y por lo tanto pierde su función • ruptura de la estructura tridimensional • puede suceder por calor o pH extremo DESNATURALIZACIÓN PROTEÍNAS EN SANGRE