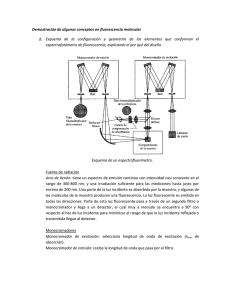
ESPECTROSCOPÍA LUMINISCENTE: Existen tres tipos de métodos ópticos relacionados entre sí llamados: fluorescencia y fosforescencia molecular y quimioluminiscencia. En todos ellos, las moléculas de analito se excitan para dar una especie cuyo espectro de emisión suministra información para el análisis cualitativo y cuantitativo. Los métodos se conocen colectivamente como procedimientos luminiscentes moleculares. La fluorescencia y la fosforescencia se parecen en que la excitación se consigue mediante la absorción de fotones. Como consecuencia, con frecuencia se alude a los dos fenómenos con el término más general de fotoluminiscencia. La fluorescencia se diferencia de la fosforescencia en que las transiciones electrónicas responsables de la fluorescencia no conllevan un cambio en el espín del electrón. Como consecuencia, la fluorescencia presenta una vida corta cesando la luminiscencia casi inmediatamente (10-5S). Por el contrario, las emisiones de fosforescencia están acompañadas por un cambio en el espín del electrón, que hace que la radiación se mantenga durante un tiempo fácilmente detectable, después de haber acabado la irradiación – a menudo varios segundos después o más. En la mayoría de los casos, la emisión fotoluminiscente, tanto si es de fluorescencia como de fosforescencia, es de mayor longitud de onda que la radiación utilizada para su excitación. Uno de los aspectos más atractivos de la luminiscencia es su inherente sensibilidad, con límites de detección que suelen ser de uno a tres órdenes de magnitud inferiores a los encontrados en la espectroscopia de absorción. Los límites de detección características son del orden de partes por billón. Debido a su alta sensibilidad, los métodos luminiscencia cuantitativos suelen sufrir serios efectos de interferencia procedentes de la matriz de la muestra. Por esta razón las medidas luminiscentes se suelen combinar con las extraordinarias técnicas de cromatografía y electroforesis. En general los métodos luminiscentes se aplican menos que los métodos de absorción en los analitos cuantitativos debido a que el número de especies que absorben radiación ultravioleta / visible es mucho mayor que el de especies que presentan fotoluminiscencia tras la absorción de radiación en esta región del espectro. Teoría de la Fluorescencia y de la Fosforescencia La fluorescencia tiene lugar en sistemas gaseosos, líquidos y sólidos, tanto sencillos como complejos. El tipo más sencillo de fluorescencia es el que presentan los vapores atómicos diluidos. Por ejemplo: Los electrones 3s de los átomos de sodio vaporizados pueden ser excitados al estado 3p mediante la absorción de radiación de longitudes de onda de 5 896 a 5 890 Å. Después de 10-8 a 10-5 s, los electrones vuelven al estado fundamental emitiendo radiación de estas mismas longitudes de onda en todas las direcciones. Este tipo de fluorescencia, en la cual la radiación absorbida es reemitida sin cambio de frecuencia, se conoce como radiación de resonancia o fluorescencia de resonancia. Estados excitados que producen fluorescencia y fosforescencia Para diferenciar entre los fenómenos de fotoluminiscencia se requiere una revisión del spín del electrón y de los estados excitados singulete / triplete. Espín del electrón El principio de exclusión de Pauli establece que en un átomo no puede haber dos electrones con los cuatro números cuánticos iguales. Esta restricción requiere que no haya más de dos electrones en un orbital, y además, los dos deben tener los estados de espín opuestos. Cuando esto ocurre, se dice que los espines están apareados. Debido al apareamiento de espines, la mayoría de las moléculas no presentan un campo magnético neto y se dice, por tanto, que son diamagnéticas, es decir, no son atraídas ni repelidas por campos magnéticos permanentes. Por el contrario, los radicales libres, que contienen electrones desapareados, tienen un momento magnético y, consecuentemente, son atraídos cuando se encuentran en un campo magnético; por ello, se dice que los radicales libres son paramagnéticos Estados excitados singulete/triplete Un estado electrónico molecular en el cual todos los espines de los electrones están apareados se llama singulete y cuando la molécula se expone a un campo magnético no se produce un desdoblamiento de niveles de energía. Por otro lado, el estado fundamental para un radical libre, es un estado doblete, porque el electrón impar puede tomar dos orientaciones en un campo magnético, lo que comunica ligeras diferencias de energía al sistema. Cuando uno de los electrones de una molécula es excitado a un nivel de energía superior, se forma un estado singulete o triplete. En el estado singulete excitado, el espín del electrón promocionado continua apareado con el electrón del estado fundamental; sin embargo, en el estado triplete los espiones de los dos electrones se han desapareado y, por tanto, están paralelos. Estos estados pueden representarse como sigue, donde las flechas representan la dirección del espín. Velocidades de absorción y de emisión La velocidad a la cual se absorbe un fotón de radiación es enorme, el proceso requiere del orden de 10-15 a 10-14 s. Por otro lado, la emisión fluorescente, tiene lugar a una velocidad significativamente más lenta. El tiempo de vida del estado excitado se relaciona inversamente con la absortividad molar del pico de absorción correspondiente al proceso de excitación. Por tanto, para absortividades molares comprendidas entre 103 y 105, los tiempos de vida del estado excitado son de 10-9 a 10-7 s. Para sistemas débilmente absorbentes, donde la probabilidad del proceso de transición es más pequeña, los tiempos de vida pueden ser tan largos como de 10-6 a 10-5 s. Como se ha señalado, la velocidad promedio de una transición triplete a singulete es menor que la correspondiente transición singulete a singulete. Por ello, la emisión fosforescente requiere tiempos comprendidos entre 10-4 y 10s o superiores. Procesos de desactivación Una molécula excitada puede volver a su estado fundamental mediante una combinación de varias etapas mecanísticas. Como muestran las flechas verticales rectas de la Figura, dos de estas etapas, fluorescencia y fosforescencia, conllevan la emisión de un fotón de radiación. Las otras etapas de desactivación, indicadas por flechas onduladas, son procesos no radiantes. El camino más propicio hacia el estado fundamental es aquel que minimiza el tiempo de vida del estado excitado. Por ello, si la desactivación por fluorescencia es más rápida que los procesos no radiantes, se observa tal emisión. Por otro lado, si la desactivación no radiante tiene una constante de velocidad más favorable, la fluorescencia desaparece o es menos intensa La fotoluminiscencia está limitada a un número relativamente pequeño de sistemas que incorporan características estructurales y ambientales que hacen que la velocidad de los procesos de relajación desactivación no radiantes se ralenticen hasta el punto en el que la reacción de emisión puede competir cinéticamente con ellos. La información referente a los procesos de emisión es suficientemente completa para permitir un cálculo cuantitativo de estas velocidades. Sin embargo, la comprensión de los otros caminos de desactivación es, en el mejor de los casos, rudimentaria; para estos procesos, sólo se pueden realizar afirmaciones o especulaciones cualitativas sobre las velocidades y los mecanismos. Fosforescencia La desactivación del estado electrónico excitado también puede incluir la fosforescencia. Después del cruce entre sistemas a un estado triplete excitado, la desactivación posterior puede tener lugar por conversión interna o externa o por fosforescencia. Una transición triplete singulete es mucho menos probable que una conversión singulete/singulete; como se ha dicho, el tiempo de vida medio de un estado triplete excitado respecto a la emisión oscila entre 10-4 y 10 s o más. Por tanto, la emisión causada por una transición de este tipo puede persistir durante algún tiempo después que la irradiación se haya interrumpido. Las conversiones externas e internas compiten con tanto éxito con la fosforescencia que este tipo de emisión se observa normalmente sólo a bajas temperaturas, en medios altamente viscosos o por moléculas que están adsorbidas sobre superficies sólidas. Variables que afectan a la fluorescencia y a la fosforescencia Tanto la estructura molecular como el entorno químico van a influir en que una sustancia sea o no luminiscente; estos factores también determinan la intensidad de emisión cuando tiene lugar la fotoluminiscencia. En este apartado se consideran brevemente los efectos de algunas de estas variables. Rendimiento cuántico El rendimiento cuántico, o la eficacia cuántica, de fluorescencia de fosforescencia es simplemente la relación entre el número de moléculas que emiten luminiscencia respecto al número total de moléculas excitadas. Para moléculas altamente fluorescentes como la fluoresceína, la eficacia cuántica, bajo determinadas condiciones, se aproxima a la unidad. Las especies químicas que no presentan una fluorescencia apreciable tienen eficacias que se aproximan a cero. Tipos de transiciones en fluorescencia Es importante resaltar que la fluorescencia rara vez es consecuencia de la absorción de radiación ultravioleta de longitud de onda menor de 250 nm, ya que tal radiación es suficientemente energética como para producir la desactivación de los estados excitados por predisociación o disociación. Por ejemplo, una radiación de 200 nm corresponde a aproximadamente 140 kcal/mol; la mayoría de las moléculas tienen al menos algún enlace que se puede romper con energías de esta magnitud. Como consecuencia, rara vez se observa fluorescencia debida a transiciones * , en cambio, este tipo de emisión está asociada a los procesos menos energéticos * y * n. Fluorescencia y estructura La fluorescencia más intensa y la más útiles la que presentan los compuestos que contienen grupos funcionales aromáticos con transiciones * de baja energía. Los compuestos que contienen grupos carbonilo en estructuras alifáticas y alicíclicas o estructuras con dobles enlaces altamente conjugados también pueden presentar fluorescencia, pero el número de estos compuestos es pequeño comparado con el número de sistemas aromáticos. La mayoría de los hidrocarburos aromáticos no sustituidos son fluorescentes en disolución, la eficacia cuántica normalmente aumenta con el número de anillos y con su grado de condensación. Los heterociclos sencillos, como la piridina, el furano, el tiofeno y el pirrol, no presentan fluorescencia; por otro lado, las estructuras condensadas con éstas normalmente sí la presentan. En los heterociclos con nitrógeno, se cree que la transición electrónica de más baja energía implica a un sistema n * que rápidamente se transforma en un estado triplete e impide la fluorescencia. Sin embargo, la condensación de anillos bencénicos para dar núcleos heterocíclicos, da lugar a un aumento en la absortividad molar del pico de absorción. En estas estructuras, el tiempo de vida del estado excitado es más corto, así, se observa fluorescencia en compuestos como la quinolina, la isoquinolina y el indo!. Efectos de la temperatura y del disolvente La eficacia cuántica de fluorescencia disminuye en la mayoría de las moléculas al aumentar la temperatura, ya que al aumentar la frecuencia de las colisiones cuando la temperatura es elevada aumenta la probabilidad de desactivación por conversión externa. Una disminución en la viscosidad del disolvente también aumenta la probabilidad de la conversión externa y conduce al mismo resultado. La fluorescencia de una molécula se reduce en presencia de disolventes que contienen átomos pesados o de solutos con dichos átomos en su estructura; como por ejemplo, el tetrabromuro de carbono y el yoduro de etilo. El efecto es similar al observado cuando se introducen, por sustitución, átomos pesados en compuestos fluorescentes; las interacciones espín-orbital desembocan en un aumento en la velocidad de formación del triplete y en la correspondiente disminución de la fluorescencia. Cuando se desea exaltar la fosforescencia se incorporan con frecuencia a los disolventes compuestos que contienen átomos pesados Efecto del oxígeno disuelto La presencia de oxígeno disuelto suele reducirla intensidad de fluorescencia de una disolución. Este efecto puede ser el resultado de una oxidación de las especies fluorescentes inducida fotoquímicamente. Sin embargo, con más frecuencia la amortiguación (quenehing) tiene lugar como consecuencia de las propiedades paramagnéticas del oxígeno molecular, que favorecen el cruce entre sistemas y la conversión de las moléculas excitadas al estado triplete. Otras especies paramagnéticas también tienden a amortiguar la fluorescencia. Efecto de la concentración en la intensidad de fluorescencia La potencia de la emisión fluorescente F es proporcional a la potencia radiante del haz de excitación absorbido por el sistema. Esto es, F = K'(Po- P) Donde Po es la potencia del haz que incide sobre la disolución y P es su potencia después de atravesar una longitud b del medio. La constante K' depende de la eficacia cuántica del proceso de fluorescencia. Con el objeto de relacionar F con la concentración de la especie fluorescente, se escribe la ley de Beer de la forma INSTRUMENTOS PARA LA MEDIDA DE LA FLUORESCENCIA Y DE LA FOSFORESCENCIA Los distintos componentes de los instrumentos para la medida de la fotoluminiscencia son similares a los que se encuentran en los fotómetros o espectrofotómetros ultravioleta/visible. La siguiente gráfica muestra una configuración característica de estos componentes en los fluorómetros y los espectrofluorímetros. Casi todos los instrumentos de fluorescencia utilizan ópticas de doble haz tal como se muestra, para compensar las fluctuaciones en la potencia de la fuente. Filtro o Radiación dispersada Monocromador de excitación Muestra Fuente Filtro o Atenuador del haz Monocromador de emisión Fotomultiplicador de la muestra Fotomultiplicador de referencia Amplificador diferencial Dispositivo de lectura El haz de la muestra pasa primero a través de un filtro o un monocromador de excitación, que transmite la radiación que provocará la fluorescencia pero excluye o limita la radiación de la longitud de onda de la emisión fluorescente. La fluorescencia se propaga desde la muestra en todas las direcciones pero lo más conveniente es observar la que forma un ángulo recto con el haz de excitación; a otros ángulos, la dispersión producida en la disolución y en las paredes de las cubetas aumenta y se pueden cometer grandes errores en la medida de la intensidad. La radiación emitida llega a un fotodetector después de haber pasado por un segundo filtro o monocromador que aísla la fluorescencia para su medida. El haz de referencia pasa a través de un atenuador que reduce su potencia a aproximadamente la de la radiación fluorescente (normalmente la potencia se reduce en un factor de 100 o más. Las señales procedentes del fotomultiplicador de la muestra y del de referencia se dirigen a un amplificador diferencial cuya salida se visualiza en un medidor o en un registro. Algunos instrumentos de fluorescencia son de tipo nulo; esta condición se consigue con atenuadores ópticos o eléctricos. Los instrumentos más modernos utilizan un circuito divisor analógico o un sistema de adquisición de datos digital seguido de tratamiento de los datos para obtener la relación entre la intensidad de la emisión fluorescente y la intensidad de la fuente de radiación. Espectrometría de luminiscencia molecular Componentes de los fluorómetros y de los espectrofluorímetros Los componentes de los fluorómetros y de los espectrofluorímetros difieren sólo en detalles de los que componen los fotómetros y los espectrofotómetros; sólo es necesario considerar estas diferencias. Fuentes En la mayoría de las aplicaciones se necesitan fuentes más intensa que las lámparas de wolframio o hidrógeno utilizadas en las medidas de absorción. De hecho, la magnitud de la señal de salida y, por tanto, la sensibilidad, es directamente proporcional a la potencia de la fuente Po Lámparas. La lámpara más común para los fluorómetros de filtro es la lámpara de arco de mercurio a baja presión equipada con una ventana de sílice fundida. Esta fuente emite líneas útiles para producir la excitación previa a la fluorescencia a 254, 302, 313, 546, 578, 691 y 773 nm. Las líneas individuales se pueden aislar con filtros de interferencia o absorción adecuados. Ya que, en la mayoría de los compuestos fluorescentes, la fluorescencia se puede inducir con distintas longitudes de onda, al menos una de las líneas del mercurio suele resultar adecuada. Láseres. Desde los comienzos de los años setenta, se utilizan también diversos tipos de láseres como fuentes de excitación para medidas de fotoluminiscencia. Un particular interés tienen los láseres sintonizables de colorante que utilizan, como sistema de bombeo, un láser de nitrógeno pulsante o un láser de Nd:YAG. La mayoría de los espectrofluorímetros comerciales utilizan lámparas (ya descritas) como fuentes, por ser menos caras y menos complicadas de uso. Sin embargo, las fuentes de láser ofrecen importantes ventajas en determinados casos: por ejemplo, (1) cuando las muestras son muy pequeñas como en cromatografía con microcolumnas y en electroforesis capilar donde la cantidad de muestra es de un microlitro o menor; (2) en los sensores de control remoto, como en la detección fluorimétrica de radicales hidroxilo en la atmósfera de clorofila en seres vivos acuáticos, donde la naturaleza colimada de los haces de láseres vital: o (3) cuando se requiere una radiación de excitación altamente monocromática para minimizar los efecto de las interferencias fluorescentes. Filtros y monocromadores Tanto los filtros de interferencia como los de absorción se han utilizado en los fluorómetros para la selección de la longitud de onda del haz de excitación y de la radiación fluorescente resultante, mayoría de los espectrofluorímetros están equipados con al menos uno y a veces dos monocromadores de red. Detectores La señal de fluorescencia típica es de baja intensidad, por ello, para su medida se necesitan ganancias de amplificador elevadas. Los tubos fotomultiplicadores son los detectores más utilizados en instrumentos de fluorescencia sensibles. Suelen trabajar en la modalidad de recuento de fotones para mejorar la relación señal/ruido. También se utiliza, a veces, la refrigeración de los detectores para mejorar la relación señal/ruido. También se han propuesto, para los espectrofluorímetros, los detectores de diodos en serie y de transferencia de carga. Este tipo de detectores permite el registro rápido de los espectros de excitación y de emisión y particularmente son útiles en cromatografía y en electroforesis Cubetas y compartimentos para las cubetas Para medidas de fluorescencia se utilizan tanto cubetas cilíndricas como rectangulares, fabricadas con vidrio o con sílice. Se debe tener cuidado en el diseño del compartimento de la cubeta para reducir la cantidad de radiación dispersada que llega hasta el detector. Con este propósito, a menudo se introducen deflectores en el compartimento incluso más importante que en las medidas de absorbancia, es evitar dejar las huellas dactilares en las cubetas y, a que la grasa de la piel con frecuencia fluórese. Diseños de instrumentos Fluorómetros Los fluorómetros de filtro proporcionan una forma relativamente simple y barata de llevar a cabo análisis cuantitativos por fluorescencia. Como ya se ha señalado para seleccionar las longitudes de onda de la radiación de excitación y de emisión se utilizan filtros de interferencia y de absorción. Generalmente, los fluorómetros son compactos, robustos y fáciles de usar. La Figura muestra un esquema de un fluorómetro de filtros característico que consta de una lámpara de mercurio para la excitación de la fluorescencia y un par de tubos fotomultiplicadores como detectores. El haz que sale de la fuente se divide cerca de ella en un haz de referencia y en un haz de muestra. El haz de referencia se atenúa mediante el disco de apertura hasta que su intensidad sea aproximadamente la misma que la intensidad de fluorescencia. Ambos haces pasan a través del filtro primario y a continuación el haz de referencia se refleja hacia el tubo fotomultiplicador de referencia. El haz de muestra se enfoca sobre la muestra mediante un par de lentes y provoca la emisión de fluorescencia. La radiación emitida pasa a través de un segundo filtro que posteriormente se enfoca sobre un segundo tubo fotomultiplicador. Las señales de salidas eléctricas de los dos detectores se dirigen hacia un divisor analógico, para obtener la relación entre las intensidades de la muestra y de referencia, que sirve como parámetro analítico. Espectrofluorímetros Algunos fabricantes de instrumentos ofertan espectrofluorímetros capaces de obtener los espectros de excitación y los de emisión. En la Figura se muestra el diseño óptico de uno de ellos, que utiliza dos monocromadores de red. La radiación que procede del primer monocromador se divide en dos, una parte se dirige hacia el fotomultiplicador de referencia y la otra hacia la muestra. La radiación fluorescente resultante, después de ser dispersada en el segundo monocromador, se detecta en un segundo fotomultiplicador. Un instrumento como el que se muestra en la Figura suministra perfectamente espectros satisfactorios para el análisis cuantitativo. Sin embargo, los espectros de emisión obtenidos no son necesariamente comparables con los de otros instrumentos, ya que la señal de salida depende no sólo de la intensidad de fluorescencia sino también de las características de la lámpara, del detector y de los monocromadores. Todas estas características instrumentales varían con la longitud de onda y difieren de un instrumento a otro. Se han desarrollado varios métodos para obtener el espectro corregido, que es el verdadero espectro de fluorescencia, libre de efectos instrumentales; muchos de los instrumentos comerciales modernos y más sofisticados están preparados para obtener directamente los espectros corregidos. FosforÍmetros Los instrumentos que se utilizan para estudios de fosforescencia tienen diseños similares a los fluorómetros y a los espectrofluorímetros antes considerados, sólo difieren en que requieren dos componentes adicionales. El primero es un dispositivo que irradia alternativamente la muestra y, después de un retraso en el tiempo adecuado, mide la intensidad de fosforescencia. El retraso en el tiempo es necesario para diferenciar la emisión fosforescente de larga vida de la emisión fluorescente de corta vida que podrían originarse en la misma muestra. Se utilizan dispositivos mecánicos y electrónicos y muchos instrumentos de fluorescencia comerciales tienen accesorios para medidas de fosforescencia. Un ejemplo de un tipo de dispositivo mecánico se muestra en la Figura. APLICACIONES Y MÉTODOS FOTOLUMINISCENTES Es inherente a los métodos fluorescentes y fosforescentes el ser aplicables a intervalos de concentración más bajos que las medidas espectrofotométricas de absorción y se encuentran entre las técnicas analíticas más sensibles de las que puedan disponer los científicos. El aumento de sensibilidad surge del hecho de que el parámetro relacionado con la concentración en fluorimetría y en fosforimetría F se puede medir independientemente de la potencia de la fuente Po. Por el contrario, una medida de absorbancia requiere la evaluación de Po y de P, ya que la absorbancia, que es proporcional a la concentración, depende de la relación entre estas dos cantidades. La sensibilidad de un método fluorimétrico puede mejorarse aumentando Po o mediante la amplificación adicional de la señal de fluorescencia. Por el contrario, en espectrofotometría, un aumento en Po da lugar a un cambio proporcional en P y, por ello, no afecta a la A. Por tanto, los métodos fluorimétricos tienen, generalmente, sensibilidades que son de uno a tres órdenes de magnitud superiores a los correspondientes de absorción. Por otro lado, la precisión y la exactitud de los métodos fotoluminiscentes son habitualmente más pobres que las de los procedimientos espectrofotométricos en un factor entre, quizás, dos y cinco. Generalmente, los métodos fosforescentes son menos precisos que sus correspondientes métodos fluorescentes. Determinación fluorimétrica de especies inorgánicas Los métodos inorgánicos fluorimétricos son de dos tipos. Los métodos directos que conllevan la formación de un quelato fluorescente y la medida de su emisión. Un segundo grupo, que se basa en el descenso de la fluorescencia que resulta de la acción amortiguadora de la sustancia que va a ser determinada. La última técnica se ha utilizado más en la determinación de aniones. Reactivos fluorimétricos Los reactivos fluorimétricos de más éxito en el análisis de cationes son los que presentan estructuras aromáticas con dos o más grupos funcionales dadores que permitan la formación de quelatos con el ion metálico. A continuación se muestran Determinación fluorimétrica de especies orgánicas El número de aplicaciones del análisis fluorimétrico a especies orgánicas y bioquímicas es impresionante. Por ejemplo, Weissler y White han recopilado los métodos para la determinación de más de 200 sustancias, incluyendo una amplia variedad de compuestos orgánicos, enzimas y coenzimas, agentes medicinales, productos naturales, esteroides y vitaminas. Es incuestionable que las aplicaciones más importantes de la fluorimetría se encuentran en el campo del análisis de productos alimentarios, farmacéuticos, muestras clínicas y productos naturales. La sensibilidad y la selectividad del método hacen que sea una herramienta particularmente valiosa en estos campos. Métodos fosforimétricos Los métodos fosforescentes y fluorescentes tienden a ser complementarios, ya que los compuestos fuertemente fluorescentes presentan una débil fosforescencia y viceversa. Por ejemplo, entre los hidrocarburos aromáticos con anillos condensados, aquellos que contienen átomos pesados como halógeno s o azufre, con frecuencia presentan una fuerte fosforescencia; por otro lado, los mismos compuestos sin la presencia del átomo pesado tienden a presentar fluorescencia en lugar de fosforescencia. La fosforimetría se ha utilizado para determinar una gran variedad de especies orgánicas y bioquímicas que incluyen sustancias como ácidos nucleicos, aminoácidos, pirina y pirimidina, enzimas, hidrocarburos del petróleo y pesticidas. Sin embargo, el método no ha alcanzado el uso tan difundido de la fluorimetría, quizás debido a la necesidad de bajas temperaturas y a la, generalmente, peor precisión de las medidas fosforescentes. Por otro lado, es atractiva la mayor selectividad potencial de los procedimientos de fosforescencia. La razón de estas diferencias de comportamiento se debe a que la fosforescencia eficaz necesita el cruce entre sistemas rápido para poblar el estado triplete excitado, que, vuelve a reducir la concentración de moléculas en el singulete excitado y, por tanto, aumenta la intensidad de fosforescencia. BIBLIOGRAFÍA - Principio de Análisis Instrumental. SKOOG, HOLLER y NIEMAN Quinta Edición. Mc Graw Hill. - Análisis Instrumental. KENNETH A. RUBINSON y JUDITH F. RUBINSON Prentice Hall. Madrid 2001.