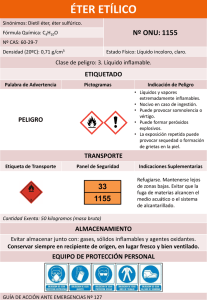
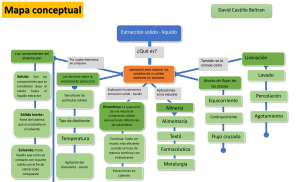
LABORATORIO Nº1 EXTRACCIÓN 1.- INTRODUCCIÓN Se llama extracción a la operación que sirve para separar uno o varios componentes a partir de una mezcla que se encuentra en estado líquido o sólido, tratándola con un disolvente (agente extractor) que es selectivo respecto a los componentes individuales. Para la subsiguiente recuperación del componente requerido a partir de su mezcla con el agente extractor se utiliza la evaporación o destilación fraccionada. En la práctica es muy utilizada para separar compuestos orgánicos de las soluciones o suspensiones acuosas en las que se encuentran. El procedimiento consiste en agitarlas con un disolvente orgánico inmiscible con el agua y dejar separar ambas capas. Los distintos solutos presentes se distribuyen entre la fases acuosa y orgánica, según el coeficiente de reparto. 1.1.- OBJETIVOS a) Analizar la relación estructura de soluto y disolvente, en cuanto a polaridad se refiere. b) Determinar cuál es el mejor disolvente para la primera parte de la práctica experimental c) Analizar la dependencia del grado de extracción con el número de extracciones sucesivas. 1.2.- MATERIAL Y REACTIVOS - Tubos de ensayo - Embudo de separación - Pipeta - Yoduro de potasio - Ácido Sulfúrico conc. - Nitrito de potasio o de sodio - Tetracloruro de carbono - Dicromato de potasio - Éter etílico 1.3.- DESARROLLO EXPERIMENTAL.- 1.3.1.- Extracción con tetracloruro de carbono y éter etílico: Disolver un pequeño cristal de KI en 10 ml de agua contenidos en un tubo de ensayo. Acidular con 3 gotas de ácido sulfúrico concentrado y añadir un par de cristales de nitrito de potasio. (Escribir la ecuación de la reacción química generada). Enfriar la muestra bajo chorro de agua (al grifo) y dividir en partes iguales, traspasando la mitad a otro tubo de igual diámetro. a) Adicionar a uno de los tubos de ensayo 0.5 ml de tetracloruro de carbono y agitar. El yodo producido se extraerá en la capa orgánica. Agite y compare ambos tubos. b) Al tubo que no se agrego nada colocar 0,5 ml. de éter etílico y comparar el resultado con el inciso (a). 1.3.2.- Extracción discontinua: En un tubo de ensayo disolver con 6 ml de agua, un par de cristales de dicromato de potasio; añadir 8 gotas de ácido sulfúrico concentrado. Posteriormente agregar cuatro cristales de KI y agitar, (escribir la ecuación de la reacción química generada) dejando enfriar en una gradilla. Una vez enfriado el producto de la reacción anterior, se procederá a la extracción de la siguiente forma: - Colocar 3 ml de la solución en el embudo de separación, y adicionar 0,5 ml. del mejor disolvente (obtenido en 1.3.1) por vez, se sugiere realizar cuatro extracciones sucesivas del yodo covalente producido. 1.4.- CUESTIONARIO 1. Qué es extracción? 2. Cómo afecta el grado de agitación el rendimiento del proceso? 3. En relación a la estructura del yodo indique los grados de polaridad del éter etílico, tetracloruro de carbono y sulfuro de carbono. 4. Cuando se extrae una solución acuosa con diferentes disolventes indicar que capa será la superior en el embudo empleando los siguientes disolventes: n- hexano, tetracloruro de carbono, sulfuro de carbono, éter etílico y cloroformo. 5. Escribir los reactantes y productos de ambas reacciones químicas