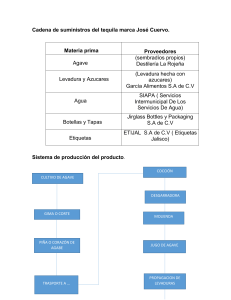
Morfofisiología temprana de agaves mezcaleros en condiciones limitantes de nutrientes PCB revisado
Anuncio

Morfofisiología temprana de agaves mezcaleros en condiciones limitantes de nutrientes. Propuesta de investigación para el Doctorado en Ciencias Biológicas Autor: Nixon Florez Velasco I.A. Ms.C Tutor Principal: Dr. Ulises Y. Rosas López Comité tutor: Dra. Margarita Collazo Ortega (Facultad de Ciencias) Dr. Alfonso Valiente Banuet (Instituto de Ecología) Universidad Nacional Autónoma de México 2022 Resumen En un mundo que continuamente se calienta y se seca debido a efectos antropogénicos, a la degradación de la tierra cultivable y al aumento en la población, se incrementará la demanda de cultivos en regiones áridas y semiáridas. Los agaves han sido usados como fuentes de comida, bebidas (mezcal) y fibras para sociedades desde hace cientos de años en México ya que pueden crecer en zonas marginales con temperaturas y sequías extremas gracias a sus adaptaciones morfológicas y metabólicas como el Metabolismo Ácido de las Crasuláceas (CAM por sus siglas en inglés) y a la producción de fructanos. Sin embargo, la cosecha de plantas silvestres para la obtención principalmente de mezcal conduce a la reducción de las poblaciones naturales y a la erosión genética. Por lo tanto, el objetivo de este estudio es determinar el efecto de las interacciones entre nutrientes minerales sobre la morfología, fisiología, y expresión de genes de plantas de Agave potatorum, Agave angustifolia y Agave salmiana, tres especies usadas para la producción tradicional de mezcal en México. Los resultados de este estudio permitirán conocer la capacidad de las plantas de agave de adquirir los nutrientes del suelo, permitirá entender el papel de los fructanos en respuesta a diferentes ambientes y eventualmente realizar una explotación sustentable del Agave basada en propuestas de manejo nutricional. Palabras Clave: mezcal, nutrición, estrés, erosión genética. Introducción El género Agave se incluye en la familia Asparagaceae, subfamilia Agavoidea (Bremer et al., 2009; Chase et al., 2016). Este género es endémico de América, se encuentra distribuido desde el sur de los Estados Unidos de América hasta el norte de Sudamérica (Good-Avila et al., 2006). Contiene alrededor de 210 especies, de las cuales 159 están en México y 129 son endémicas del territorio mexicano (García-Mendoza et al., 2019). Las comunidades humanas en México han utilizado al Agave desde hace 10,000 años obteniendo diferentes productos de sus diferentes estructuras (Callen, 1965). Las especies Agave tequilana y Agave angustifolia son cultivadas en plantaciones agroindustriales monoespecíficas; la primera para la extracción de tequila y la segunda ampliamente cultivada en Oaxaca para la obtención de mezcal (Conabio, 2006; Gentry, 1982). Las demás especies de Agave se encuentran en diferentes ambientes productivos desde producciones silvestres hasta agroecosistemas que incorporan la mayor parte de la biodiversidad y el conocimiento tradicional asociado al mezcal y que exhiben dificultades para su producción y conservación como la reducción de poblaciones naturales y erosión genética (Aguirre-Dagua and Eguiarte, 2012). En México, el 60% de su territorio está conformado en su mayoría por ecosistemas áridos y semiáridos en donde las plantas de Agave habitan (Lara-Ávila and Alpuche-Solís, 2016; Montaño et al., 2016). Allí, los suelos se caracterizan por presentar altos contenidos de carbonatos, pH alcalino, textura arcillosa, poca profundidad y baja disponibilidad de nutrientes (de Jesús Romero Fernández et al., 2019). En consecuencia, las plantas de Agave han evolucionado en adaptaciones fisiológicas y anatómicas que le permiten habitar ambientes donde el agua y los nutrientes son limitados (Nobel, 1988; Stewart, 2015). El arreglo en roseta de estas plantas permite una máxima absorción de la radiación fotosintéticamente activa y permite la canalización del agua condensada hacia su sistema radical superficial (Nobel, 1988). Las plantas de Agave incrementan el crecimiento de raíces laterales y la densidad y longitud de los pelos radiculares en la superficie del suelo para la adquisición de nutrientes limitantes y agua (Lynch, 2011; Miguel et al., 2013; Langlé-Argüello et al., 2019). A su vez, la disponibilidad de nutrientes desencadenan mecanismos de respuesta en la síntesis de moléculas protectantes o de reserva (Stewart, 2015). Es así que, plantas de Agave potatorum muestran incrementos en la producción de fructanos frente a condiciones de estrés (Langlé-Argüello et al., 2019). Los fructanos son polímeros solubles en agua basados en fructosa almacenados en vacuola, actúan como reservas de carbohidratos para ser usadas a largo plazo, tienen una alta capacidad bio-protectante y son usados para la producción de mezcal (Pérez-López and Simpson, 2020; Morales-Hernández et al., 2019). Se ha reportado que en condiciones de estrés, las plantas de Agave de las especies Agave tequilana y Agave inaequidens incrementan la expresión de fructosiltransferasas y la producción de fructanos como mecanismo de tolerancia (Suárez-González et al., 2014). Aunque estas especies de Agave crecen y se reproducen naturalmente en condiciones de estrés existe evidencia que demuestran que aplicaciones de nutrientes estimulan el crecimiento y la cantidad de azúcares almacenados y reducen su tiempo a cosecha (Enríquez del Valle et al., 2016; Langlé-Argüello et al., 2019; Martínez-Ramírez et al., 2013). Sin embargo, aún existe un amplio vacío en el conocimiento de la manera en que las plantas de las diferentes especies de Agave detectan, traducen y se adaptan a las señales provenientes de la disponibilidad de nutrientes en el medio que merecen ser abordadas para entender mejor la regulación en la nutrición de estas plantas entender el papel de los fructanos en respuesta a diferentes ambientes y eventualmente realizar una explotación sustentable del Agave basada en propuestas de manejo nutricional. Es por esto que, el objetivo de esta propuesta es determinar el efecto de las interacciones entre nutrientes minerales sobre la morfología, fisiología y expresión de genes de plantas de tres especies de Agave usadas para la producción tradicional de mezcal en México. Pregunta de investigación ¿Cómo es que las combinaciones e interacciones de nutrientes minerales pueden causar cambios a nivel morfológico, fisiológico y molecular, durante el crecimiento temprano de plantas de tres especies de agave mezcalero? Hipótesis Las plantas de agave presentarán alteraciones morfológicas, fisiológicas y moleculares en respuesta a las interacciones combinatorias entre nutrientes minerales. Por ejemplo, de acuerdo a Bouain et al. (2019) las modificaciones en los niveles de P y la interacción con Fe y Zn modifican la arquitectura de la raíz, afectan el crecimiento y reducen la acumulación de fructanos en plantas de Agave.. Objetivos específicos 1. Determinar las modificaciones sobre la arquitectura y el crecimiento del brote y raíz de plantas de Agave potatorum, Agave angustifolia y Agave salmiana sometidas a variaciones en las concentraciones de nutrientes minerales. 2. Determinar los cambios en la fisiología de plantas de Agave potatorum, Agave angustifolia y Agave salmiana sometidas a variaciones en las concentraciones de nutrientes minerales. 3. Determinar a nivel molecular metabólico el efecto de variaciones en las concentraciones de nutrientes minerales en plantas de Agave potatorum, Agave angustifolia y Agave salmiana Antecedentes Producción de Mezcal El término mezcal proviene de la palabra náhuatl mexcalli “Agave al horno” aplicado a las bebidas alcohólicas destiladas de forma tradicional en regiones ubicadas en el norte de Tamaulipas y Sonora hasta el sur de Oaxaca (Aguirre-Dugua and Eguiarte, 2013). La producción de mezcal hace parte de un sistema de producción altamente localizado, con prácticas altamente especializadas que lo hacen difícil de imitar o producir en otro espacio geográfico (Camacho Vera et al., 2020). El mezcal, se identifica con la región de Oaxaca dentro de una macro región definida en criterios normativos de la Denominación de Origen Protegida Mezcal (DOP Mezcal). Así mismo, la Norma oficial mexicana 070-SCFI-1994 define al mezcal como una bebida alcohólica que se obtiene por destilación de los jugos derivados de la fermentación de cabezas cocidas de maguey de cualquier especie de agave, siempre y cuando sea cosechado dentro del área considerada como protegida por la DOP Mezcal (Comite Consultivo Nacional, 2016). Últimamente, el mezcal ha llegado a convertirse en una bebida de moda en el mercado mundial de bebidas alcohólicas, gracias a su proceso artesanal, exótico y genuino que lo diferencia de otros procesos de bebidas similares como el tequila, aumentando su demanda. Variedades de agave Por su parte, los seres humanos facilitaron la aparición de nuevas especies de Agave (Lara-Ávila and Alpuche-Solís, 2016; Parker et al., 2010). Entre las especies de Agave de importancia económica utilizadas para obtener el Mezcal se destacan; Agave angustifolia es la especie de Agave con mayor distribución desde Panamá hasta el estado de Sonora. Es ampliamente cultivada en el estado de Oaxaca y es la principal fuente del mezcal comercial producido en México (Aguirre-Dugua and Eguiarte, 2013; Gentry, 2021). Creciendo en ambientes tropicales de bosques de pino y matorrales xerófilos entre 300 y 1800 metros sobre el nivel del mar (Gentry, 2021). La morfología de esta especie presenta rosetas de 1.5 a 2.0 m de altura y 1.5 a 2.0 de ancho. Se presentan de 40 a 120 hojas por individuo de forma lanceolada, rígida, cóncava de coloración verde claro, de 60 a 120 cm de largo y 35 -10 cm de ancho (Gentry, 2021). El Agave salmiana se localiza en los estados de Zacatecas, San Luis de Potosí y Durango, México. En las poblaciones silvestres se han descrito las variantes 'Blanco', 'Chino' y 'Liso' usadas principalmente para fabricar mezcal. Sus plantas adultas presentan diferencias morfológicas en sus hojas y espinas laterales y en su reacción a la temperatura de germinación en condiciones de laboratorio (Díaz et al., 2011). Es una especie con rosetas de 1.5 a 2.0 m de altura con raíz "fibrosa", hojas de color verde obscuro a verde glauco, emite un escapo floral de hasta 4 m entre los 8 y 10 años de edad, con flores hermafroditas amarillo-verdosas de 10-12 cm de largo; el fruto es una cipsula oblonga con pequeñas semillas negras (Gentry, 2021). Agave potatorum llamada comúnmente maguey tobalá. Es una especie de Agave silvestre representativa por su uso para obtener mezcal del suroeste de México. Es endémica de las pendientes en la Sierra Madre del Sur y del Valle de Tehuacán. Plantas de esta especie se encuentran en ecosistemas secos como bosques de encino y bosques tropicales caducifolios considerados entre los tipos de vegetación más amenazados en México debido a la fragmentación y perturbación causada por actividades de desmonte, pastoreo y deforestación (Trejo et al., 2000). Se ha reportado que esta especie depende únicamente de la reproducción sexual debido a que no produce bulbos ni ramificaciones laterales (García-Meneses, 2004). El sistema de extracción de plantas de A. potatorum se basa en la extracción de plantas reproductivas anualmente bajo un enfoque forestal y contrasta con los periodos de 5 a 8 años para cosecha de A angustifolia y A. tequilana (Aguirre-Dugua and Eguiarte, 2013). Metabolismo del agave y adaptaciones fisiológicas en respuesta al estrés Los agaves han sido usados como fuentes de comida, bebidas y fibras para sociedades desde hace cientos de años en México. El Agave exhibe potencial como cultivo ya que puede crecer en zonas marginales áridas y semiáridas gracias a la evolución de adaptaciones como el metabolismo ácido de las crasuláceas (CAM) que le permite sobrevivir en condiciones de temperaturas y sequías extremas (Stewart, 2015). Este mecanismo está presente en Agave, lo que significa que el aporte de ganancias diurnas de CO2 por el mecanismo C3, que también se encuentra presente, es casi nulo. Reflejándose en una baja plasticidad fotosintética en plantas de Agave y maximizando el uso eficiente del agua al fijar el carbono en la noche (Holtum and Winter, 2014). Así mismo, las hojas suculentas y ricas en fibra permiten la fijación continua de CO2 y demás procesos bioquímicos aun en extensos periodos de sequía que pueden alcanzar 7 años o más (Lüttge, 2010). La morfología de la planta de Agave ha evolucionado para permitir su establecimiento y colonización de ambientes desérticos y suelos rocosos y de baja fertilidad (Gentry, 2021; Nobel, 1988). Las interacciones entre nutrientes minerales y la arquitectura de la raíz Las interacciones entre nutrientes inducen cambios en el desarrollo de las plantas como modificaciones en la arquitectura del sistema radical (Richardson et al., 2009). Se han reportado varios efectos antagónicos, sinérgicos y nulos de la combinación de deficiencias de nutrientes sobre la arquitectura del sistema radical en comparación con las deficiencias de un solo nutriente (Kellermeier et al., 2014; Ward et al., 2008). En el caso de las plantas de Agave los incrementos en la fertilización nitrogenada (N) aumentaron el peso seco de los brotes sin cambios en el peso seco de la raíz, cuando el elemento que varía es el fósforo (P), las plantas de Agave reducen el crecimiento de sus raíces en respuesta a los incrementos de este nutriente (Quero and Linares, 1988). En ambos casos, se reduce la relación raíz/brote, esta reducción en tamaño de la raíz puede ser una adaptación o una desventaja para la adquisición de agua y otros nutrientes. Así que, estudiar la capacidad de las plantas de agave de adquirir los nutrientes del suelo es un objetivo primordial para facilitar su explotación sustentable. En México, predominan los ecosistemas áridos y semiáridos abarcando un 60% de su territorio (Montaño et al., 2016). Allí, los suelos se caracterizan por presentar altos contenidos de carbonatos, pH alcalino, textura arcillosa, poca profundidad y baja disponibilidad de fósforo (de Jesús Romero Fernández et al., 2019). El fósforo (P) es un macronutriente esencial para el crecimiento y desarrollo de las plantas. Se encuentra en los ácidos nucleicos (ADN), en las moléculas fuente de energía como el ATP y actúa en la regulación de las señales de transducción vía fosforilación (Bouain et al., 2019). En el suelo la distribución del fósforo es heterogénea usualmente se encuentra en las capas superiores (Heppell et al., 2015). El hierro (Fe) y el Zinc (Zn) están involucrados en procesos biológicos que aseguran el adecuado funcionamiento celular. Son cofactores de numerosas enzimas y están involucrados en los procesos de fotosíntesis y respiración (Couturier et al., 2013). La reducción en el crecimiento de la raíz en deficiencias de P ha sido propuesta como un resultado de la toxicidad de Fe (Ward et al., 2008). Como adaptación, las plantas incrementan el crecimiento de las raíces laterales y la densidad y longitud de los pelos radiculares en las capas superficiales para la adquisición de fósforo (Lynch, 2011; Miguel et al., 2013). A su vez, modificaciones en las concentraciones de nutrientes incrementaron la producción de fructanos en plantas de Agave potatorum. Sin embargo, La manera en que las plantas de Agave detectan, traducen y se adaptan a las señales provenientes de la disponibilidad de nutrientes en el medio son cuestiones biológicas que merecen ser abordadas para entender mejor la regulación en la nutrición de estas plantas. Los fructanos y sus propiedades en plantas de Agave Los fructanos son polímeros solubles en agua basados en fructosa sintetizados a partir de sacarosa y acumulados en la vacuola. Actúan como reservas de carbohidratos para ser usadas a largo plazo (Pérez-López and Simpson, 2020). Los fructanos presentan características como estructura flexible, alta solubilidad, acumulación en altos niveles y asociación con membrana celular estas propiedades son intrínsecas a su papel en la señalización en el desarrollo y en las respuestas al estrés (Van den Ende, 2013; Versluys et al., 2018). Los Agaves utilizan los fructanos como fuente de carbohidratos para el cambio entre la etapa vegetativa y la reproductiva. El rápido crecimiento de la inflorescencia demanda grandes reservas de fructanos, razón por la cual la inflorescencia es removida en condiciones de cultivo (Pérez-López and Simpson, 2020). Así mismo, los fructanos son también utilizados durante la reproducción asexual dado que los chupones se producen a partir de rizomas o bulbillos en las inflorescencias y dependen de los fructanos almacenados en la planta madre (Szarek et al., 1996). La especie Agave victoria-reginae acumula fructanos en el tejido de hidrénquima de las hojas apoyando la evolución de la acumulación de fructanos como una adaptación de Agavaceae a condiciones áridas (Singh et al., 2020). Metodología Ob. 1. Determinar las modificaciones sobre la arquitectura y el crecimiento del brote y raíz de plantas de Agave potatorum, Agave angustifolia y Agave salmiana sometidas a limitaciones en nutrientes. Actividad 1. Obtención de las plantas de Agave y establecimiento de las condiciones de crecimiento. Las plantas de Agave de las tres especies seleccionadas se obtendrán a partir de semillas recolectadas en campo en localidades de los estados de Oaxaca, Jalisco, Michoacán y Zacatecas lugares donde crecen naturalmente y son cultivadas las tres especies Así mismo, se tendrá en cuenta las plantas de Agave de la colección del Jardín Botánico (UNAM) y de estas se recolectarán semillas de ser necesario. Las semillas de estas plantas serán desinfectadas durante 5 minutos en lejía comercial al 70% y lavadas tres veces con agua destilada dentro de una campana de flujo laminar con filtro HEPA. Posteriormente, se suspenderán en agar al 0,1% para facilitar su manipulación y adhesión a la placa de siembra. Las semillas se sembrarán en placas de Petri de 12 × 12 cm (Greiner Bio-One, Cat 688102), con 75 ml de medio Murashige-Skoog al 50 % (Caisson Labs, Cat MSP09-1LT), con 0,05 sales MES (MP Biomedicals, Cat 152454), con un pH a 5,7 y agar al 1 % (Sigma Life Science, Cat A1296-1KG). Las plántulas de Agave crecerán en cámaras de crecimiento en condiciones controladas de temperatura 27°C, humedad relativa del 80% luz continúa suministrada con tubos fluorescentes. Actividad 2. Establecimiento de los tratamientos nutricionales y determinación de variables de crecimiento y morfología. Plantas de Agave regeneradas a partir del cultivo In-vitro serán sometidas a tratamientos de variaciones en las concentraciones de P, Fe y Zinc. Se establecerán tratamientos de acuerdo a Bouain et al. (2019), con ligeras modificaciones que se realizará mediante experimentos previos sobre plántulas de Agave. Modificación del medio de cultivo de acuerdo con la concentración y el nutriente mineral a variar. Se determinarán variables de crecimiento como longitud, pesos secos de parte aérea y raíz y se evaluarán las modificaciones en la arquitectura de la raíz de acuerdo con Rosas et al. (2021). Ob. 2. Determinar los cambios en la fisiología de plantas de Agave potatorum, Agave angustifolia y Agave salmiana sometidas a limitaciones en nutrientes. Actividad 1. Establecimiento de los tratamientos variaciones en la concentración de los nutrientes Plantas de Agave obtenidas en el Ob. 1. Actividad 1. se cultivarán en dos conjuntos; en dos tratamientos de nutrición. Se cultivará un primer conjunto de plantas en cultivo hidropónico con solución nutritiva Hoagland; La solución nutritiva se renovará y se ajustará el pH 6.5 cada día y se aireará diariamente a las 7:00~9:00, 11:00~13:00 y 15:00~17:00 (Xie et al., 2018). Un segundo conjunto de plantas se cultivará en suelo. Posteriormente, se asignan los tratamientos de elementos minerales que hayan presentado diferencias significativas en el objetivo 1. Todas las demás condiciones ambientales (por ejemplo, intensidad y calidad de la luz, eliminación del aire, duración del fotoperíodo) serán idénticas y controladas (Perdomo et al., 2017). Actividad 2. Evaluación de variables fotosintéticas, concentración de ácidos en tejidos y variables de crecimiento y desarrollo La tasa de fotosíntesis (Pn), la conductancia estomática (gs) y la transpiración (E) serán medidas en las hojas de las plantas de Agave, usando un sistema portátil conectado a un analizador infrarrojo de El uso eficiente del agua (WUE) será calculado con los datos de fotosíntesis y transpiración (Pn/E). Se registraron las variables de tasa de transporte de electrones (ETR), eficiencia fotoquímica actual del PSII (ФPSII), quenching fotoquímico (qP), quenching no fotoquímico (NPQ), Eficiencia fotoquímica máxima del PSII (Fv/Fm) y Fluorescencia máxima (Fm). Después de lo cual se recolectarán las raíces más jóvenes (en la parte inferior de 10 cm de la raíz) y la parte aérea, se pesarán, se congelarán en N2 líquido, se pulverizan y se almacenan a -80 ° C hasta el análisis metabolitos y extracción de RNA. Ob. 3. Determinar a nivel molecular el efecto de la limitación de nutrientes en plantas de Agave potatorum, Agave angustifolia y Agave salmiana Actividad 1. Determinación de partidores específicos de genes candidatos involucrados en la síntesis y degradación de fructanos, extracción, determinación de pureza e integridad de RNA De los tratamientos contrastantes en el Ob. 2., se tomarán las muestras almacenadas en N2 a -80°C y se realizará la extracción de RNA siguiendo el protocolo de (Maceda-López et al., 2021). Seguido a esto, se realizará una búsqueda en las bases de datos de NCBI y revisión bibliográfica de genes candidatos asociados a la síntesis y degradación de fructanos. Cada una de las muestras de RNA total, se cuantifican en el equipo NanoDrop One (Thermo Scientific©) y se determina su pureza de acuerdo con los datos de las relaciones A260/A280 y A260/A230. En cada uno de estos valores son >2.0 corresponden a muestras de alta pureza. Para la observación de la integridad se realiza una electroforesis en un gel de agarosa al 1%. Para la síntesis de cDNA mediante una PCR-RT previamente se realiza un tratamiento de DNAasa (Promega©). Para la obtención de cDNA se utiliza una transcriptasa reversa SuperScript™ (Invitrogen©). Actividad 2. Determinación de la expresión (niveles de expresión) de genes candidatos involucrados en la síntesis y degradación de fructanos en tejidos de plantas de Agave. Se va a realizar con cada una de las muestras análisis de niveles de expresión (qRT- PCR) de los genes candidatos asociados a la síntesis y degradación de fructanos identificados en ob. 3. Actividad 1. Cronograma OBJETIVOS ESPECÍFICOS PROPUESTA Año 2022 Año 2023 Año 2024 Año 2025 1 2 3 4 1 2 3 4 1 2 3 4 1 2 3 4 Preparación de propuesta de investigación Act1. Preparación de presentación del proyecto de título Act2.Preparación documento del proyecto de título Act3.Familiarización con sistemas de cultivo in-vitro con plantas de Agave Act4. Protocolos de extracciones de RNA en algunas muestras de Agave Act 5. Protocolos de medición de variables fotosintéticas en hojas de plantas de Agave. OBJ 1: Determinar las modificaciones sobre la arquitectura y el crecimiento del brote y raíz de plantas de Agave potatorum, Agave angustifolia y Agave salmiana sometidas a limitaciones en nutrientes. Act 1. Obtención de las plantas de Agave y establecimiento de las condiciones de crecimiento Act 2. Establecimiento de los tratamientos nutricionales y determinación de variables de crecimiento y morfología Análisis de resultados Escritura Primer articulo OBJ 2: Determinar los cambios en la fisiología de plantas de Agave potatorum, Agave angustifolia y Agave salmiana sometidas a limitaciones en nutrientes. Act 1: Establecimiento de los tratamientos variaciones en la concentración de los nutrientes Act 2. . Evaluación de tasa fotosintética, concentración de ácidos en tejidos y variables de crecimiento y desarrollo Análisis de resultados Envío de segundo artículo OBJ 3: Determinar a nivel molecular el efecto de la limitación de nutrientes en plantas de Agave potatorum, Agave angustifolia y Agave salmiana Act 1. Determinación de partidores específicos de genes candidatos fructosiltransferasas y fructano exohidrolasas Act 2. Determinación de la expresión (niveles de expresión) de genes candidatos fructosiltransferasas y fructano exohidrolasas en tejidos de plantas de Agave Análisis de resultados Redacción de articulo 3 Escritura tesis Defensa tesis Literatura consultada Aguirre-Dugua, X., Eguiarte, L.E., 2013. Genetic diversity, conservation and sustainable use of wild Agave cupreata and Agave potatorum extracted for mezcal production in Mexico. J. Arid Environ. 90, 36–44. https://doi.org/10.1016/j.jaridenv.2012.10.018 Bouain, N., Korte, A., Satbhai, S.B., Nam, H.I., Rhee, S.Y., Busch, W., Rouached, H., 2019. Systems genomics approaches provide new insights into Arabidopsis thaliana root growth regulation under combinatorial mineral nutrient limitation. PLoS Genet. 15, e1008392. https://doi.org/10.1371/journal.pgen.1008392 Bremer, B., Bremer, K., Chase, M.W., Fay, M.F., Reveal, J.L., Bailey, L.H., Soltis, D.E., Soltis, P.S., Stevens, P.F., Anderberg, A.A., Moore, M.J., Olmstead, R.G., Rudall, P.J., Sytsma, K.J., Tank, D.C., Wurdack, K., Xiang, J.Q.Y., Zmarzty, S., 2009. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Bot. J. Linn. Soc. 161, 105–121. https://doi.org/10.1111/j.1095-8339.2009.00996.x Callen, E.O., 1965. Food habits of some pre-columbian Mexican Indians. Econ. Bot. 19, 335–343. https://doi.org/10.1007/BF02904803 Camacho Vera, J.H., Vargas Canales, J.M., Durán Ferman, P., 2020. Avatares de la producción de mezcal en la región miahuateca de la Sierra Sur de Oaxaca. LiminaR Estud. Soc. y Humanísticos 19, 183–194. https://doi.org/10.29043/liminar.v19i1.794 Chase, M.W., Christenhusz, M.J.M., Fay, M.F., Byng, J.W., Judd, W.S., Soltis, D.E., Mabberley, D.J., Sennikov, A.N., Soltis, P.S., Stevens, P.F., Briggs, B., Brockington, S., Chautems, A., Clark, J.C., Conran, J., Haston, E., Möller, M., Moore, M., Olmstead, R., Perret, M., Skog, L., Smith, J., Tank, D., Vorontsova, M., Weber, A., 2016. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Bot. J. Linn. Soc. 181, 1–20. https://doi.org/10.1111/boj.12385 Comite Consultivo Nacional, 2016. Norma Oficial Mexicana NOM-070-SCFI-2016. Couturier, J., Touraine, B., Briat, J.F., Gaymard, F., Rouhier, N., 2013. The iron-sulfur cluster assembly machineries in plants: Current knowledge and open questions. Front. Plant Sci. https://doi.org/10.3389/fpls.2013.00259 de Jesús Romero Fernández, A., Mota, R.M.A., Mendoza-Villarreal, R., 2019. Isolation and selection of solubilizing phosphate soil fungi native to Coahuila state, Mexico. Acta Bot. Mex. https://doi.org/10.21829/ABM126.2019.1390 Díaz, E.V., García Nava, J.R., Peña Valdivia, C.B., Ramírez Tobías, H.M., Ramos, V.M., 2011. Tamaño de la semilla, emergencia y desarrollo de la plśntula de maguey (Agave salmiana Otto ex Salm-Dyck). Rev. Fitotec. Mex. 34, 167–173. https://doi.org/10.35196/rfm.2011.3.167 Enríquez del Valle, J.R., Alcara Vázquez, S.E., Rodríguez Ortiz, G., Miguel Luna, M.E., Vázquez, C.M., 2017. Fertirriego en vivero a plantas de Agave potatorum Zucc micropropagadas-aclimatizadas. Rev. Mex. Ciencias Agrícolas 7, 1167–1177. https://doi.org/10.29312/remexca.v7i5.240 García-Mendoza, A.J., Martínez, I.S.F., Gutiérrez, D.S., 2019. Four new species of Agave (Asparagaceae, Agavoideae) from southern Mexico. Acta Bot. Mex. 126, 1–18. https://doi.org/10.21829/abm126.2019.1461 García-Meneses, P.M., 2004. Reproducción y germinación de Agave cupreata Trel. and Berger (Agavaceae) en la localidad de Ayahualco. Universidad Nacional Autónoma de México,. Gentry, H.S., 2021. Agaves of Continental North America, Agaves of Continental North America. https://doi.org/10.2307/j.ctv1t4m2h4 Good-Avila, S. V., Souza, V., Gaut, B.S., Eguiarte, L.E., 2006. Timing and rate of speciation in Agave (Agavaceae). Proc. Natl. Acad. Sci. U. S. A. 103, 9124–9129. https://doi.org/10.1073/pnas.0603312103 Groenewald, E., Wessels, D., Koeleman, A., 1977. Callus formation and subsequent plant regeneration from seed tissue of an Agave species (Agavaceae). Zeitschrift für Pflanzenphysiologie 81, 369–373. https://doi.org/10.1016/s0044-328x(77)80105-0 Heppell, J., Talboys, P., Payvandi, S., Zygalakis, K.C., Fliege, J., Withers, P.J.A., Jones, D.L., Roose, T., 2015. How changing root system architecture can help tackle a reduction in soil phosphate (P) levels for better plant P acquisition. Plant, Cell Environ. 38, 118–128. https://doi.org/10.1111/pce.12376 Holtum, J.A.M., Winter, K., 2014. Limited photosynthetic plasticity in the leaf-succulent CAM plant Agave angustifolia grown at different temperatures. Funct. Plant Biol. 41, 843–849. https://doi.org/10.1071/FP13284 Kellermeier, F., Armengaud, P., Seditas, T.J., Danku, J., Salt, D.E., Amtmann, A., 2014. Analysis of the root system architecture of Arabidopsis provides a quantitative readout of crosstalk between nutritional signals. Plant Cell 26, 1480–1496. https://doi.org/10.1105/tpc.113.122101 Langlé-Argüello, L.A., Martínez-Gutiérrez, G.A., Santiago-García, P.A., Escamirosa-Tinoco, C., Morales, I., Enríquez-Del-Valle, J.R., 2019. Nutrient Solutions and Drought in Plant Growth and Fructans Content of Agave potatorum Zucc. HortScience 54, 1581–1584. https://doi.org/10.21273/HORTSCI14129-19 Lara-Ávila, J.P., Alpuche-Solís, Á.G., 2016. Análisis de la diversidad genética de agaves mezcaleros del centro de México. Rev. Fitotec. Mex. 39, 323–330. https://doi.org/10.35196/rfm.2016.3.323-330 Lüttge, U., 2010. Ability of crassulacean acid metabolism plants to overcome interacting stresses in tropical environments. AoB Plants 2010. https://doi.org/10.1093/aobpla/plq005 Lynch, J.P., 2011. Root phenes for enhanced soil exploration and phosphorus acquisition: Tools for future crops. Plant Physiol. 156, 1041–1049. https://doi.org/10.1104/pp.111.175414 Maceda-López, L.F., Villalpando-Aguilar, J.L., García-Hernández, E., Ávila de Dios, E., Andrade-Canto, S.B., Morán-Velázquez, D.C., Rodríguez-López, L., Hernández-Díaz, D., Chablé-Vega, M.A., Trejo, L., Góngora-Castillo, E., López-Rosas, I., Simpson, J., Alatorre-Cobos, F., 2021. Improved method for isolation of high-quality total RNA from Agave tequilana Weber roots. 3 Biotech 11, 1–10. https://doi.org/10.1007/s13205-020-02620-8 Martínez-Ramírez, S., Trinidad-Santos, A., Bautista-Sánchez, G., César Pedro-Santos, E., 2013. Crecimiento de plántulas de dos especies de mezcal en función del tipo de suelo y nivel de fertilización. Rev. Fitotec. Mex. 36, 387–393. https://doi.org/10.35196/rfm.2013.4.387 Miguel, M.A., Widrig, A., Vieira, R.F., Brown, K.M., Lynch, J.P., 2013. Basal root whorl number: A modulator of phosphorus acquisition in common bean (Phaseolus vulgaris). Ann. Bot. 112, 973–982. https://doi.org/10.1093/aob/mct164 Montaño, N.M., Ayala, F., Bullock, S.H., Briones, O., Oliva, F.G., Sánchez, R.G., Maya, Y., Perroni, Y., Siebe, C., Torres, Y.T., Troyo, E., 2016. Almacenes Y Flujos De Carbono En Ecosistemas Áridos Y Semiáridos De México : Síntesis Y Perspectivas. Terra Latinoam. 34, 39–59. Morales-Hernández, J.A., Singh, A.K., Villanueva-Rodriguez, S.J., Castro-Camus, E., 2019. Hydration shells of carbohydrate polymers studied by calorimetry and terahertz spectroscopy. Food Chem. 291, 94–100. https://doi.org/10.1016/j.foodchem.2019.03.132 Nobel, P.S., 1988. Environmental Biology of Agaves and Cacti. Park S. Nobel. Cambridge University Press., New York, NY. https://doi.org/10.1086/416158 Nobel, P.S., Quero, E., Linares, H., 1989. Root versus shoot biomass: responses to water, nitrogen, and phosphorus applications for Agave lechuguilla. Bot. Gaz. 150, 411–416. https://doi.org/10.1086/337787 Parker, K.C., Trapnell, D.W., Hamrick, J.L., Hodgson, W.C., Parker, A.J., 2010. Inferring ancient Agave cultivation practices from contemporary genetic patterns. Mol. Ecol. 19, 1622–1637. https://doi.org/10.1111/j.1365-294X.2010.04593.x Pérez-López, A. V., Simpson, J., 2020. The Sweet Taste of Adapting to the Desert: Fructan Metabolism in Agave Species. Front. Plant Sci. https://doi.org/10.3389/fpls.2020.00324 Quero, E., Linares, H., 1988. Differential growth resporses of agaves to nitrogen, phosphorus, potassium, and boron applications. J. Plant Nutr. 11, 1683–1700. https://doi.org/10.1080/01904168809363925 Richardson, A.E., Barea, J.M., McNeill, A.M., Prigent-Combaret, C., 2009. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms. Plant Soil. https://doi.org/10.1007/s11104-009-9895-2 Rosas, U., Lara-González, J.A., De-la-Rosa-Tilapa, A., Terrazas, T., 2021. Persistent adventitious and basal root development during salt stress tolerance in Echinocactus platyacanthus (Cactaceae) seedlings. J. Arid Environ. 187. https://doi.org/10.1016/j.jaridenv.2020.104431 Singh, A.K., Pérez-López, A. V., Simpson, J., Castro-Camus, E., 2020. Three-dimensional water mapping of succulent Agave victoriae-reginae leaves by terahertz imaging. Sci. Rep. 10. https://doi.org/10.1038/s41598-020-58277-z Stewart, J.R., 2015. Agave as a model CAM crop system for a warming and drying world. Front. Plant Sci. https://doi.org/10.3389/fpls.2015.00684 Suárez-González, E.M., López, M.G., Délano-Frier, J.P., Gómez-Leyva, J.F., 2014. Expression of the 1-SST and 1-FFT genes and consequent fructan accumulation in Agave tequilana and A. inaequidens is differentially induced by diverse (a)biotic-stress related elicitors. J. Plant Physiol. 171, 359–372. https://doi.org/10.1016/j.jplph.2013.08.002 Szarek, S.R., Driscoll, B., Shohet, C., Priebe, S., 1996. Bulbil production in Agave (Agavaceae) and related genera. Southwest. Nat. 41, 465–469. Trejo, I., conservation, R.D.-B., 2000, undefined, 2000. Deforestation of seasonally dry tropical forest: a national and local analysis in Mexico. Elsevier. Van den Ende, W., 2013. Multifunctional fructans and raffinose family oligosaccharides. Front. Plant Sci. https://doi.org/10.3389/fpls.2013.00247 Versluys, M., Kirtel, O., Toksoy Öner, E., Van den Ende, W., 2018. The fructan syndrome: Evolutionary aspects and common themes among plants and microbes. Plant Cell Environ. https://doi.org/10.1111/pce.13070 Ward, J.T., Lahner, B., Yakubova, E., Salt, D.E., Raghothama, K.G., 2008. The effect of iron on the primary root elongation of Arabidopsis during phosphate deficiency. Plant Physiol. 147, 1181–1191. https://doi.org/10.1104/pp.108.118562