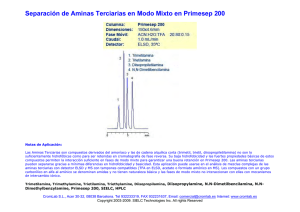
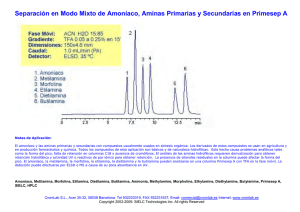
Identificación de aminas. Sara Abello Castañeda-Juliana Rincón López. Escuela de Química UTP. Noviembre 2016. El comportamiento químico y físico de una molécula orgánica se debe principalmente a la presencia en su estructura de uno o varios grupos, funciones o familias químicas. Los grupos funcionales son agrupaciones constantes de átomos, en disposición espacial y conectividad, que por tal regularidad confieren propiedades físicas y químicas muy similares a la estructura que las posee.[1] Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de uno o varios de los hidrógenos de la molécula de amoníaco por otros sustituyentes como radicales alcohólicos (aminas alifáticas) o aromáticos (aminas aromáticas) [2]. La química de las aminas está dominada por el par de electrones no compartidos del nitrógeno, el cual imparte a dichos compuestos tanto un carácter básico como nucleófilo, las aminas primarias secundarias y terciarias tienen propiedades nucleófilas similares. La diferencia más importante reside en el hecho de que, a diferencia de las aminas terciarias, las aminas primarias y secundarias tienen un protón que puede perderse una vez ha tenido lugar la adición nucleofílica. Por consiguiente existe una distinción entre la reactividad de las aminas primarias y secundarias con respecto a las terciarias. [3] Figura 1. Tipos de aminas con respecto a la posición en la cadena. Figura 2. Tipos de amina con respecto al tipo de cadena La identificación de estos tipos de aminas se da por medio de diferentes reacciones, las cuales arrojan resultados positivos o negativos según la solución problema a analizar. I. PROCEDIMIENTO. Se siguió el procedimiento del libro MANUAL DE PRÁCTICAS DE LABORATORIO de Jaime Niño, de la práctica titulada REACCIONES DE IDENTIFICACIÓN Y PREPARACIÓN DE DERIVADOS DE LAS AMINAS. Durante se práctica se analizaron tres aminas conocidas (N, N-Dimetilanilina, Anilina, N-metilanilina) por medio de la prueba de lignina, comportamiento frente al anhídrido acético, prueba de Hinsberg, prueba de ácido nitroso, prueba de feniltioúreas, prueba de schotten-Baumann, con el fin de identificar las características particulares de cada una de ellas y así observar como son el “positivo y negativo” de cada una además de comparar los resultados obtenidos con los esperados. En la tabla 1 se muestra el fundamento teórico de cada una de las pruebas y se especula el resultado con respecto a las aminas que se puedan evaluar. Tabla 1. Pruebas de aminas, fundamento teórico. Prueba Fundamento teórico Especulación Lignina La lignina es un polímero fenólico reticulado, presente principalmente en la pared celular de las plantas, al exponerse a una amina primaria o secundaria los pares libres de electrones de estas se unen a los monómeros catalizados por ácidos, generando un cambio de color. 1°= Positivo. 2°= Positivo. 3°= Negativo. Comportamien to frente al anhídrido acético Los anhídridos reaccionan con las aminas para formar ácido acético y ácidos carboxílicos. Dependiendo de su impedimiento estérico que va de manera creciente de 1° a 3°, es el tiempo de reacción debido al ataque nucleofílico.[5] Figura 3. Estructura polimérica de lignina. Fígura 4. Esquema general de reacción. 1°= positivo, rápido. 2°= positivo, velocidad normal. 3°= positivo o negativo dependiendo de los grupos sustituyentes de la amina, lento. Hinsberg Ácido nitroso Permite diferenciar los tres tipos de aminas. Un reactivo que contiene una solución acuosa de hidróxido de sodio y cloruro de bencensulfonilo se agregado a un sustrato. 1°: formará una sal sulfonamida soluble, que precipita después de la adición de ácido clorhídrico diluido. 2°: en la misma reacción, formará directamente una sulfonamida insoluble 3°: no reaccionará con el cloruro de bencensulfonilo, sino que seguirá insoluble. Después de agregar ácido diluido, la amina insoluble se convertirá en una sal de amonio soluble. 1°: precipitado. 2°: precipitado insoluble desde el principio. 3°: soluble. Fígura 5 Reacción de Hinsberg con cada uno de los tipos de aminas. Identificación de aminas aromáticas (1°,2° y 3°) y alifáticas. Las sales de diazonio alifáticas son muy inestables, Las sales de diazonio a partir de aminas aromáticas primarias son muy estables. A partir de aminas secundarias aromáticas se forman N-nitrosoaminas. Y a partir de las aminas terciarias aromáticas no reaccionan. Alifáticas: negativo. 1° Aromáticas: formación de sal de diazonio. 2° Aromática: formación de Nnitrosoamina. 3° Aromática: no reacciona. Figura 6. Formación de la sal de diazonio. Preparación feniltioúreas Las feniltioúreas sólo se forman a partir de aminas primarias o secundarias en presencia de isotiocianato de fenilo. Figura 7.Preparación de feniltioureas. 1°: positiva. 2°: positiva. 3° : negativa Solubilidad SchottenBaumann Las aminas 1°, 2° y 3° forman puentes de hidrógeno con el agua, como resultado las aminas menores son bastante solubles en agua y tienen solubilidad límite al alcanzar los 6 átomos de carbono (ya que disminuye su polaridad), estas son más solubles en éter, alcohol, benceno.[4] Fígura 8. Puentes de hidrógeno de las aminas. Formación de amidas a partir de un cloruro de acilo y una amina. Fígura 9. Reacción de schotten-bauman. Al tener en estudio los tres tipos de aminas (1°, 2° y 3°) se puede identificar el comportamiento de cada una por separado y así concluir los tipos de aminas problema. En la siguiente tabla se describe los resultados de las pruebas antes mencionadas, y el resultado teórico por el tipo de amina. Tabla 2.Tabla con resultados teóricos y experimentales para cada amina evaluada. Siendo (+) positivo y (-) negativo Prueba Agua NaOH HCl Anhidrido acético Solubilidad N,N-Dimetilanilina Teórico Experimental + + +(3°) +(3°) Lignina - Hinsberg Ácido nitroso 3° Feniltioureas - +/-(color amarillo leve)(3°) Teórico + +(1°) + Anilina Experimental + +(1°) +(1° o 2°) 1° - + N-metilanilina Teórico Experimental + + +(2°) +(2°) + +(1° o 2°) 2° + + P1 P2 + + + +(2°) + +(1°) +/-(color amarillo leve)(3°) 1° +(1° o 2°) 3° + +(1° o 2°) -(3°) Schotten-Baumann II. CONCLUSIONES. - Para obtener resultados concretos a pruebas de identificación se deben hacer mínimo por triplicado para tener repetitividad y poder realizar un análisis robusto con bases experimentales confiables. - A través de pruebas sencillas, rápidas y con pequeñas cantidades de reactivos se pueden identificar muchas características de una sustancia problema. III. PREGUNTAS. IV. BIBLIOGRAFÍA. Preguntas sobre aminas Qu1: Para cada una de las siguientes series de compuestos, organice las moléculas en orden de basicidad decreciente (de la más básica a la menos básica): (a) (B) (C) Qu 2: (D) ¿Cuáles serían los principales productos de las siguientes reacciones? Qu 3: Diseñe síntesis de las siguientes aminas utilizando eteno como única fuente de átomos de carbono: 1-amino etano, 1-amino propano, 1-aminobutano Qu 4: ¿Cuáles serían los principales productos de las reacciones de la ciclohexilamina con cada uno de los siguientes? (a) cloruro de etanoilo / Et3N (b) bromuro de hidrógeno (c) ciclohexanona en un tampón ácido (d) óxido de etileno seguido de tratamiento con ácido diluido. (e) exceso de yoduro de etilo (f) exceso de yoduro de metilo y luego Ag 2 O / H 2 O / calor ¿Cuáles serían los principales productos de las reacciones de la piperidina (ver a la derecha) con cada uno de los siguientes: (a) cloruro de benzoílo / Et 3 N (b) bromuro de hidrógeno (d) óxido de etileno seguido de tratamiento con (c) ciclohexanona en un tampón ácido ácido diluido. (f) exceso de yoduro de metilo y luego Ag 2 O / (e) cloruro de bencilo H 2 O / calor Qu 5: Qu 6: Diseñe una síntesis eficiente de lo siguiente a partir de benceno y cualquier reactivo inorgánico. (a) 1-bromo-3-yodobenceno (c) fenol ¿Respuestas? (b) N, N-dimetil benzamida (d) 4-bromoanilina Respuestas de amina Qu1: (a) Use la definición de la base de Lewis para comenzar e intente ver la disponibilidad del par solitario (más disponible = base más fuerte). Cada sistema en N está centrado, por lo que podemos ignorarlo como factor. El ion amida es la base más fuerte, ya que tiene dos pares de electrones no enlazantes (más repulsión electrón-electrón) en comparación con el amoníaco, que solo tiene uno. El amonio no es básico ya que no tiene un solo par para donar como base. (B) Las aminas son bases más fuertes que los alcoholes. De nuevo, podemos usar la disponibilidad de un par solitario ... N es menos electronegativo que O, por lo que es un mejor donante de electrones. ¿Qué pasa con el alcohol y el tiol? La acidez aumenta en un grupo, por lo que el tiol es una base peor que el alcohol ... los átomos más grandes tienden a formar enlaces más débiles con el protón pequeño. (C) Dado que todas estas son anilinas sustituidas, debemos analizar el papel del sustituyente (después de todo, es lo único que cambia a lo largo de la serie). Los sustituyentes que son donantes de electrones harán que el par único N esté más disponible (capacidad de donación de electrones -OCH 3 > -CH 3 ), mientras que los grupos de extracción de electrones harán que el par único N esté menos disponible (capacidad de extracción de electrones -NO 2 > Cl) (D) Todavía podemos utilizar la disponibilidad de par solitario. La piperidina es la más básica (ácido conjugado pK a = 11,2). El par solitario está en un orbital híbrido sp 3 y no hay resonancia (no hay sistema π). En piridina (ácido conjugado pK a = 5.2), el par solitario N está en un orbital híbrido sp 2 pero no es parte del sistema aromático de electrones 6π ni está involucrado en ninguna resonancia (perpendicular). El híbrido sp 2 es más pequeño que el híbrido sp 3 , por lo que hay una atracción más fuerte hacia el núcleo, por lo que es menos básico. En anilina (ácido conjugado pK a= 5,2), el par solitario N puede interactuar con el sistema π del anillo aromático, lo que los hace menos disponibles para la donación. En pirrol es una base muy débil (ácido conjugado pK a = -4). El par solitario N está involucrado en el sistema aromático de electrones 6π . La protonación destruirá la aromaticidad del sistema aromático de electrones 6π y esto lo convierte en un proceso desfavorable. Qu2: Los nitrilos, RC≡N , se reducen a 1 o aminas mediante la conversión del RC≡N en R-CH 2 -NH 2, por lo que el producto sería 1-aminopentano. El bromuro de bencilo es un haluro de alquilo y, por lo tanto, sufrirá una sustitución nucleófila por el N nucleófilo del amoníaco dando bencilamina. Tolueno sufre nitración para dar principalmente para- nitrotolueno. La reducción del grupo nitro da la amina, paraaminotolueno (o para- metilanilina si lo prefiere). La ciclohexanona, una cetona, reaccionará con una amina secundaria para dar una enamina (se prefiere un alqueno más estable) que por hidrogenación catalítica se reduce a la amina terciaria, N, N-dimetilaminociclohexano. Qu3: Primero, tenga en cuenta que tenemos una serie homóloga de aminas C2 a C4 que estamos tratando de producir. Aquí hay un esquema que recopila posibles síntesis juntas. Estos se basan en reacciones importantes y deben ser síntesis breves. (a) 1-amino etano : no podemos agregar N 3 directamente al alqueno, por lo que introducir un halógeno, el bromuro es una buena opción ya que es un buen grupo saliente y luego sustituirlo usando un exceso de amoníaco. (b) 1- amino propano : necesitamos agregar un átomo de C para pasar de C2 a C3. Para una amina, una buena forma de hacerlo es a través del nitrilo. Entonces, después de preparar bromuro de etilo, la sustitución nucleofílica con NaCN (en un solvente aprótico polar como DMSO) dará el nitrilo que se puede reducir a la amina. (c) 1- aminobutano : ahora necesitamos agregar 2C para llegar a C4 ... la adición del bromuro de etilmagnesio de Grignard al óxido de etileno da 1-butanol. El amoníaco no reaccionará con un alcohol para dar sustitución (grupo saliente pobre), nuestra mejor opción aquí es convertir el alcohol en bromuro o podríamos usar un tosilato (ambos mejores grupos salientes) y luego sustituirlo con amoníaco. Et3 N; TEA; N,N,N-trietilamina Qu4: En cada una de las reacciones, la amina primaria es la especie nucleofílica que reacciona con una variedad de electrófilos ..... Qu5: En cada una de las reacciones, la amina secundaria es la especie nucleofílica que reacciona con una variedad de electrófilos ..... Qu6: (a) Estos ejemplos revelan algunos de los aspectos interesantes que involucran aminas y compuestos aromáticos ...... Para conseguir que los dos halógenos orto- / paradirigidos se meta entre sí, necesitamos utilizar la química de las sales de diazonio introduciendo el primer halógeno en la etapa nitro. Esta ruta es especialmente útil para obtener el sustituto de yoduro. (B) Para preparar una amida, debemos planificar la obtención del ácido carboxílico y la amina. Podemos preparar el ácido mediante la reacción del dióxido de carbono con el Grignard de bromobenceno. Vías alternativas al ácido podrían ser la oxidación de un alquilbenceno preparado por alquilación (no mostrado). (C) Una buena ruta a los fenoles es mediante la hidrólisis de la sal de diazonio preparada mediante la conversión del grupo nitro en anilina. (D) Para limitar la reacción a la monobromación, primero preparamos la amida menos reactiva, luego bromamos y luego hidrolizamos la amida a la anilina requerida.