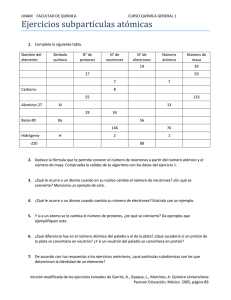
Actividad #1 Desarrolló de problemas de química Nombre: Anthony Aguilar grupo Farmacia A23 8-980-1594 Explique la estructura del átomo. Incluya imágenes explicativas. El átomo tiene una estructura interna formada por un núcleo y una corteza o nube de electrones orbitando en torno al núcleo. El diámetro del núcleo es unas 10.000 veces más pequeño que el del átomo completo, así que, fundamentalmente, el átomo está hecho de vacío. El átomo está formado principalmente por tres partículas subatómicas: electrones, protones y neutrones. Los protones y los neutrones se ubican en el núcleo del átomo, y los electrones giran en torno a este. Cada partícula subatómica presenta una particularidad sobre su carga: - Protón → Carga positiva (+) - Electrón → Carga negativa (-) - Neutrón → Carga neutra (0) Resuelva los siguientes problemas que se encuentran en el PDF de problemas: 2.21, 2.25, 2.35, 2.53, 2.55 Resuelva los siguientes problemas que se encuentran en el PDF de problemas: 2.21, 2.25, 2.35, 2.53, 2.55 Resuelva los siguientes problemas que se encuentran en el PDF de problemas: 2.21, 2.25, 2.35, 2.53, 2.55. 2.21 a) Defina los términos número atómico y número de masa. En física y química, el número atómico de un elemento químico es el número total de protones que tiene cada átomo de dicho elemento. El símbolo convencional y su representación "Z" proviene de la palabra alemana Atomzahl. la t Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente En química, el número másico o número de masa es la suma del número de protones y el número de neutrones del núcleo de un átomo. Se simboliza con la letra A. Suele ser mayor que el número atómico, dado que los neutrones del núcleo proporcionan a este la cohesión necesaria para superar la repulsión entre los protones b) ¿Cuál de estos puede variar sin modificar la identidad del elemento? Ambos pueden variar sin modificar la identidad del elemento. 2.25 Complete los espacios en la siguiente tabla, suponiendo que cada columna representa un átomo neutro: Símbolo Protones Neutrones Electrones Numero de masa 2.35. El magnesio tiene los siguientes isótopos que se presentan naturalmente, con las siguientes abundancias: Isotopo Abundancia Masa atómica ( uma ) a) ¿Cuál es la masa atómica promedio del Mg? b) Trace el espectro de masas del Mg. 2.53 Usando la tabla periódica como guía, prediga la fórmula química y el nombre del compuesto formado por los siguientes elementos: a) Ga y F. b) Li y H. c) Al e I. d) K y S. 2.55 Prediga la fórmula química del compuesto iónico formado por: a) b) c) d) e)