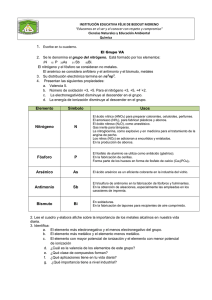
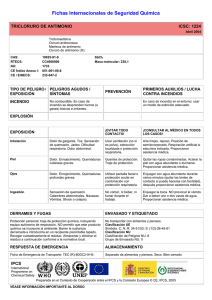
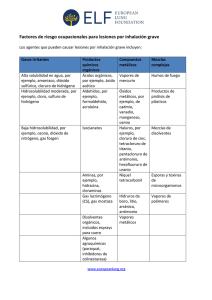
GRUPO D ANTIMONIO, GRUPO 2 INTEGRANTES García García María José Huamán Guevara Washington Emilio Iza Gualoto Lisbeth Jussara Llumiluiza Rodríguez María Mercedes Lozano García Milena Valentina Masache Paquín Betsabé Lianmoy ANTIMÓNIO El antimonio es un elemento químico que forma parte del grupo de los metaloides de número atómico 51 situado en el grupo 15 de la tabla periódica de los elementos. ANTIMÓNIO Estado natural El antimonio se encuentra nativo. Su principal origen es el mineral estibina , Sb2O3, el cual se encuentra en forma de cristales grandes negros brillantes. Se encuentra también en la valentinita, Sb2O3, y como un componente de otros minerales , tal como la pirargirita, Ag3SbS3. Propiedades El antimonio es un metal blanco cristalino, con una densidad de 6,7 y un punto d funsion de 680°. Se parece al bismuto en que es quebradizo y se pulveriza facilmente. A la temperatura ordinaria no se oxida apreciablemente en el aire seco, pero calentando fuertementemenete arde, y forma un vapor blanco de Sb2O3 Las propiedades antóferas del Sb2O2 y del Sb2O3 dan lugar a dos clases de sales: Las formadas por la acción de los acidos sobre estos oxidos. Las que resultan de la reaccion de los oxidos y los alcalis causticos. El tricloruro de antimonio SbCl3, es la sal de antimonio mejor conocida . Es una subsustancia cristalina, incolora, muy delicuescente, que funde a 73°. La reacción es reversible , asi que , para disolver el SbCl3 , se ha de emplear HCl medianamente concentrado. Tratados con agua, el nitrato produce (SbO)NO3 y el sulfato (SbO)2SO4. ACIDOS ANTIMONIOSOS Y ANTIMONITOS A partir de la solucion de Sb2O3 en sosa caustica, se puede obtener una sal cristalina , de formula NaSbO2(H20)3. Esta es la sal sodica del acido hipotetico mentantimoso HSbO2. El precipitado obtenido obtenido al añadir NaOH a una solucion SbCl3 , se supone fercuentemente que es el acido ortoantimonioso fr Sb(OH)3 o H3SbO3, y a partir de este compuesto, por deshidratciones sucesivas , se supone que se forman los acidos piro (H2 SB2 05) y meta (HSbO2). En realidad, mimguno de estos acidos ha sido aislado . A excepcion del NaSbO2 mencionado antes, y de un numero de derivados de metales pesados de composición dudosa, muy poco se conoce en definitiva de los antimoniots. ACIDOS ANTIMONICOS Y ANTIMONIATOS En tanto que el Sb(OH)3 no existe, se han preparado problablemente varias formas hidratadas del Sb2O5 correspondientes a los ácidos antimónicos orto (H3SbO4) y piro (H1Sb2O7). De especial interés es el antimoniato de potasio, sal algo soluble, cuya solución acuosa se empleaba antes como reactivo de los iones sodio, puesto que la correspondiente sal de sodio es mucho menos soluble en agua que el compuesto de potasio. La sal potásica fue llamada al principio piroantimoniato potásico y se le asignó la fórmua K2H2Sb2O7 (H2O) REACCIONES DE LOS COMPUESTOS ANTIMONIOSOS 1. Agua.- Si a una solución clorhídrica de SbCl3, que no contenga demasiado ácido libre, se añade una cantidad de agua relativamente grande, se forma un precipitado blanco de oxicloruro. Puesto que la acción hidrolítica del agua aumenta con la temperatura, la precipitación se puede acelerar con ayuda del calor. Se distingue fácilmente el precipitado del correspondiente compuesto de bismuto por su solubilidad en ácido tartárico. 2. Sulfuro de Hidrógeno.- Pasado a través de una solución no demasiado fuertemente ácida precipita Sb2S3, rojo anaranjado 3. Álcalis cáusticos, el amoníaco y el carbonato sódico.- Producen un precipitado blanco de óxido antimonioso hidratado de fórmula Sb203 (H2O).. Este precipitado es anfótero y se disuelve fácilmente en HCL fumante, así como un exceso de álcali cáustico, Es insoluble en Nh3, pero se disuelve lentamente en un exceso de solución concentrada y caliente de carbonato sódico. 4. Estaño metálico.- Añadido a una solución de antimonio en cualquier estado de oxidación , precipita antimonio en forma de polvo negro. La acción se puede acelerar si se introduce en la solución un pedazo de lámina de platino, sobre la cual se coloca un trozo de estaño que forma un par Sn-Pt. 5. Hierro.- Si se calienta una solución de antimonio, acidulada con HCL, con un clavo de hierro brillante, todo el antimonio se precipitará en forma de copos negros (diferencia del Sn). Si la solución de antimonio contiene mucho estaño de SnC6, éste se reducirá primero, de modo que no se precipitará antimonio o se precipitará poco.. REACCIONES DE LOS COMPUESTOS ANTIMÓNICOS 1. AGUA Los compuestos antimonios pueden reaccionar con agua para formar ácidos o hidróxidos, dependiendo de la naturaleza del compuesto. Ejemplo: El trióxido de antimonio (Sb2O3) reacciona con agua para formar ácido antimonioso (Sb(OH)3): Explicación: En esta reacción, el trióxido de antimonio reacciona con el agua para producir ácido antimonioso y protones La formación de ácido antimonioso indica la naturaleza ácida de la reacción. 2. SULFURO DE HIDRÓGENO Los compuestos antimonios pueden reaccionar con sulfuro de hidrógeno para formar sulfuros de antimonio. Ejemplo: El pentasulfuro de antimonio (Sb2S5) reacciona con sulfuro de hidrógeno para formar antimonio trisulfuro (Sb2S3): Explicación: En esta reacción, el pentasulfuro de antimonio reacciona con el sulfuro de hidrógeno para formar antimonio trisulfuro y agua. 3. EL YODURO POTÁSICO Los compuestos antimonios pueden formar yoduros de antimonio en presencia de yoduro potásico. Ejemplo: El cloruro de antimonio (SbCl3) reacciona con yoduro potásico para formar yoduro de antimonio (SbI3) y cloruro de potasio (KCl): Explicación: En esta reacción, el cloruro de antimonio reacciona con el yoduro potásico para formar yoduro de antimonio y cloruro de potasio. ENSAYOS ESPECIALES PARA RECONOCER CANTIDADES PEQUEÑAS DE ANTIMONIO 1. Ensayo de Marsh: Es un método que implica la generación de gas arsina (AsH3) al reaccionar antimonio con ácido clorhídrico y zinc. El gas arsina se forma cuando hay presencia de antimonio, y luego se lleva a través de una serie de tubos para su detección. 2. Ensayo de Gutzeit: Similar al ensayo de Marsh, se basa en la formación de arsina (AsH3), pero utiliza una solución de hidruro de sodio en presencia de ácido tartárico. La arsina producida se arrastra hacia un papel de filtro impregnado con acetato de plomo, formando manchas amarillas o marrones si hay presencia de antimonio. 3. Ensayo de Reinsch: Este método implica la deposición de antimonio sobre una lámina de cobre cuando la muestra se calienta en presencia de ácido clorhídrico y una lámina de cobre. Se observa la formación de un depósito gris o negro de antimonio en la lámina de cobre. Los compuestos de antimonio no dan la reacción de Fleitmann, ni la de Bettendorff ESTAÑO Estado natural: El estaño se encuentra en estado libre en la naturaleza. Su mineral principal es la casiterita, SnO2. Propiedades: El estaño es un metal blanco argentino, blando, con densidad de 7,3 y punto de fusión de 282°. Es maleable y dúctil. A la temperatura ordinaria no se oxida al aire, tanto si está húmedo como seco. El estaño se disuelve en HCl, con formación de Sn++ y desprendimiento de hidrógeno. Con HCl diluído, en frío, la acción es muy lenta, en cambio se disuelve con rapidez ácido concentrado caliente. COMPUESTOS ESTANNOSOS Los compuestos estannosos se refieren a aquellos que contienen estaño en un estado de oxidación +2. El estaño puede formar compuestos con varios elementos y grupos químicos. La sal estannosa más importante es SnCI2 (H2O)2. Cuando es pura, se presenta en cristales incoloros. La solución acuosa de la sal se vuelve turbia, por hidrólisis, a no ser que contenga algo de HCI. Expuesta al aire, una solución clara de SnCl2 se oxida rápidamente a SnCl = Por esta razón, para evitar la oxidación del reactivo SnCl2, se acostumbra a añadir un poco de papel de estaño puro a la solución ácida de la sal. El estaño añadido reduce algo de (SnC16) que haya podido formarse. Debido a su fácil oxidación se emplean las sales estannosas como poderosos reductores. = Reacciones de los compuestos estannosos El hidróxido estannoso es anfótero, puesto que se disuelve lo mismo en exceso de NaOHque en HCl. Como el ion estannoso tiene por número máximo de coordinación 4, problamente su ion hidratado tiene por fórmula Sn(H2O)4. Los hidróxidos inorgánicos solubles pueden considerarse como sales, es decir, compuestos electrovalentes constituidos por un catión metal y un anión hidroxilo. Los hidróxidos insolubles son compuestos moleculares formados por complejos de coordinación que contienen radicales hidroxilos y moléculas de agua. Compuestos estánnicos El estaño tetravalente forma varios óxidos hidratados, siendo lo más importante: Ácido α-estánnico (hidróxido estánnico), H2SnO8 (formado por la acción del NaOH sobre la solución de SnCl4. Ácido β-estánnico (metaestánnico), substancia blanca que resulta de la acción del ácido nítrico concentrado sobre estaño metálico. Se disuelve con facilidad en los ácidos y bases, y da una serie de sales, conocidas como sales estánnicas normales o αestánnicas. No se disuelve en ácidos, pero hervido corto tiempo con HCl concentrado da un compuesto de fórmula Sn5O5Cl2(oh)8, el cual, aunque prácticamente insoluble en HCl, se disuelve fácilmente en agua. Reacciones de los compuestos estánnicos 1. Los álcalis cáusticos, amoniaco y carbonato sódico: Se producen un precipitado blanco gelatinoso de hidróxido estánnicos Sn(OH)4, el cual desecado sobre H2SO4 concentrado, se transformar en H2SnO4 (ácido estánnico). El precipitado se disuelve en excesos de hidróxidos de alcalinos, así como en soluciones de Na2CO3. Es también soluble en ácido con tal que estos contengan un anión capaz de formar de ion complejo con el Sn, por ejemplo el Cl: 2. Sulfuro de hidrógeno: Con soluciones ácidas (que no excedan de HCl 0,8 M), el H2S produce un precipitado amarillo claro de sulfuro estánnico SnS2, con algo de Sn(OH)4. Con soluciones diluídas la precipitación tiene lugar lentamente, debido a la tendencia del SnS2 al formar un sol. Por el calor o adición de una sal de solución, se acelera la precipitación. El sulfuro estánnico se disuelve fácilmente en HCl 6M (diferencia de As2S2 yHgS y método de separación de los mismos. También se disuelve en solución de KOH, y forma una mezcla en equilibrio de iones estannato Sn(OH)6 y tioestannato SnS3. La igualdad es análoga a la de la solución del As2S3 en KOH. Incompleta Tenemos 8 S a la derecha y 2 S a la izquierda, por lo que necesitamos 3 moles de SnS2 para que den 2 moles de SnS3 a la derecha. La igualdad es la siguiente: Es evidente que para formar Sn(OH)6 necesitamos 6 OH, por lo que la igualdad completa será: Acidulada esta solución, la reacción se verifica en sentido contrario, y vuelve a precipitarse SnS2.. El sulfuro estánnico no es precipitado por el H2S en presencia de mucho ion oxalato, por formarse un ion complejo estable (diferencia del antimonio y método de separación del mismo). Cuano se calienta fuertemente en contacto del aire, el SnS2 se transforma cuantitativamente en SnO2. 3. El hierro metálico Añadido a una solución clorhídrica de SnCl6 reduce éste a ion estannoso. Se verifica una reducción semejante si se añade Cu o Sb a la solución caliente. En la solución, después de verificada la reducción, se puede ensayar el Sn si se filtra y añade al líquido filtrado un poco de HgCl3, ya que el Fe no reduce el HgCl2. 4.Coloración de la llama Si la parte inferior de un tubo de ensayo, que contenga 10 c.c. de agua, se sumerge en una solución de cloruro estánnico con exceso de HCl, y luego la parteque se ha sumergido se calienta en la llama de Bunsen, la zona de la llama que está en contacto con el tubo toma una coloracion azul pálido. Si no se colorea la primera vez, hay que sumergir el tubo en HCl concentrado y volver a calentarlo. Los elementos que comunican coloración a la llama, como el Cu. Los metales alcalinotérreos y alcalinos, perjudican este ensayo. La experiencia de muestra que en presencia de 250 mg. de arsénico o antimonio no puede investigarse 1 mg. de Sn en forma de SnCl6. Al igual que todas las reacciones a la llama, este ensayo no proporciona indicaciones cuantitativas. Sólo cuando se obtiene resultado positivo la prueba es concluyente. 5. Sulfato sódico o nitrato amónico (o cualquier sal alcalina neutra. De las soluciones, en frío, no se obtiene precipitado con estos reactivos (diferencia de los compuestos B-estánnicos); pero al hervir la solución se forma un precipitado de Sn(OH)4. Reacciones del grupo metaestánnico, Sn5O5Cl2(OH)8 1.El NH3, KOH, H2SO4, Na2SO4 dan un precipitado de ácido B-estánnico. 2. El HCl precipita Sn5O5Cl4(OH)6( H2O), (diferencia del cloruro aestánnico). 3. El H2S produce un precipitado que se forma lentamente, debido a la tendencia del sulfuro a permanecer, en estas condiciones, en estado coloidal. La adición de sales neutras da lugar a la formación de un precipitado amarillo claro, formado de una mezcla de SnS2 y ácido Bestánnico. REFERENCIA Curtman, Luis J. ANÁLISIS QUÍMICO CUALITATIVO (1959). Barcelona, Editorial:Manuel Marín & Cia. ¡Gracias por su atención!