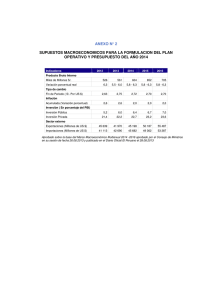
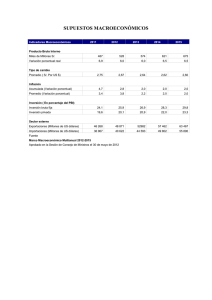
INSTITUCIÓN EDUCATIVA SAN LUIS BELTAN DE MANATI APROBADOPOR RESOLUCIÓN N° 0665 DE 2018 DE LA SED NIT: 103145-0 DANE: 108456000079 GUIAS DE CLASE, TALLERES,EVALUACIONES ÁREA: Ciencias Naturales PERÍODO: PRIMERO ASIGNATURA: QUÍMICA I.H HORARIA: 4 DOCENTE: JOAN JAVIER ASSIA LUQUE GRADO:11 FECHA: 04 de Abril de 2024 APRENDIZAJE : Composición porcentual LOGRO: Calcula la composición porcentual de un compuesto mediante ejercicios planteados. COMPETENCIAS: Utiliza las matemáticas como herramienta para modelar, analizar y presentar datos. GUIA 2 : COMPOSICIÓN PORCENTUAL DE LOS ELEMENTOS DE UN COMPUESTO Hola Amigos del grado 11 ¡Recuerden! El reconocimiento de emociones, el diálogo y el establecimiento de rutinas como familia, (organizando tiempos para las diferentes actividades individuales y colectivas) son claves para la puesta en marcha del Plan de Trabajo Académico en Casa así que sigamos adelante............ ORIENTACIONES: Lea con interés, los conceptos plasmados en la guía, Tenga en cuenta los ejercicios modelos planteados en cada tema. Utilizar el cuaderno para realizar las actividades NO se deben realizar directamente en la guía FECHA DE ENTREGA EL 10 de Abril de 2024 CONTEXTUALIZACIÓN TEÓRICA CONCEPTO DE PESO MOLECULAR La Masa Molecular (m.m) o Peso Molecular es la masa de una molécula. Se calcula igual que la masa atómica pero aplicándola a todos los átomos de una molécula. La Composición Porcentual: La Composición Porcentual es una medida de la cantidad de masa que ocupa un elemento en un compuesto. Se mide en porcentaje de masa. La Composición Porcentual de un elemento en una molécula se calcula a partir del peso molecular y viene determinada por la siguiente fórmula: ACTIVIDAD 2: ACTIVIDAD 1: Teniendo en cuenta los ejemplos presentados en la gráfica realice los siguientes ejercicios. 1. 2. 3. 4. 5. 6. 7. 8. Peso Molecular del Agua (H2O) Peso Molecular del Ácido Clorhídrico (HCl) Peso Molecular del Cloruro de Sodio (NaCl) Peso Molecular del Nitrato de Plata (AgNO3) Peso Molecular del Permanganato de Potasio (KMnO4) Peso Molecular del Hidróxido de Potasio (KOH) Peso Molecular del Metano (CH4) Peso Molecular del Etano (C2H6) Realiza los ejercicios teniendo en cuenta los siguientes aspectos: Lee con atención cada enunciado. Realizar el proceso matemático siguiente el ejemplo de la guía. Utiliza hojas cuadriculadas 2.1 La progesterona es un componente común de la píldora anticonceptiva. Si su fórmula empírica es C21H30O2, ¿cuál es su composición porcentual de cada elemento que la conforma? 2.2 Calcular la composición porcentual de cada elemento en la molécula FeSO4. 2.3 Calcular la composición porcentual del hidrógeno y ACTIVIDAD 4: Lee con atención el siguiente texto y responde las preguntas de comprensión. del oxígeno en el la siguiente molécula (C6H6) si los pesos atómicos del C y H son 12 y 1 respectivamente. 2.4 Calcular la composición porcentual del hidrógeno y del oxígeno en el agua oxigenada (H2O2) si los pesos atómicos del H y O son 1 y 16 respectivamente. CELEBREMOS EL DÍA DEL NÚMERO DE AVOGADRO Los químicos americanos celebran cada 23 de octubre la fiesta no oficial del “Mole Day”. Como dato curioso, según el sistema americano, para expresar fechas y horas, lo hacen a las 6.02 Am/Pm, del 10.23.2019 “es decir “6.02.10^23”. Interesante ¿cierto? 2.5 Calcular la composición porcentual del K, N y O en el nitrato potásico (KNO3). 2.6 Hallar la composición porcentual de cada uno de los elementos que forman los siguientes compuestos: Cl2O7 H3PO3 HCl Ca3P Bien, ¿pero por qué es “Mole Day” y no “Avogadro Day”’? esto se debe a que la definición del “mol” es más popular y sencilla. Por si no sabes que es un mol en química, te cuento que es “el número de partículas individuales que hay en un mol de cualquier sustancia o especie química”. LECTURA COMPLEMENTARIA La fórmula de un compuesto indica la relación entre el número de átomos de cada elemento presente en el compuesto. A partir de la fórmula, podemos calcular el porcentaje con que contribuye cada elemento a la masa total del compuesto. Fue el físico italiano Amadeo Avogadro, quien asentó algunos de los pilares fundamentales de muchas leyes científicas que conocemos hoy. Sus aportes en la química y la física han sido fundamentales. Es así, como se propuso una de las leyes por la que ahora es mundialmente conocido. El número de Avogadro, establece que dos volúmenes iguales de dos gases distintos a la misma temperatura y la misma presión debían tener el mismo número de partículas. Para determinar, mediante cálculos, el porcentaje de un elemento en un compuesto, debemos conocer varios Es decir, el número de Avogadro es usado para medir cuánta sustancia tiene un mol y equivale a 6,022×1023. Ahora si entendiste ¿verdad? El uso más habitual del número de Avogadro es para hablar de moléculas, pero un mol puede ser de otras cosas, por ejemplo: conceptos. La composición porcentual es el porcentaje en masa de cada elemento presente en un compuesto. La obtenemos dividiendo la masa de cada elemento para la masa del compuesto. Y TAMBIEN ¿? COMPOSICIÓN PORCENTUAL La ley fundamental de la química establece que todo compuesto químico formado por dos o más elementos distintos están presentes en dicho compuesto en una cantidad o composición porcentual determinada ACTIVIDAD 3 Teniendo en cuenta el texto anterior responda: 3.1 ¿Que indica la fórmula química de un compuesto? 3.2 Que átomos y cuantos están presentes en los siguientes compuestos indica la cantidad de cada uno Al(OH)3 H3PO4 K2Cr2O7 C3H8O3 C6H12O6 3.3. ¿A qué se le da el nombre de composición porcentual? Un mol de átomos tendrá 6,022×1023átomos, Un mol de manzanas tendrá 6,022x1023manzanas, Un mol de camiones tendrá 6,022×1023 El número de Avogadro es un número gigantesco, tanto que resulta difícil de comprender a simple vista su magnitud. Algunos matemáticos han jugado con este número y han creado varios ejemplos para que se pueda entender la magnitud del mismo. Si llenásemos un número de Avogadro de tazas con agua del océano Pacífico, lo dejaríamos totalmente seco. Cien (100) folios de papel apilados miden aproximadamente 1 centímetro de alto; si apilásemos un mol (un número de Avogadro) de folios, la torre resultante mediría 60 billones de kilómetros de alto. ¡Feliz día del mol para todos! PREGUNTAS DE COMPRENSIÓN 4.1 ¿A qué se le da el nombre de mol? 4.2 ¿Qué representa el número de Avogadro? 4.3 ¿A que equivale el número de Avogadro? 4.4 Cuéntame ¿Cómo te ha parecido el artículo?