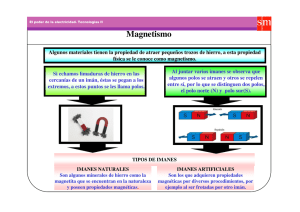
2do parcial de naturales. 1. El estudio de los materiales Conductividad térmica: Capacidad para transmitir calor. o Conductores: Ejemplos: cobre, aluminio. o Aislantes: Ejemplos: madera, amianto. La enorme variedad de objetos y seres que nos rodean está constituido por materia en sus tres estados 2. Dilatación: Aumento de tamaño con la temperatura. agregación sólido como las rocas de la corteza terrestre líquido como el agua de los mares y ríos y 3. Fusibilidad: Facilidad para fundirse. Ejemplos: mercurio, aluminio. gaseoso como el aire hay muchas clases de materia que se diferencian entre sí por sus propiedades. Todos los objetos que nos rodean están compuestos por una gran variedad de materiales. El conjunto de características que permiten diferenciar los materiales recibe el nombre de propiedades. Propiedades Mecánicas 1. Dureza: Resistencia al rayado y abrasión. Ejemplos: diamante, cuarzo. 2. Fragilidad: Facilidad para quebrarse. Ejemplos: vidrio, cerámica. 3. Tenacidad: Resistencia a la rotura. Ejemplos: acero, plomo. 4. Elasticidad: Capacidad de volver a la forma original tras deformarse. Ejemplos: silicona, Propiedades Ópticas 1. Transparencia: Dejar pasar la luz claramente. Ejemplos: vidrio. 2. Translucidez: Dejar pasar la luz sin claridad. Ejemplos: cuarzo. 3. Opacidad: Impedir el paso de la luz. Ejemplos: plomo. 4. Reflexión: Reflejar la luz. Ejemplos: metales pulidos. 5. Refracción: Cambiar la dirección de la luz. Ejemplos: agua. Propiedades Químicas 1. neopreno. Oxidación: Facilidad para oxidarse. o Oxidable: Ejemplos: hierro. o Inoxidable: Ejemplos: acero inoxidable. 5. Plasticidad: Capacidad de adquirir deformaciones permanentes. Ejemplos: plomo, estaño. 6. Rigidez: Resistencia a deformaciones. Ejemplos: cerámica, vidrio. 7. Maleabilidad: Facilidad para extenderse en láminas. Ejemplos: aluminio, hierro. 1. Reciclabilidad: Capacidad para ser reciclado. Ejemplos: cartón. 8. Ductilidad: Facilidad para extenderse en hilos. Ejemplos: cobre, estaño. 2. Toxicidad: Nocividad para el medio ambiente. Ejemplos: plaguicidas. 3. Biodegradabilidad: Capacidad para descomponerse naturalmente. Ejemplos: materiales Propiedades Eléctricas 1. Conductividad eléctrica: Capacidad para transmitir electricidad. o Conductores: Ejemplos: cobre, aluminio. o Semiconductores: Ejemplos: silicio, germanio. o Aislantes: Ejemplos: vidrio, teflón. Propiedades Térmicas Propiedades Ecológicas orgánicos. 4. Reutilizabilidad: Capacidad para ser reutilizado. Ejemplos: botellas de vidrio ¿Cómo es la materia en su interior? determinada, se encuentran unidad entre si y tienen fuerza de cohesión, por lo cual tienen un La materia está formada por partículas pequeñísimas llamadas átomos, que se orden, forma y volumen constante. unen entre si mediante procesos químicos. Neutrón: carga neutra Electrón: carga negativa Protón: carga positiva ¿Cómo se puede medir la cantidad de materia? donde se mida. En la luna pesarías sólo un sexto de lo que pesas en la tierra, aproximadamente, heterogéneos se ven de que están compuestos y los homogéneos no, aunque algunos materiales mientras que un Júpiter pesarías más del doble de que pesas en la tierra. heterogéneos sí, pero con lupa. Masa: Es la medida de cuanta materia hay en un cuerpo, y no cambia con la ubicación, aunque Métodos de separación: Heterogéneos: Volumen: Toda la materia tiene masa y ocupa espacio. La cantidad de espacio que ocupa la Liquido-solido: sudimentación y filtración materia se denomina volumen, por lo tanto, todos los estados de la materia presentan volumen. Liquido-liquido: decantación Solido-solido: tria, imantación y tamizado ¿Cuáles son los estados de la materia? Los estados de la materia son cuatro: solido, liquido, gaseoso y plasmático. Es una porción de materia y/o energías que se aísla del resto del universo, de forma real o imaginaria para su estudio experimental. Se clasifican en homogénea y heterogénea, generalmente los materiales de medida. La masa corresponde a una propiedad física de la materia. Sistemas materiales Peso: Es la medida de fuerza que ejerce la gravedad sobre la materia y difiere según el planeta cambie la fuerza de gravedad, es por ello que generalmente los científicos utilizan esta unidad Solido: las partículas se encuentran compactas, es decir que están fijas en una posición Homogéneos: Gaseoso: las partículas se encuentra n libres, con una libertad de movimiento, provocando un Liquido-solido: evaporación desorden total, tienden a estar alejadas ente si, su forma y volumen es variable. Liquido-liquido: destilación y cromatografía (técnica de separación de una solución que se basa Liquido: las partículas no se encuentran tan compactas, es decir que tienen un movimiento en las diferentes velocidades con que se mueve cada sustancia que la conforma a través de relativo entre sí, no se encuentran unidas, pero mantienen un contacto, adopta la forma del un medio poroso, al ser arrastradas por un solvente cuando este se desplaza: los componentes recipiente por lo cual solo tiene un volumen determinado, ya que tienen poco orden. se separan en dos fases; una es estacional y la otra móvil) Pigmentos Es la sustancia que se emplea para colorear una pintura, un barniz, un esmalte. Gracias a los pigmentos Materia inorgánica. Pueden hallarse en el mundo inanimado como los seres vivos (agua, sales es posible conferir un determinado color a las comidas, las ropas y otros productos. minerales, gases). Sus moléculas son de menor tamaño, debido a que están formadas por menor cantidad de átomos, además contienen menor cantidad de energía que las forman la Los colores no son una propiedad de los objetos, sino de la luz, la cual consta de 7 colores: materia orgánica específicamente el del arcoíris. Si n ojo ve algo de un color es porque refleja la longitud de onda correspondiente a dicho color. El agua: Pigmentos vegetales: En el jardín de infantes solo utilizamos u observamos el cambio de la materia cuando es de Sólido a líquido Las plantas contienen una gran variedad de pigmentos, que dan lugares a los colores que en ellas observamos. Los pigmentos fotosintéticos son los únicos que tienen la capacidad de absorber la energía de la luz solar y hacerla disponible para producir su propio alimento. Los pigmentos que encontramos en las plantas y que podemos identificar son: Clorofila a : color verde. Clorofila b : color de verde a verde limón Carotenos: coloración naranja. Xantofilas: color amarillo claro Antocianas: color violeta Clasificación de la materia: Se clasifican según sus relaciones con el mundo biótico: Materia orgánica: presente exclusivamente en los seres vivos y sus derivados (como son las proteínas, azucares, grasas, etc.) en la composición de sus moléculas siempre participan átomos de carbono, hidrogeno, oxigeno combinados entre si en distintas proporciones y habitualmente pueden estar acompañados por átomos de nitrógeno. Estas moléculas de gran número de átomos, contienen abundante energía química en estado potencial. y viceversa. Para saber más sobre ello debemos tener en cuenta el único líquido incoloro, insípido e inodoro, que es el AGUA. Esta, además, se congela a 0°C. Pasa al estado de vapor a los 100°C cuando la presión atmosférica es normal. Todo es agua, la vida comienza en el agua. Es tan importante que el hombre puede llegar a manipular el agua a través del control y puede llegar a contaminarla o potabilizarla. El agua se contamina a través de desechos tóxicos. Por ejemplo si el aire se contamina, al estar formada por agua, el aire forma ácido sulfúrico. En el suelo el agua se contamina debido a residuos no degradables. Por ejemplo las pilas. ¿Por qué algunos elementos se hunden y otros flotan en el agua? Unas de las características del agua es su TENSIÓN SUPERFICIAL. Esta es la interacción de las partículas en la superficie del agua, la cual hace que este se presente como una verdadera cama elástica “soporta un mosquito” Entonces, en el agua hay una cierta fuerza de atracción de las moléculas, las cuales hacen que se produzca esa cama elástica pero entonces ¿por qué otros elementos como el hierro se hunden? Sencillo, porque su peso específico es mayor que el del agua. ¿Cómo sube el agua en las plantas? El imán de la tierra atrae naturalmente al agua pero ¿cómo sube? Sube por un mecanismo físico llamado capilaridad. Los vegetales tienen capilares dentro de sus troncos llamadas floemas y xilemas Capilaridad: Tendencia del agua a ascender por un tubo estrecho en contra de la fuerza de gravedad. Es el resultado de dos tipos de fuerzas: La elevada fuerza de cohesión hace que las moléculas cumplan una fuerza de atracción. Estas formas la llamada tensión superficial que hace que las moléculas se eleven a través del tubo o el capilar. ¿Y la densidad? ¿Qué tiene que ver? Es la cantidad de masa que tiene un objeto en un determinado volumen. En decir que indica cuánta materia hay en un espacio. El peso relaciona la masa (la cantidad de materia) con el volumen. Cambios físicos y químicos Las sustancias experimentan dos tipos de cambios físicos y químicos. Un cambio físico modifica algunas propiedades de la sustancia sin formar una nueva, por ejemplo, al romper un papel los pedazos mantienen La Elevada fuerza de adhesión hace referencia a la capacidad del agua de adherirse a las paredes de los las propiedades originales. Los cambios químicos o reacciones modifican profundamente todas tubos capilares. Siendo esta fuerza mayor que a la de cohesión. propiedades formando una nueva sustancia son irreversibles al quemar un papel se generan sustancias ¿Qué es el principio de Arquímedes? El principio de Arquímedes dice que: «Un cuerpo total o parcialmente sumergido en un fluido en reposo experimenta un empuje vertical hacia arriba igual al peso del fluido desalojado». Es decir que todo objeto sumergido en el agua o en algún líquido desborda su propio volumen. Esta teoría permite calcular el volumen del líquido. Si el peso específico del objeto es MAYOR que el del líquido (agua en este caso), el objeto se hunde y el empuje de este objeto hará que el agua se desborde. Ese desborde es el volumen del cuerpo. Si el objeto tiene un peso específico MENOR que el del agua, este objeto flota. Si el objeto tiene el MISMO peso específico que el agua este queda en el medio. ¿Y qué tiene que ver la presión hidrostática en esto? diferentes a las iniciales cenizas y dióxido de carbono. Los procesos físicos y químicos se diferencian, porque en las transformaciones físicas prácticamente no se alteran las propiedades de la materia, mientras que las transformaciones químicas pueden ser permanentes, entonces se la llama irreversibles los cambios físicos que se mantienen mientras actúen las causas que los originan o pueden volver atrás con otra reacción química en este caso se las llama reversibles las transformaciones físicas producen una muy pequeña variación de energía los cambios químicos generan una importante variación de energía. . Laboratorio escolar Estructura para plantear las actividades experimentales Idea fuerza: es la idea inicial de la que se puede partir el experimento. (hipótesis) Es la presión que el agua ejerce sobre los objetos que están sumergidos. Esta presión actúa en todas las Tema generador: es el tema global de cual se trata el experimento direcciones. Si un objeto pesa menos que el agua, la presión puede empujarlo hacia arriba, haciéndolo Objetivo del experimento: describe la intencionalidad que se quiere lograr luego de realizar el flotar. Sin embargo, a mayores profundidades, esta presión también puede comprimir algunos objetos. experimento. Materiales: es el conjunto de instrumentos y objetos que se necesitan para desarrollar las actividades propuestas en el experimento. Procesos: es la descripción detallada de las actividades a desarrollar, de tal manera que se llegue a verificar o rechazar la idea fuerza. Vocabulario nuevo: conjunto de palabras que se emplearán durante el experimento y permiten a los alumnos relacionarse con terminología apropiada para nominar los fenómenos que los rodean y que más adelante facilitará el desarrollo de destrezas y su crecimiento cultural y científico. Fijarse en los signos de peligrosidad que aparecen en los f rascos de los productos químicos. Lavarse las manos con jabón después de tocar cualquier producto químico. Al acabar la práctica, limpiar y ordenar el material utilizado. Si se salpican accidentalmente, lavar la zona af ectada con agua abundante. Si se salpica la mesa, limpiarla con agua y secarla después con un paño. Evitar el contacto con f uentes de calor. No manipular cerca de ellas sustancias inf lamables. Para sujetar el instrumental de vidrio y retirarlo del f uego, utilizar pinzas de madera. Cuando se calientan los tubos de ensayo con la ayuda de dichas pinzas, procurar darles cierta inclinación. Nunca mirar directamente al interior del tubo por su abertura ni dirijas esta hacia algún compañero. Todos los productos inf lamables deben almacenarse en un lugar adecuado y separados de los ácidos, las bases y los reactivos oxidantes. Los ácidos y las bases f uertes han de manejarse con mucha precaución, debido a que la mayoría son corrosivos y, si caen sobre la piel o la ropa, pueden producir heridas y quemaduras importantes. Si tienen que mezclar algún ácido (por ejemplo, ácido sulfúrico) con agua, añade el ácido sobre el agua, nunca al contrario, porque el ácido «saltaría» y podría provocarte quemaduras en la cara y los ojos. No dejar destapados los f rascos ni aspirar su contenido. Muchas sustancias líquidas (alcohol, éter, clorof ormo, amoníaco...) emiten vapores tóxicos. Conclusiones: se puntualiza actividades para lograr el desenlace del experimento, relacionado La energía a la comprobación o rechazo de la idea fuerza. Se tomará en cuenta las impresiones que han Es la capacidad para realizar un trabajo o transmitir calor la cual puede ser: tenido los niños a lo largo de todo el proceso Energía potencial: es la que permanece almacenada e intacta hasta ser utilizada, por ejemplo, mientras la leña no se quemó, era rica en energía química en estado potencial. Energía cinética: es la que permite el desplazamiento, por ejemplo: nadar, volar, trotar. Energía mecánica: es la que produce el movimiento de partes de un ser o de una máquina, por ejemplo, martillar, masticar. Energía lumínica: es la que se percibe en forma de luz, por ejemplo: llama, luz solar, luz eléctrica, Energía eléctrica: es la que permite la conducción de impulsos, por ejemplo, ondas eléctricas cerebrales y actividad cardiaca. Energía química: es la que está contenida en otra los compuestos químicos, por ejemplo, alimentos, la nafta, la madera. Energía calórica: se manifiesta en forma de calor y forma más degradada de la energía, ya que se disipa en el ambiente sin poder ser reutilizada. Pirámides ecológicas: La pirámide de energía Las pirámides ecológicas son otras formas de representar las cadenas tróficas, en este cada escalón se destina a un nivel trófico, el primero de los cuales, ubicado en la base, se destina al productor. Ejemplo de cadena trófica: Los hongos y bacterias son los encargados de descomponer la materia orgánica transformándolas en inorgánica como los- minerales- productores- consumidores (nosotros)descomponedores- hongos y bacterias- Imantación Se llama magnetismo a un conjunto de propiedades que son características de los imanes. Los imanes son materiales especiales que atraen a los objetos fabricados con hierro, pueden ser tanto naturales (como la magnetita) como artificiales (se la construye a través de diferentes metales como el hierro o el acero). Los imanes poseen dos polos en sus extremos (llamados polos norte y polo sur) y estos generan un campo magnético. Si acercamos dos imanes por sus polos opuestos estos se atraen, en cambio sí juntamos dos polos iguales se rechazan. Los imanes lo podemos ver en las heladeras, o en los discos duros o en la tarjeta de memoria para almacenar datos. Así como también en las pantallas, altavoces y otros objetos electrónicos. También, las brújulas contienen imanes las cuales permiten la orientación y la ubicación ya que nuestro planeta cuenta con un campo magnético, que contiene también un polo norte y sur. Por eso que decimos que la tierra actúa como un imán gigante ya que atrae las hojas de las brújulas hacia el norte. Este campo magnético nos protege de los rayos solares, si no lo tuviéramos la corriente electromagnética nos causaría mucho daño. Este campo desvía estos rayos a los polos los cuales se transforman en gases que luego se transforman en luz (auroras boreales).