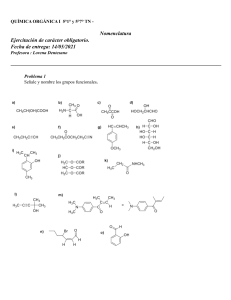
ACIDOS CARBOXILICOS 1.- Introducción. 2.- Propiedades físicas. Importancia. 3.- Acidez de los ácidos carboxílicos. 4.- Preparación de ácidos carboxílicos. 5.- Sustituciones nucleofílicas en el carbono acílico. 6.- Ácidos dicarbonílicos. 7.- Principales aplicaciones industriales. Cuando se une un grupo hidroxilo a una función carbonilo se forma un nuevo grupo funcional, el grupo carboxilo, característico de los ácidos carboxílicos. Este sustituyente se representa por -COOH o CO2H. Hasta cierto punto los ácidos carboxílicos pueden considerarse como derivados hidroxicarbonílicos ya que muestran aspectos de la reactividad de los alcoholes y cetonas. Así, son tanto ácidos como bases: el protón del grupo OH o todo el grupo OH pueden ser reemplazados por otros sustituyentes y la función carbonilo es susceptible al ataque nucleófilo sobre el carbono. Sin embargo, debido a la proximidad de ambos grupos, el grupo carboxilo tiene también una química particular y característica. R electrófilo d C d O O ácido H básico El enlace carbono-oxígeno de los alcoholes mide aproximadamente 1,43 A, en tanto que la longitud de dicho enlace en los aldehidos y cetonas es de 1,23 A aproximadamente. En el ácido fórmico la longitud del enlace C=O es de 1,202 A en tanto que la longitud del enlace C - OH es de solo 1,343 A. 1,097 A 124,1º 1,343 A 1,202 A H C 110º O O 124,9º H 106,3º 0,972 A El átomo de carbono emplea tres orbitales híbridos sp2 y un orbital p para formar sus enlaces. De acuerdo con esto, puede predecirse que el anión carboxilato es plano y con ángulos de aproximadamente 120º entre sus átomos. El ácido carboxílico presenta una estructura resonante: O R C O OH R C O OH R C OH Un ácido carboxílico cede protones por ruptura heterolítica del enlace O - H dando un protón y un ion carboxilato. O O R C O C R H O + H + Se dice que un ácido carboxílico es alifático cuando tiene un grupo alquilo unido al grupo carboxilo, si el grupo que se une al - COOH es un grupo arilo tenemos un ácido aromático. Se llaman “ácidos grasos” a los ácidos alifáticos de cadena larga y que derivan de la hidrolisis de grasas y aceites. PROPIEDADES FISICAS.La estructura indicada hace suponer que los ácidos carboxílicos son moléculas polares, y al igual que los alcoholes pueden formar puentes de hidrógeno entre sí y con otros tipos de moléculas polarizadas como es el caso del agua y alcoholes. No es de extrañar, por tanto, que los ácidos carboxílicos inferiores (hasta el butanoico) sean totalmente solubles en agua. El ácido de cinco átomos de carbono es parcialmente soluble y los superiores son virtualmente insolubles. La solubilidad en agua se debe a los puentes de hidrógeno entre el ácido carboxílico y el agua: R O H O H O H C H O H Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman con ellos enlaces por puente de hidrógeno, además, los alcoholes no son tan polares como el agua, de tal forma que los ácidos de cadena larga son más solubles en ellos que en el agua. La mayor parte de los ácidos carboxílicos son bastante solubles en disolventes no polares como el cloroformo, éter, benceno, etc. Los ácidos carboxílicos hierven a temperaturas aún más elevadas que los alcoholes, cetonas o aldehídos de pesos moleculares semejantes. El ácido propanoico (141ºC) hierve a unos 20ºC más que el alcohol de peso molecular semejante, el n- butanol (118ºC). Estos puntos de ebullición tan elevados se deben a la formación de un dímero estable mediante puentes de hidrógeno, que duplican efectivamente el peso molecular de las moléculas que dejan la fase líquida. O R H O C C O H R O La interacción O - H ......... O tiene una energía de unos 6-8 Kcal /mol. Los ácidos caboxílicos que tienen más de ocho átomos de carbono son por lo general sólidos, a menos que contengan dobles enlaces. Los puntos de fusión son también elevados, debido a que el enlace de hidrógeno persiste en el estado sólido. Los olores de los ácidos alifáticos inferiores progresan desde los fuertes e irritantes del fórmico y el acético, hasta los abiertamente desagradables del butírico (butanoico), valerianico (pentanoico) y caproico (hexanoico). Los ácidos superiores tienen muy poco olor debido a sus bajas volatilidad Aunque mucho más débiles que los ácidos minerales fuertes (H2SO4, HCl, HNO3) los ácidos carboxílicos son sustancialmente más ácidos que los orgánicos muy débiles (alcoholes, acetileno, así, el ácido acético es 1011 veces más ácido que los alcoholes más ácidos); son mucho más ácidos que el agua, por lo que los hidróxidos acuosos los convierten en sus sales con facilidad, y los ácidos minerales acuosos reconvierten las sales en los ácidos carboxílicos correspondientes. Debido a que se convierten frecuentemente en sus sales y viceversa es interesante examinar sus propiedades. O C R ácido O O H - OH H C R O sal Las sales de los ácidos carboxílicos son sólidos cristalinos no volátiles. Debido a las considerables fuerzas electrostáticas que mantienen a los iones en el retículo cristalino, los puntos de fusión son tan altos que antes de fundir se rompen los enlaces carbonocarbono y se descompone la molécula entre 300-400ºC. Las sales de metales alcalinos (Na, K, NH+4) son solubles en agua pero no en disolventes no polares, por el contrario la mayoría de las sales de metales pesados (Ag, Fe, Cu, etc.) son insolubles en agua. De esta manera se puede observar, que salvo en el caso de los ácidos de cuatro carbonos o menos que son solubles en agua y en disolventes orgánicos, los ácidos carboxílicos y sus sales de metales alcalinos exhiben un comportamiento de solubilidad exactamente opuesta. Debido a la fácil interconversión de ácido y sus sales, este comportamiento se puede utilizar de dos formas importantes: para la identificación y para la separación. Así, un compuesto orgánico insoluble en agua que se disuelve en NaOH acuoso, diluido y frío, debe ser un ácido carboxílico o uno de los pocos otros tipos de compuestos orgánicos más ácidos que el agua. O O C + NaOH O H R insoluble en agua + H2O C Na O R soluble en agua O C R O O H + C NaHCO3 R + O Na H2O + CO2 ACIDEZ DE LOS ACIDOS CARBOXILICOS. Un ácido carboxílico se puede disociar en agua para dar un protón y un ion carboxilato. R COO + Ka = H2O [R R COOH + H3O COO ] [H3O ] [R COOH ] Los valores de pKa son aproximadamente 5 (Ka = 10-5) para los ácidos carboxílicos simples. Así, por ejemplo, el ácido acético tiene un pKa de 4,7 (Ka = 1,8.10-5). De acuerdo con esto, aunque los ácidos carboxílicos no son tan fuertes como los ácidos minerales o inorgánicos, son mucho más ácidos que otros grupos funcionales que hemos estudiado, como es el caso de los alcoholes, los cuales tienen un pKa que varia entre 16 y 18, por lo que el ácido acético es unas 1011 veces más ácido que los alcoholes más ácidos. La disociación de un ácido o de un alcohol implica la ruptura de un enlace O H, pero la disociación de un ácido carboxílico da un ion carboxilato con la carga negativa repartida por igual sobre dos átomos de oxígeno, en cambio sólo un oxígeno lleva la carga negativa en el ion alcóxido, por lo cual esta deslocalización de la carga convierte al ion carboxilato en un ion más estable que el ion alcóxido. R OH + H2O R O C R O O O H + H2O R pKa = 16(Ka=10 -16 ) H3O + O C R C O + H3O pKa=5(Ka=10 -5 ) O Un sustituyente que estabilice el ion carboxilato con carga negativa, aumenta la disociación y produce un ácido más fuerte. De este modo los átomos electronegativos aumentan la fuerza de un ácido. Dicho de otra manera, los sustituyentes con atracción de electrones dispersan la carga negativa, estabilizan al anión y aumentan la acidez. Los sustituyentes con liberación de electrones en cambio, aumentan la carga negativa, desestabilizan al anión y entonces reducen la acidez. Este efecto inductivo puede ser muy grande si están presentes uno o más grupos que atraen electrones en el átomo de carbono . Así, por ejemplo, tenemos: CH3 COOH pKa= 4,74 ClCH2 COOH pKa= 2,86 Cl 2CH COOH Cl 3C COOH pKa= 0,64 pKa= 1,26 La magnitud del efecto de un sustituyente depende de su distancia al grupo carboxilo. Los sustituyentes en el átomo de carbono son los más eficaces para aumentar la fuerza de un ácido. Los sustituyentes más distantes tienen efectos mucho más pequeños sobre la acidez, mostrando que los efectos inductivos decrecen rápidamente con la distancia. H3C Cl O CH2 CH C pKa= 2,86 OH H3C Cl O CH CH2 C pKa= 4,05 Cl OH H2C O CH2 CH2 pKa= 4,52 C OH ANALISIS ESPECTROSCOPICO DE LOS ACIDOS CARBOXILICOS. El grupo carbonilo como ya hemos indicado está constituido por un grupo carbonilo (C = O) y un grupo hidroxilo (O - H). Así, en el I.R., en ácidos unidos por puentes de hidrógeno (dímeros) los alargamientos O - H dan una banda ancha e intensa entre 2500-3500 cm-1. -COOH y enoles 2500-3500 cm-1 R - OH y Ar - OH 3200-3600 cm-1 Al igual que en los aldehídos y cetonas, la señal correspondiente al C = O aparece como una banda intensa que debido a su frecuencia característica da bastante información sobre el tipo de estructura. Para ácidos (con puente de hidrógeno) la banda del carbonilo aparece alrededor de 1700-1710 cm-1. En cuanto al espectro de 1H-RMN lo más destacable de los ácidos carboxílicos es la absorción a campo bajo, d 10,5-12, del protón del grupo carboxílo (-COOH). En el U.V. los ácidos carboxílicos saturados absorben alrededor de 200 a 215 nm. Los ácidos conjugados muestran absorciones mucho más intensas. Así, un doble enlace -C = Cconjugado con el grupo carboxílo produce un espectro con una señal alrededor de 200 nm. La presencia de un segundo doble enlace conjugado presenta una señal a 250 nm. IMPORTANCIA DE LOS ACIDOS CARBOXILICO. FUENTE INDUSTRIAL. Los ácidos carboxílicos son abundantes en la naturaleza. Así, el ácido metanoico (ácido fórmico) no sólo se encuentra en las hormigas, donde actúa como feromona de alarma, sino también en las plantas. Así, las ortigas son irritantes debido a que cuando se tocan inyectan ácido fórmico. Este ácido se prepara a gran escala por reacción de hidróxido sódico en polvo con CO a presión. Esta transformación transcurre por adición nucleofílica seguida de protonación. NaOH + CO 150ºC 7 atm + HCOO Na H H2O H COOH El ácido etanoico (ácido acético) se forma en la naturaleza por oxidación enzimática (bacterias Acetobacter) del etanol producido por fermentación. Este ácido y su anhídrido son productos industriales de gran consumo y se utilizan en la manufactura de monómeros para polimerización como son el etanoato de etenilo (acetato de vinilo), en la industria farmacéutica y para la fabricación de colorantes y pesticidas. Los métodos industriales principales para la preparación de estos compuestos son: 1.- Oxidación catalítica con aire de diversos hidrocarburos o de acetaldehido: H2C CH2 O2/H2O; PdCl 2-CuCl 2 Proceso Wacker H3C CHO O2 catalizador Co3+ CH3 COOH 3+ H3C CH2 CH2 CH3 O2, catalizador Co 15-20 atm; 180ºC CH3 COOH 2.- Por carbonilación del metanol (Proceso Monsanto) 3+ CH3OH + CO catalizador de Rh , I2 30-40 atm, 180ºC CH3 COOH Este ácido también es importante en la naturaleza, así por ejemplo, es la unidad de construcción en la biosíntesis de los ácidos grasos y se ha identificado como la feromona de defensa en algunas hormigas y escorpiones. Un grupo muy importante de ácidos carboxílicos naturales son los aminoácidos que constituyen las unidades monómeras de polímeros tan importantes desde el punto de vista biológico como los péptidos y proteínas. Las fuentes de ácidos carboxílicos alifáticos más importantes son las grasas animales y vegetales, que son ésteres de ácidos carboxílicos de cadena larga, de las que se pueden obtener ácidos carboxílicos de cadena recta con un número par de carbonos, debido a que derivan biológicamente del ácido etanoico con una pureza superior al 90 %. La hidrólisis o “saponificación” (debido a que las sales correspondientes forman jabones, del latín sapo = jabón) da los “ácidos grasos” correspondientes. Los ácidos grasos más importantes tienen entre 12 y 22 átomos de carbono en cadena recta y además pueden ser insaturados como el ácido oleico: H3C (CH2)14 COOH ácido palmítico H3C (CH2)7 C C (CH2)7 COOH H H ácido oleíco (cis-9-octadecanoico) Las sales sódicas y potásicas de los ácidos grasos tienen la interesante propiedad de agregarse en micelas esféricas en solución acuosa. OOC COO OOC OOC COO COO OOC Región hidrofóbi ca COO OOC COO COO OOC GRASA COO COO OOC OOC COO COO OOC OOC OOC COO COO COO OOC COO En estos agregados todas las cadenas alquílicas hidrofóbicas de los ácidos intentan mantenerse juntas debido a las fuerzas de atracción de London y su tendencia a minimizar su exposición al agua. Las cabezas polares de los carboxilatos, solvatados por el agua forman una pared esférica alrededor de un núcleo hidrocarbonado. Las sales carboxílicas también pueden dar películas en la superficie del agua en la que los grupos polares se introducen en el agua, mientras que las cadenas alquílicas dan una capa hidrofóbica. Esta disposición reduce la tensión superficial y permite la formación de la espuma típica de los jabones. De hecho, tales sales fueron de los primeros jabones que se utilizaron. Básicamente, su modo de acción consiste en disolver materias que normalmente no serían solubles en agua (aceites, grasas,) en el interior de las micelas y reducir la tensión superficial del agua de modo que esta pueda penetrar en el interior de los tejidos. Los detergentes modernos están basados en alcanosulfonatos [ CH3-(CH2)nCH2-SO3- +Na , que son biodegradables como los jabones, pero no forman precipitados con los iones calcio y magnesio del agua dura, un problema común con las aguas de Las Palmas de G.C. debido a su interacción con los aniones de los ácidos grasos. (*) Ciertos “ácidos biliares” esteroídicos, como el ácido cólico se encuentran en los conductos biliares y participan en el emulsionado y la absorción por el organismo de grasas mediante la formación de micelas. Las “penicilinas” son antibióticos derivados de 2-aminoácidos. H CH3 COOH OH CH3 CH3 H H H S H2N H H HO CH3 H CH3 O H ácilo cólico COOH penicilina Los ácidos carboxílicos aromáticos más importantes son el ácido benzoico y los ácidos ftálicos, los cuales se preparan a escala industrial por una reacción conocida, la oxidación de alquilbencenos. El tolueno y el xileno necesarios se obtienen del petróleo por reformación catalítica de hidrocarburos alifáticos. Cantidades mucho menores de estos arenos se aíslan directamente del alquitrán de hulla. Otro precursor del ácido ftálico es el naftaleno que también se encuentra en el alquitrán de hulla. Se utilizan agentes oxidantes baratos como cloro e incluso aire, normalmente en presencia de catalizadores. Cl CH3 Cl C Cl Cl 2 calor Petróleo COOH OH H2O calor catalizador - CO2 COOH CH3 CH3 COOH O2 ó V2O5 El ácido benzoico se usa como ingrediente en medicina, conservador de alimentos y materia prima en síntesis. Se puede obtener también del tolueno: COO CH3 KMnO4 H2O, OH K COOH H + El ácido ftálico se utiliza en la fabricación de poliésteres. Otro diácido comercialmente importante es el ácido adipíco (ácido hexanodioico), el cual se utiliza en la fabricación del Nylón 66, y que se puede sintetizar a partir del benceno: H2/Ni alta presión COOH O2 Co(OCOCH3)3; CH3COOH COOH PREPARACION DE ACIDOS CARBOXILICOS. Los ácidos alifáticos de cadena recta hasta seis átomos de carbono y aquellos de número par de carbonos hasta 18, existen comercialmente, lo mismo que los ácidos aromáticos simples. Los distintos métodos de obtención de ácidos carboxílicos incluyen: 1.- Oxidación de alquenos: R CH CH R´ KMnO4 calor R COOH + R´ COOH 2.- Oxidación de aldehídos y de alcoholes primarios: KMnO4 (dil.) + Ag(NH3)2 R CHO R CH2OH + KMnO4 R COOH H2O/OH calor R + COO H R 3.- Oxidación de alquilbencenos: R´ COOH K + MnO2 + COOH - CH3 1)KMnO4,OH , calor 2) H + COOH 4.- Oxidación de metil-cetonas (Reacción de haloformo): O C R O CH3 1) X2/NaOH 2) H + C R + COOH CHX3 haloformo 5.- Hidrólisis de cianhidrinas: OH R´ OH + R C O + HCN R C CN R´ H H2O R C R´ COOH 6.- Carbonatación de los reactivos de Grignard: La síntesis de Grignard de un ácido carboxílico se realiza burbujeando CO 2 gaseoso en una solución etérea del reactivo o vertiendo el reactivo de Grignard sobre hielo seco molido (CO2 sólido). En este caso, el hielo seco no sólo sirve como reactivo, sino también como refrigerante. R Mg éter X R MgX + C CH3 H3C Mg Cl éter C H3C O O CH3 C CH3 R COO + R COOH CH3 MgCl H3C CH3 C COOH CH3 Mg éter Br H MgX MgBr 1) CO2 2) H2O COOH Para preparar el reactivo de Grignard, puede emplearse un halogenuro de alquilo primario, secundario, terciario o aromático. El método sólo esta limitado por la presencia de otros grupos reactivos en la molécula (-NO2, -NH2, -COOH, etc.) 7.- Síntesis mediante nitrilos. Los nitrilos alifáticos se preparan por tratamiento de halogenuros de alquilo con cianuro sódico en un disolvente que disuelva ambos reactivos (acetona). Así, por ejemplo, en DMSO (dimetilsulfóxido) la reacción tiene lugar a temperatura ambiente con rápidez y exotérmicamente. Luego se hidroliza el nitrilo resultante, hirviendo con ácido o álcali acuosos para general el ácido: + - d d R X + Na R CN H R C H2O N + C N + X R COOH + NH4 R COO + OH + + NH3 De hecho, los nitrilos se hidrolizan primero a amidas y después a ácido carboxílico: Hidrólisis ácida: O R C N + H2O H R C O + + NH2 H H2O R C + OH + NH4 Hidrólisis básica: R C OH - N + H2O O R O - C OH H2O NH2 R C O + NH3 En el caso de los nitrilos aromáticos, estos se obtienen a partir de las sales de diazonio y no a partir de los halogenuros de alquilo: C N COOH CH3 Sal de diazonio CH3 NaCN H2SO4(conc.) 150-160ºC + + NH4 En general podemos decir que la oxidación es el método más directo y se usa siempre que sea posible. La síntesis de Grignard y la síntesis mediante nitrilos tiene la ventaja adicional de alargar la cadena de átomos de carbono. En la serie alifática, tanto los reactivos de Grignard como los nitrilos se preparan con halogenuros, los cuales a su vez se sintetizan de los alcoholes. De forma esquemática sería: KMnO4 R R COOH Mg éter CH2OH PBr 3 R CH2Br CN R CH2 MgBr R CH2 C 1) CO2 2) H + - H2O N R R CH2 COOH CH2 COOH SUSTITUCIONES NUCLEOFÍLICAS EN EL CARBONO ACÍLICO. Como ya vimos en el tema anterior la reacción más característica de los aldehídos y cetonas es la adición nucleofílica al doble enlace carbono-oxígeno: R1 R2 C O + Nu (ó Nu H) R1 R2 C Nu O H + R1 R2 C Nu O H Al estudiar las ácidos carboxílicos y posteriormente sus derivados, nos encontraremos que sus reacciones están caracterizadas por las reacciones de sustitución nucleofílicas que se llevan a cabo en sus carbonos acílicos (carbonilicos). La reacción general es: R1 C O + Nu (ó Nu R1 H) L C O H + R1 L C O + L Nu Nu L = -OR(éster); -X(haluro de ácido); -NH2(amida) Como se puede observar aunque los resultados son diferentes, las dos reacciones tienen en común que en la etapa inicial se lleva a cabo un ataque nucleofílico sobre el átomo de carbono del grupo carbonilo. La diferencia estriba en la 2ª etapa, donde en el caso de los aldehídos y cetonas el intermediario que se forma acepta un protón para formar un producto de adición, mientras que el intermediario formado a partir de un grupo acilo casi siempre libera un grupo lábil, esto da lugar a la regeneración del doble enlace C = O, y a un producto de sustitución. O C R O O Cl + Nu H R C Nu C H R Nu H + Cl Cl O C R + Nu H Cl De acuerdo con este comportamiento, las principales reacciones de los ácidos carboxílicos son las denominadas “conversiones en derivados funcionales”, conteniendo todos ellos el grupo acilo. O R C Los derivados funcionales se reconvierten con facilidad en el ácido por simple hidrólisis y a menudo también se interconvierten entre ellos. Conversión a cloruros de ácido. Un cloruro de ácido se prepara por sustitución del -OH del ácido por un -Cl. Con este fin se emplean a menudo los siguientes reactivos: cloruro de tionilo (SOCl2), cloruro de oxalilo (COCl)2, PCl3 y PCl5. O R C O SOCl 2 + OH R O CH2 CH2 C C + Cl + HCl SO2 O OH + CH2 CH2 C Cl PCl 5 + POCl 3 + HCl Los mejores reactivos para convertir los ácidos carboxílicos en cloruros de ácido son el SOCl2 y (COCl)2 porque forman subproductos gaseosos que no contaminan al producto. El exceso de ambos reactivos se puede eliminar por destilación ya que hierven a 79ºC y 62ºC respectivamente. O H3C (CH2)7 C (CH2)7 C C O OH Cl O O C C H3C C H H (CH2)7 C (CH2)7 Cl C Cl + HCl + CO + H2O H H Conversión a ésteres. Frecuentemente los ácidos se convierten en sus ésteres por medio de los cloruros de ácido: O C R O SOCl 2 OH C R O R1 OH Cl C R OR1 Un ácido carboxílico se convierte directamente en un éster al calentarlo con un alcohol en presencia de un poco de ácido mineral, generalmente H2SO4 o HCl seco (esterificación de Fischer). Esta es una reacción que es reversible y alcanza el equilibrio cuando aún quedan cantidades apreciables de reactivos: O H3C COOH + H3C CH2OH H2SO4 Keq=3,38 H3C C O CH2 CH3 + H2O Ahora bien esta reversibilidad es un inconveniente en la preparación directa de un éster a partir de un ácido, pudiéndose favorecer la reacción hacia la derecha mediante un exceso de reactivo o eliminando uno de los productos. El equilibrio es particularmente desfavorable si utilizamos fenoles en lugar de alcoholes. No obstante, si se elimina agua durante la reacción, se obtienen ésteres fenólicos (R-COOAr) con rendimientos importantes. Asimismo la presencia de grupos voluminosos próximos la lugar de la reacción en el alcohol o en ácido, disminuye la velocidad de esterificación. Debido a los inconvenientes para favorecer la esterificación de Fischer hasta su terminación, con frecuencia se prefiere la reacción de un halogenuro de ácido con un alcohol para la síntesis de los ésteres en el laboratorio. La esterificación de Fischer se usa normalmente en la industria, evitando el paso, relativamente caro de convertir el ácido en su cloruro. Conversión en amidas. Las amidas son compuestos que se obtienen al reemplazar el grupo -OH del ácido carboxílico por el grupo -NH2. En general se preparan por reacciones del amoniaco con cloruro de ácido: O R C O SOCl 2 OH C R O + 2 NH3 Cl R C + NH4Cl NH2 el procedimiento con cloruro de ácido utiliza condiciones más moderadas y con frecuencia da mejores rendimientos. Sin embargo, la síntesis directa es un procedimiento industrial importante porque evita el gasto de fabricar el cloruro de ácido: O R C O + OH R1 NH2 R C O calor O H3N R1 R C + NH R1 H2O Reducción de ácidos a alcoholes. La conversión de alcoholes a ácidos tiene importancia debido a que los primeros son más accesibles que los segundos. Pero no siempre es así, los ácidos de largas cadenas rectas procedentes de las grasas son más accesibles que los alcoholes correspondientes, de modo que el proceso inverso es importante en este caso. El hidruro de aluminio y litio, LiAlH4, es uno de los pocos reactivos capaces de reducir los ácidos carboxílicos para formar alcoholes primarios: O R C 1) LiAlH4 OH 2) H3O + R CH2OH Como este reactivo es relativamente caro, la industria lo utiliza para la reducción de cantidades pequeñas de materias primas valiosas, como en la síntesis de ciertas drogas y hormonas. Como alternativa a la reducción directa, a menudo se convierten ácidos en alcoholes por un proceso en dos etapas: esterificación y reducción del éster. Reducción a aldehídos. La reducción de ácidos carboxílicos a aldehídos es difícil debido a los aldehídos son más reactivos que los ácidos hacia la mayor parte de los reactivos reductores. Cualquier reactivo que reduzca el ácido a aldehído también reduce el aldehído a alcohol primario, por lo cual, lo que se requiere es un derivado del ácido que sea más reactivo (cloruro de ácido) que el aldehído. El triterbutóxidohidruro aluminio y litio LiAl[OC(CH3)3]H es un agente reductor más suave que el LiAlH4. O R C O SOCl 2 OH R C O + LiAl[CO(CH3) 3]H Cl R C + LiCl + Al[CO(CH3)3] H Halogenación de los ácidos alifáticos. En presencia de una pequeña cantidad de fósforo, los ácidos carboxílicos alifáticos reaccionan suavemente con cloro o bromo para dar un compuesto en el que se ha reemplazado un hidrógeno por un halógeno. Esta es la reacción de Hell-Volhard- Zelinsky (HVZ). Debido a su especificidad (halogenación exclusiva en ) y a la facilidad con que se realiza, es de gran importancia en síntesis. Cl R CH2 X2/P COOH PX3 R CH COOH X2/P PX3 R Cl CH3 COOH X2/P PX3 ClCH2 COOH C COOH X2/P PX3 Cl X2/P PX3 Cl CH N.R. Cl COOH X2/P Cl PX3 Cl C COOH Cl El mecanismo transcurre por intermedios iónicos y es bastante complejo. El halógeno de estos ácidos es muy reactivo y se suele utilizar este proceso (halogenación) como un primer paso en la conversión de un ácido carboxílico a muchos ácidos carboxílicos sustituidos importantes. R R CH COOH + NH3(exceso) R Cl NH2 ( -aminoácido) CH COOH + Na OH R Br CH COOH + HCl CH COONa OH H + R CH COOH OH ( -hidroxiácido) A su vez estos nuevos sustituyentes sufren sus reacciones características. Síntesis Malónica de ácidos carboxílicos. Unos de los métodos más eficaces para preparar ácidos carboxílicos emplea el malonato de etilo (éster malónico) CH2(COOC2H5)2 y se denomina “síntesis malónica”. Esta síntesis depende de: 1.- La acidez considerable de los hidrógenos del éster malónico. 2.- La gran facilidad con que se descarboxilan el ácido malónico y los ácidos malónicos sustituidos, La reacción general es: COO CH2 CH3 1) Na CH2 COO CH2 CH3 OCH2CH3 2) R X COO CH2 CH3 1) H2O, OH R CH + COO CH2 CH3 2) H, calor R CH2 COOH + CO2 Esta reacción se inicia mediante etóxido de sodio en etanol para formar la sal: COO CH2 CH3 H CH COO CH2 CH3 + Na OCH2CH3 COO CH2 CH3 CH Na HO CH2CH3 + COO CH2 CH3 A continuación se produce un ataque nucleofílico del carbanión sobre el halogenuro de alquilo (los rendimientos son máximos en halogenuros primarios, menores con los secundarios y no sirve para los terciarios o de arilo). COO CH2 CH3 CH Na COO CH2 CH3 + R X COO CH2 CH3 R CH + Na X COO CH2 CH3 El éster alquilmalónico sigue teniendo un hidrógeno ionizable que puede convertirse en su sal con etóxido de sodio nuevamente y volver a reaccionar con un halogenuro de alquilo igual o distinto al anterior y generar un éster dialquimalónico. COO CH2 CH3 R C H COO CH2 CH3 COO CH2 CH3 + Na OCH2CH3 R C Na + HO CH2CH3 + Na COO CH2 CH3 R1 X COO CH2 CH3 R C R1 X COO CH2 CH3 Al calentar el ácido malónico a una temperatura algo superior a la de fusión se descarboxila con facilidad dando ácido acético. De manera similar los ácidos malónicos sustituidos pierden CO2 para dar ácidos sustituidos. Los ésteres mono y dialquilsustituidos preparados se convierten con facilidad en ácidos monocarboxílicos por hidrólisis, acidulación y calor: COO CH2 CH3 R CH COO CH2 CH3 COO H2O, OH calor R CH COO CH2 CH3 COOH + R CH COO COO CH2 CH3 R C R1 H R C R1 R CH2 COOH + CO2 COOH COO H2O, OH calor calor H COOH + R C R1 calor R CH COOH + CO2 COOH COO R1 Así, al planificar una síntesis malónica debemos elegir el o los halogenuros de alquilo apropiados, para lo cual hay que estudiar la estructura del ácido que pretendemos obtener: COO CH2 CH3 CH2 COO CH2 CH3 1) Na OCH2CH3 CH3(CH2)3 2)CH3CH2CH2CH2Br COO CH2 CH3 CH COO CH2 CH3 1) H2O, OH + 2) H , calor CH3(CH2)2CH2COOH Reacción de Hunsdiecker. Descarboxilación de ácidos carboxílicos. Este proceso que tiene lugar mediante un mecanismo por radicales y permite obtener un haluro de alquilo a partir de un ácido carboxílico por tratamiento de este con un ion metálico que puede ser Ag, Hg(II) ó Pb(IV), con la característica de que el haluro resultante tiene un átomo de carbono menos que el ácido de partida. H3C CH2 CH2 CH2 COOH ácido pentanoico Ag2O, Br2 CCl4 H3C CH2 CH2 CH2 Br + CO2 1-bromo butano ÁCIDOS DICARBONÍLICOS. En este apartado podemos agrupar los ácidos dicarboxílicos propiamente dichos, los cuales se caracterizan por tener dos grupos –COOH y los llamados cetoácidos que se caracterizan por tener el grupo característico del ácido y además un grupo carbonilo O O HO C R C CH2 COOH O (CH2)n C OH ácido dicarboxílico cetoácido Según la posición que ocupe el grupo carbonilo, lo cetoácidos se pueden clasificar como, , , , d-cetoácidos, etc. O H3C C COOH -cetoácido ácido pirúvico O O O H3C C CH2 C OH H3C C CH2 CH2 COOH -cetoácido -cetoácido ácido levulínico ácido -cetobutírico O H3C C CH2 CH2 CH2 COOH d-cetoácido Una característica estos compuestos dicarbonílicos (cetoácidos y ácidos dicarboxílicos) es que cuanto más próximos estén el grupo carbonilo (-CO) y el grupo ácido (-COOH) mayor será su acidez, mientras que a medida que se van separando disminuye su acidez. Asimismo tienen una marcada acidez los H en posición respecto a los grupos carbonilo como es el caso de las -cetoácidos y los ácidos -dicarboxílicos. hidrógeno ácido O H O O H O H3C C CH C OH HO C CH C OH -cetoácido ácido -dicarboxílico Los -cetoácidos por calentamiento se descarbonilan perdiendo CO y formando ácido O O O calor H3C C C OH CO + H3C C OH Los -cetoácidos se descarboxilan perdiendo el grupo carbonilo del grupo ácido originando la correspondiente cetona, mientras que los ácidos -dicarboxilicos también se descarboxilan pero dan lugar al correspondiente ácido. O O O H3C C CH2 C OH O HO C CH2 calor H3C C CH3 + CO2 O O C OH calor H3C C OH + CO2 La mayoría de los ácidos dicarboxílicos se preparan por adaptación de los métodos utilizados para los ácidos monocarboxílicos. PRINCIPALES APLICACIONES INDUSTRIALES. Los ácidos carboxílicos de mayor aplicación industrial son el ácido acético que se utiliza fundamentalmente para la obtención de acetato de vinilo que se utiliza como monómero para la fabricación de polímeros. También se utiliza en la producción de acetato de celulosa para la obtención de lacas y películas fotográficas, así como en la fabricación de disolventes de resinas y lacas. La sal alumínica del ácido acético se emplea como mordiente en tintorería. El ácido fórmico se suele emplear en la industria del curtido al objeto de suavizar las pieles y también en los procesos de tintorería en la industria del curtido. Algunos derivados clorados de los ácidos carboxílicos se emplean en la producción de herbicidas. Cl Cl O H3C C C OH O Cl CH2 COOH O Cl CH2 COOH Cl Dalapon Cl Cl 2,4-D 2,4,5-D El ácido benzoico tiene una amplia utilidad como intermediario de síntesis en muchos procesos orgánicos y algunos de sus ésteres se emplean como plastificantes y en la industria de la perfumería (benzoato de bencilo). El benzoato de sodio se emplea en la industria de la alimentación como conservante (zumos, refrescos, mermeladas, etc.). O O C O benzoato sódico Na C O CH2 benzoato de bencilo Entre los ácidos dicarboxílicos, el ácido propanodioico (ácido malónico) se emplea en la elaboración de medicamentos, plaguicidas y colorantes. El ácido 1-4butanodioico (ácido succínico) se emplea en la obtención de resinas de poliéster para barnices y el ácido trans-butenodioico (ácido fumárico) se emplea como acidulante en la fabricación de refrescos. BIBLIOGRAFIA. - Bonner W.A y Castro A.J. Química Orgánica Básica. Ed. Alhambra Universidad. - McMurry, J. Quimica Orgánica. Grupo Editorial Iberoamérica. - Morrison-Boyd. Química Orgánica. Ed. Addison-Wesley. - Primo Yúfera, E. Química Orgánica Básica y Aplicada. Tomo I. Ed. Reverté S.A. - Vollhardt, P.C. Química Orgánica. Ed. Omega. - Wade, L.G. Química Orgánica. Ed. Prentice-Hall.