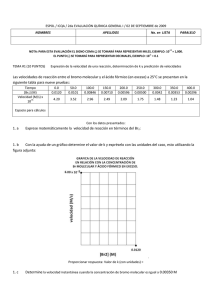
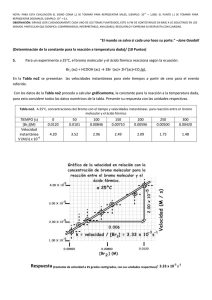
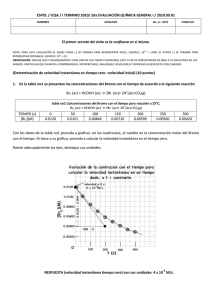
UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERÍA MECÁNICA QUIMICA APLICADA INFORME N°05: ALCALINOS Docente: Ing. Diaz Cabrera Carlos Zacarias Integrantes: Cabrera Holguín Benjamín- 2327130015 Manrique Sosa Miguel Angel- 2327120062 Isique Lumbre Renzo- 2327120417 Sanchez Monja Marcelo-2327110028 Román Sunquillpa Gonzalo-2327120427 Grupo horario: 05L Semestre: 2024-B Callao-Lima OBJETIVOS GENERALES: Reconocer los alcalinos y halógenos usando compuestos químicos como el cloroformo y la fenolftaleína. Conocer algunas propiedades de la tabla periódica como la energía de ionización, afinidad electrónica y electronegatividad. MARCO TEÓRICO: Antes de entrar al tema principal, conozcamos un poco algunas propiedades de los elementos: Energía de ionización (EI): “Es la energía mínima (en KJ/mol) necesaria para remover un electrón de un átomo en estado gaseoso, en su estado fundamental” (K. G. R. Chang, 2014, p. 340). X(g) + EI → X(g)+ + e ∆ H= + Afinidad electrónica (AE): “Es el valor negativo del cambio de energía que se desarrolla cuando un átomo, en estado gaseoso, acepta un electrón para formar un anión” (K. G. R. Chang, 2014, p. 345). X(g) + e- → X(g)- ∆ H= - X(g)- + e- → X(g)= ∆ H= + Electronegatividad (EN): “Es la capacidad de un átomo para atraer hacia sí los electrones de un enlace químico” (K. G. R. Chang, 2014, p. 380) Alcalinos: Los metales alcalinos son un grupo de elementos químicos en la tabla periódica que incluye el litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Se encuentran en el grupo 1 y son altamente reactivos, especialmente con el agua, formando hidróxidos y liberando hidrógeno. Esta reactividad se debe a su baja energía de ionización, la cual está representada por: X(g) + EI → X(g)+ + e- ∆ H= + Tienen un solo electrón en su capa exterior, lo que les confiere propiedades químicas similares, como una baja densidad y puntos de fusión relativamente bajos. Además, “Estos elementos tienen una baja energía de ionización y, por lo tanto, gran tendencia a perder el único electrón de valencia. De hecho, en la mayoría de sus compuestos forman iones monopositivos. Dichos metales son tan reactivos que nunca se encuentran libres en la naturaleza” (K. G. R. Chang, 2014, p. 349) Elementos pertenecientes al grupo IA (Alcalinos): Según la tabla periódica moderna, tenemos los siguientes elementos con algunas de sus aplicaciones: Li (Litio): Ligero y blando, se utiliza en baterías recargables y en la industria farmacéutica para tratar trastornos del estado de ánimo. Na (Sodio): Muy reactivo, se encuentra en la sal común (NaCl) y se utiliza en la fabricación de productos químicos y en la industria alimentaria. K (Potasio): Esencial para la vida, se utiliza en fertilizantes y en la regulación del equilibrio hídrico en organismos. Rb (Rubidio): Poco común, se usa en aplicaciones especializadas como en relojes atómicos y en la investigación de láseres. Cs (Cesio): Muy reactivo y con un punto de fusión bajo, se utiliza en relojes atómicos de alta precisión y en ciertas aplicaciones industriales. Fr (Francio): Extremadamente raro y radiactivo, tiene poco uso práctico debido a su inestabilidad y escasez, pero es interesante para la investigación científica. Ordenados de menor a mayor reactividad Propiedades de los alcalinos: Alta reactividad: Especialmente con agua y halógenos. Baja densidad: Son menos densos que muchos metales. Bajo punto de fusión: Se funden a temperaturas relativamente bajas. Blandos: Pueden cortarse con un cuchillo. Forman iones +1: Tienen una valencia de +1 en compuestos. Buena conductividad eléctrica: Son buenos conductores de electricidad. Brillo metálico: Poseen brillo metálico característico, pero al aire libre lo pierden rápidamente debido a su fácil oxidación. Fenolftaleína: “La fenolftaleína es un indicador que en medio ácido o neutro es incoloro, pero adquiere un color rosa intenso en disoluciones básicas” (K. G. R. Chang, 2014, p. 152). Reacciones químicas: Al reaccionar un metal con el agua (H2O), obtendremos un hidróxido con H de residuo. Para este caso, hemos analizado las reacciones con el litio, sodio y potasio. Hidróxido de litio: El litio reacciona fuertemente con el agua formando hidróxido de litio e hidrógeno altamente inflamable. Esta solución incolora es muy básica. Li + H2O → Li (OH) + H2 2Li + 2H2O → Li (OH) + H2 (balanceado) Hidróxido de sodio: Se forma una disolución incolora, que consiste en hidróxido de sodio (sosa cáustica) e hidrógeno gas. Se trata de una reacción exotérmica. El sodio metal se calienta y puede entrar en ignición y quemarse. Na + H2O → Na(OH) + H2 2Na + 2H2O → 2Na (OH) + H2 (balanceado) Hidróxido de potasio: El potasio reacciona violentamente con agua, produciendo hidrógeno. La reacción es notablemente más violenta que la del litio o sodio con agua, y es suficientemente exotérmica para que el gas hidrógeno desarrollado se encienda. K + H2O → K(OH) + H2 2K + 2H2O → 2K(OH) + H2 (balanceado) Halógenos: Son un grupo de elementos químicos en el grupo 17 de la tabla periódica, que incluye flúor (F), cloro (Cl), bromo (Br), yodo (I) y astato (At). Son altamente reactivos, especialmente con los metales, y forman sales cuando reaccionan con ellos. Son conocidos por su uso en desinfectantes, iluminación y productos químicos. Elementos pertenecientes al grupo VIIA (Halógenos): Según la tabla periódica moderna, tenemos los siguientes elementos: F (Flúor) Cl (Cloro) Br (Bromo) I (Yodo) At (Astato) Ordenados de mayor a menor reactividad Cloroformo: El cloroformo (CHCl₃) es un líquido volátil y aromático que se utiliza como disolvente en química. En el contexto de la identificación de halógenos, el cloroformo se puede emplear en reacciones que producen cambios de color al reaccionar con halógenos. Por ejemplo, el yodo disuelto en cloroformo puede mostrar un color violeta intenso. Para este caso, usaremos el cloro, bromo y yodo. Al reaccionar el cloroformo con estos halógenos, el producto se tornará de un color característica, según el elemento. Para el cloro: Verde amarillento Para el bromo: Café rojizo Para el yodo: Violeta intenso CHCl3 H2O/Cl2 H2O/I2 H2O/Br 2 Reacciones químicas: Primer ejemplo: 1. En un tubo de ensayo, colocamos un poco de agua de cloro (H2O/Cl2). 2. Agregamos bromuro de sodio(NaBr) 3. Agitamos un poco, agregamos cloroformo y analizamos el color. 1) H2O/Cl2 3) CHCl3 2) NaBr Notamos que el producto se torna de un color café rojizo, pero, ¿por qué sucede esto? Lo que pasa es que el cloro al ser más reactivo que el bromo, toma su lugar junto con el sodio, dejando solo al bromo. Finalmente, la reacción quedaría así: 2NaBr + Cl2 → Br2 + 2NaCl El cloroformo añadido, indica el color del halógeno libre resultante, en este caso sería el bromo. Segundo ejemplo: 1. En un tubo de ensayo, colocamos un poco de agua de bromo (H2O/Br2). 2. Agregamos cloruro de sodio (NaCl) 3. Agitamos un poco, agregamos cloroformo y analizamos el color. 1) H2O/Br2 3) CHCl3 2) NaCl Teniendo: NaCl + Br2 → NaCl + Br2 (No hay reacción) Esto ocurre porque el bromo no es lo suficientemente reactivo para desalojar al cloro. BIBLIOGRAFÍA: CHANG, K. G. R. (2014). General Chemistry: The Essential Concepts. McGraw Hill Education.23