Nombre: ________________________________________________ Guía de Laboratorio n°1 Ácido- Base
Anuncio

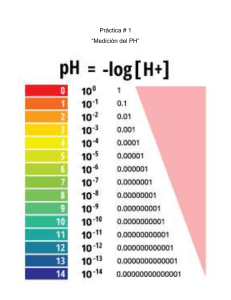
Dpto. de Ciencias Subsector: Química Profesora: Daniela Troncoso Ríos Guía de Laboratorio n°1 Ácido- Base Nombre: ________________________________________________ Curso: III°___ Fecha: /10/2013 Objetivo General: Identificar y clasificar sustancias ácidas y básicas según su pH. IMPORTANTE: NORMAS DE SEGURIDAD EN EL LABORATORIO NORMAS GENERALES No comas o bebas en el laboratorio. Utiliza una bata y tenla siempre bien abrochada, así protegerás tu ropa. Guarda tus prendas de abrigo y los objetos personales en un la sala de clases y no los dejes nunca sobre la mesa de trabajo. No lleves bufandas, pañuelos largos ni prendas u objetos que dificulten tu movilidad. Procura no andar de un lado para otro sin motivo y, sobre todo, no corras dentro del laboratorio. Si tienes el cabello largo, recógetelo. Dispón sobre la mesa sólo los libros y cuadernos que sean necesarios. Ten siempre tus manos limpias y secas. Si tienes alguna herida, tápala. No pruebes ni ingieras los productos. En caso de producirse un accidente, quemadura o lesión, comunícalo inmediatamente al profesor. Recuerda dónde está situado el botiquín. Mantén el área de trabajo limpia y ordenada. NORMAS PARA MANIPULAR INSTRUMENTOS Y PRODUCTOS Antes de manipular un aparato o montaje eléctrico, desconéctalo de la red eléctrica. No pongas en funcionamiento un circuito eléctrico sin que el profesor haya revisado la instalación. No utilices ninguna herramienta o máquina sin conocer su uso, funcionamiento y normas de seguridad específicas. Maneja con especial cuidado el material frágil, por ejemplo, el vidrio. Informa al profesor del material roto o averiado. Fíjate en los signos de peligrosidad que aparecen en los frascos de los productos químicos. Lávate las manos con jabón después de tocar cualquier producto químico. Al acabar la práctica, limpia y ordena el material utilizado. Si te salpicas accidentalmente, lava la zona afectada con agua abundante. Si salpicas la mesa, límpiala con agua y sécala después con un paño. Evita el contacto con fuentes de calor. No manipules cerca de ellas sustancias inflamables. Para sujetar el instrumental de vidrio y retirarlo del fuego, utiliza pinzas de madera. Cuando calientes los tubos de ensayo con la ayuda de dichas pinzas, procura darles cierta inclinación. Nunca mires directamente al interior del tubo por su abertura ni dirijas esta hacia algún compañero. Todos los productos inflamables deben almacenarse en un lugar adecuado y separados de los ácidos, las bases y los reactivos oxidantes. Los ácidos y las bases fuertes han de manejarse con mucha precaución, ya que la mayoría son corrosivos y, si caen sobre la piel o la ropa, pueden producir heridas y quemaduras importantes. Si tienes que mezclar algún ácido (por ejemplo, ácido sulfúrico) con agua, añade el ácido sobre el agua, nunca al contrario, pues el ácido «saltaría» y podría provocarte quemaduras en la cara y los ojos. No dejes destapados los frascos ni aspires su contenido. Muchas sustancias líquidas (alcohol, éter, cloroformo, amoníaco...) emiten vapores tóxicos. Simbología Actividad n°1: Identificación y clasificación de sustancias ácidas y básicas según su pH. Introducción:Una de las formas más comunes empleadas para clasificar una sustancia essu pH, concepto ampliamente utilizado en cremas, champú, bálsamos, perfumes, detergentes, entre otros productos que son anunciados como“de pH neutro”. ¿Sabemos qué significa realmente esta clasificación? Trabajaen un equipo organizado y desarrolla la siguiente actividad experimental. Paso 1: Exploración Observen atentamente los materiales y sustancias. Cada una de las sustancias a explorar deberá ser clasificada como sustancias ácidas, básicas o neutrassegún corresponda. Los materiales solicitados les permitirán dicha identificación y posterior clasificación, (indicador natural y papel pH) Paso 2: Preguntas de exploración Mirando los materiales y conociendo la finalidad del trabajo experimental,respondan las siguientes preguntas de investigación. 1. Además de las características operacionales, ¿qué otra propiedad permiteclasificar una sustancia como ácido, base o neutra? 2. ¿Qué es el pH y cómo se puede determinar el de una sustancia cualquiera? 3. Si una sustancia es ácida, neutra o básica según la relación deconcentración entre [H +] y [OH–], ¿qué relación existe entre estasconcentraciones y el pH? 4. Sabiendo que el ácido clorhídrico, el hidróxido de sodio y el aguadestilada corresponden a una sustancia ácida, básica y neutra,respectivamente, ¿cuál es la finalidad de su uso en este experimento? 5. ¿Qué es un indicador ácido–base? Investiguen. 6. ¿Qué relación tendrá la presencia del repollo morado con la clasificaciónde sustancias ácidas o básicas? Investiguen. 7. Investiguen, ¿qué es la escala de pH? Paso 3: Formulación de hipótesis Considerando las preguntas de investigación así como el objetivoplanteado, elaboren las hipótesis de investigación. Paso 4: Registro de observaciones Recuerden registrar todas las observaciones experimentales, como colores,apariencia, temperatura, entre otros. Paso 5: Recopilación y ordenamiento de datos Los datos deberán ser tabulados en la tabla que se presenta más abajo, dentro de cuales deberá elegir 5 sustancias que tenga a su alrededor. Paso 6: Análisis de datos De acuerdo a las investigaciones realizadas para elaborar el procedimientoexperimental, respondan: 1. ¿Cuál es la finalidad de una sustancia indicador? 2. ¿Cuáles son los colores de cambio del repollo morado para reconocercada tipo de sustancia? 3. ¿Cuál es la diferencia entre los indicadores ácido-base y el papel ocinta pH? ¿Cuál les parece más efectiva? Justifiquen su respuesta. 4. Considerando la relación de [H+] y el pH, ¿qué pueden decir de laconcentración de iones de hidrógeno en las siguientes sustancias? a. HCl b. NaOH c. H2O d. Vinagre e. Champú f. Bicarbonato de sodio 5. ¿Se aceptan o rechazan sus hipótesis? Paso 7: Realización de Informe, considerar conclusión y comunicación de resultados Elaboren un informe científico, considerando las recomendaciones de laprimera unidad, en el que se establezcan las bases teóricas y experimentales del trabajo desarrollado. En la elaboración de las conclusiones, consideren la importancia del pH y su relación con la concentración de hidrógeno, así como la aplicación de este concepto a su vida cotidiana. El informe debe traer: Portada indicando: Integrantes, Fecha, Nombre de la Profesora, Asignatura, Insignia y Nombre del establecimiento. Índice. Introducción. Marco Teórico. Procedimientos. Desarrollo de las actividades. Imágenes. Anexos. Tabulación de datos: Indique los valores de pH obtenidos determine pH, pOH, [H+] y [OH–] según corresponda: Sustancia de prueba o patrones Sustancia de prueba o patrones Sustancias Analizar Sustancia pH Indicador Natural (Repollo Morado) Cinta pH HCl NaOH H2O Agua potable Vinagre Shampoo Bicarbonato de Sodio Café Té Jugo de Limón Aceite Alcohol Saliva pOH [H+] [OH–] HCl NaOH Agua Potable Vinagre Shampoo Bicarbonato de Sodio Café Té Jugo de Limón Aceite Alcohol Saliva Actividad n°2: Indicadores ácido base Procedimiento: • Coloca el fruto que ocuparás en un recipiente de plástico y aplástalos con el tenedor hasta que tenga consistencia de mermelada y agrega al recipiente una taza y media de agua tibia. • Introduce las tiras de cartulina en el jugo de fruta, hasta que queden bien impregnadas del color. Retíralas del recipiente y saca los restos de pulpa que hayan quedado en las tiras. • Déjalas secar sobre el papel absorbente. Una vez secas, las ocuparas paraintroducirlas en diferentes sustancias. Responde: 1. ¿Cuál es la utilidad e importancia de haber fabricado este tipo depapel? Investiga que es el papel indicador. 2. ¿Qué sucede si introduces tiras de papel en las siguientes sustancias:vinagre, lavaloza, jugo de limón y solución de detergente para ropa? Elige otras sustancias que tengas a tu alrededor, realiza una tabla como la que se adjunta en la actividad anterior. Clasificando color y pH. 3. ¿Cómo podrías explicar los cambios de color en el papel indicador? 4. Según tus investigaciones, ¿Qué coloración indica un ácido y quecoloración una base? 5. Uno de los indicadores naturales más antiguos, es el pigmento vegetal conocido como tornasol. En los laboratorios se utiliza frecuentemente, un papel impregnado con tornasol. Con respecto a lo anterior: 6. Investiga que es el papel tornasol y que color adquiere disoluciones ácidasy básicas. 7. ¿Qué otros indicadores naturales existen? Investiga y nombra tres ejemplos.