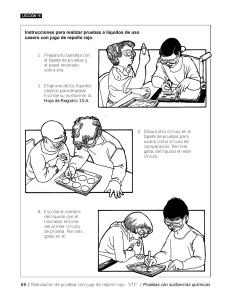
QUÍMICA Aquí va la fotografía de las
Anuncio

IED Liceo Femenino Mercedes Nariño QUÍMICA Informe de laboratorio No.1 pH Aquí va la fotografía de las integrantes del grupo. (Con bata de laboratorio.) CURSO 707 Integrantes: KKKKK KKKKKKKKKKK KKKKKKKKKK LLLLLLLLLL LLLLLLLLLLL LLLLLLLLLL ÑñÑÑ ÑÑÑ ÑÑÑÑÑÑÑÑ OOOOOOOOO OOO OOOOOOOO Iiiiiiiiii iiiiiiiiiii iiiiiiiii Profesor Ramiro González Gómez Marzo x de 2015 1 LABORATORIO No.1 POTENCIAL DE HIDRÓGENO pH ****LLEVE AL LABORATORIO LOS MATERIALES Y SUSTANCIAS ESCRITAS EN VERDE 1. OBJETIVOS a. Determinar el pH de varias sustancias por métodos colorimétricos. b. Diferenciar experimentalmente los ácidos, las bases y las sales. 2. MARCO TEÓRICO Busque en libros e internet información acerca del pH. El contenido investigado debe aprenderlo. MATERIALES *12 vasos desechables transparentes *1 cuchara plástica para revolver *12 tiras de papel (3cmx1cm) impregnados con agua de repollo (después de preparar el agua de repollo morado, moje tiritas de servilleta cortadas al tamaño de media curita, mójelas en esa agua y déjelas secar. Llévelas seas al laboratorio¡ *Cinta de enmascarar *Cámara fotográfica 3. 4. SUSTANCIAS Agua de repollo (cocine un repollo morado, cuele y traiga el agua de repollo en una botella) 20 ml cada uno en un frasco de las siguientes sustancias: leche de magnesia, jugo de limón, agua jabonosa, vinagre, champú, amoníaco (de las tinturas para el cabello), leche de vaca, alcohol, agua con detergente disuelto, 5. EXPERIENCIA DIAGRMAS Y FOTOGRAFÍAS Primera parte: a. Ordene en fila los vasos desechables. Rotule con la cinta de enmascarar. b. Vierta parte del contenido del agua de repollo en la probeta. c. Saque con una pipeta 20ml de agua de repollo en cada vaso. d. Elija el vaso del centro y rotule como blanco pH=7 e. Vierta en el primero de la izquierda jugo de limón y en el de la derecha leche de magnesia. f. Vierta separadamente cada una de las sustancias a cada uno de los vasos restantes. g. Clasifique las sustancias por color en degradé. h. Moje en cada una de las sustancias, los papelitos de servilleta previamente preparados. Deje secar y péguelos a su informe de laboratorio. Segunda parte: Elija un vaso de la izquierda y otro de la derecha y mezcle los contenidos hasta virar el color a 7. Estarán formándose las sales, resultantes de hacer reaccionar los ácidos con las bases. Describa sus observaciones paso a paso numerando e ilustrando con fotografías. Cada fotografía debe tener un comentario en su informe de laboratorio. 6. TABLA DE RESULTADOS Registre aquí una tabla en al cual aparezcan en una columna la lista de las sustancias y en la de enfrente la acidez de estas. Utilice las palabras: ácido, alcalino, neutro. 2 7. ANÁLISIS DE LECTURA (Lea el texto colocado al final de esta guía. No transcriba, lea, analice y escriba la idea con sus palabras cuidando el léxico) a. Qué es el pH? b. Relacione el pH y la reproducción sexual caries dental estómago e intestino delgado. Sacrificio veterinario de animales domésticos 8. CONCLUSIONES Escriba aquí una lista numerada de las cosa que Ud ahora sabe pero que ignoraba antes de realizar el presente laboratorio. Ejemplo: *El agua de repollo morado es un indicador de color que da información del pH de una sustancia. (Fíjese que es una afirmación de algo que Uds no sabían antes de la práctica). 9. BIBLIOGRAFÍA Título del libro, autor, editorial, fecha de impresión. Páginas consultadas. Consulten los 2 libros que aparecen en la página web: liceoquimica-rgg.jimdo.com. 10. CIBERGRAFÍA Direcciones web ATENCIÓN. En rojo lo que debe hacer y en verde lo que deben traer. Grupos de 5 o 6 estudiantes por informe. Se hará previa oral. NO OLVIDEN: *Las páginas van numeradas *Las fotografías deben ser todas iguales. *Cada fotografía debe tener una leyenda *El informe de laboratorio deberá hacerse en computador. *Sean meticulosamente ordenadas. *Sigan las instrucciones dadas en rojo. 3 LECTURA El pH es la medida de la concentración de los iones hidronio H+ de una sustancia. Su valor se obtiene de la relación matemática del logaritmo negativo de la concentración molar (moles de la sustancia por litro de solución en la cual está contenida) de iones hidrógeno. –log [H+]. La gran mayoría de los procesos químicos en los organismos vivos tienen que ver con esta medida, así el estómago tiene HCl lo que lo hace ácido mientras la ese duodenal (primera parte del intestino delgado unida al estómago por la válvula píloro),es alcalina. A sabiendas de eso los químicos farmaceutas saben que la aspirina (ácido acetil salicílico), utilizadas para aliviar el dolor, añaden efecto ácido al estómago causándole irritaciones que van de las molestias a la gastritis y a las úlceras. Por eso desarrollaron el acetaminofén que es una sustancia alcalina que no eleva la acidez estomacal. De manera que se concluye que la ingesta de ácidos a un órgano ácido como el estómago puede causarle molestias severas. Se preguntaría uno, de qué manera se puede ingerir entonces la aspirina?, pues bien el problema se ha solucionado recubriendo las pastillas con una capa dulce evitando el contacto directa de la aspirina con la mucosa gástrica. Siguiendo la temática voy a referirme a la reproducción de sexual de los mamíferos la cual tiene sus pH, veamos, los espermatozoides están contenidos en el líquido seminal de carácter alcalino y el utero de membrana mucosa igualmente alcalina. En el momento de la reproducción los espermatozoides vitales en su medio buscarán el ovulo alojado en el último tercio de una de las trompas de Falopio, en donde aguarda un ovulo en medio alcalino y entonces al unirse formaran el zigoto o huevo fecundado. Si el pH se altera en alguno de los dos medios la célula o células contenidas morirán indefectiblemente, lo que se ha aprovechado como forma de planificación familiar en los humanos, al usarse sustancias ácidas en condones o medios intravaginales tales como espumas. De otra parte el análisis del pH nos lleva a las enfermedades que pueden causarse por la alteración de este. Por ejemplo, las caries dentales se producen como todos sabemos entre otros por un deficiente cepillado de las piezas dentales. Pero qué pasa en el esmalte dental? Pues los residuos de alimentos se vuelven caldos de cultivo para la acomodación y reproducción de bacterias cuyos residuos metabólicos son ácidos. Estos ácidos corroen el esmalte dental dejando a su paso el cemento dental expuesto y sin la consabida protección. Finalmente nos referiremos al pH como medio en el cual se realizan las reacciones bioquímicas. Una alteración del pH conduce a impedir estos metabolismos y causar anomalías. Se sabe por ejemplo que la sangre de los mamíferos tiene un pH de aproximadamente 7, lo que la hace neutra. Las reacciones bioquímicas que se dan en el seno de este fluido así como el mantenimiento de las sustancias contenidas en estado de actividad, dan facilidades metabólicas es decir de realizar adecuadamente y sin impedimentos las reacciones químicas e intercambios iónicos y de otras sustancias contenidas en los nutrientes o desechos. La ciencia veterinaria utiliza esta propiedad del pH para sacrificar las mascotas cuando las necesidades lo ameritan. Se inyecta una sustancia de pH ácido o alcalino en cantidad suficiente como para alterar el volumen sanguíneo, causando la gelatinización de la sangre y como consecuencia se impide la facultad de fluir, dando como resultado la muerte del animal en cuestión. 4