Revisión de las Ideas Principales de la Unidad “materia y... La química estudia la composición, estructura y el comportamiento de... Las observaciones macroscópicas de la ...
Anuncio

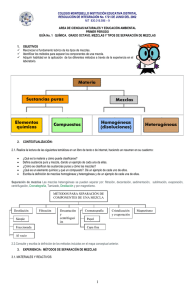
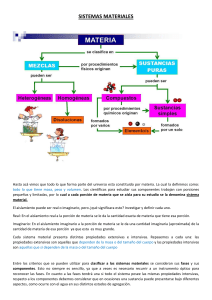
Revisión de las Ideas Principales de la Unidad “materia y energía” La química estudia la composición, estructura y el comportamiento de la materia. Las observaciones macroscópicas submicroscópica. de la materia reflejan su estructura La cantidad de materia que contiene una muestra se puede medir al determinar sus masa. A las descripciones de la materia y su comportamiento se les llaman propiedades. Las cuales pueden ser: Generales y Específicas. Las propiedades generales se llaman así porque toda la materia lo posee, ejemplos: masa, peso, inercia, volumen. Mientras que las propiedades específicas nos sirven para identificar una materia de otra, por ejemplo: color, sabor, textura, tamaño, estado de agregación, etc. La composición de una muestra de materia determina si ésta es una sustancia o una mezcla. Las mezclas pueden ser homogéneas (soluciones) si se observan las mismas propiedades en toda su extensión, es decir, se observa uniformidad y no se distinguen sus componentes; ejemplos: aire, refresco, agua de mar, oro comercial, plata comercial, concreto, aleación (mezcla de metales), medicamentos, etc. Las mezclas heterogéneas son aquellas en las cuales se distinguen sus componentes. Las mezclas se pueden separar por medio de cambios físicos que utilizan propiedades físicas de las sustancias individuales de las mezclas. Las sustancias se clasifican en elementos y compuestos. Los elementos son sustancias puras que ya no pueden descomponerse en otras más simples o sencillas por métodos químicos ordinarios. Los compuestos están formados por las combinaciones o uniones de dos o más elementos químicos. Los elementos son los bloques de construcción de toda la materia. La composición de un compuesto está representada pos su fórmula química. Propiedades y cambios de la materia Cada sustancia tiene un conjunto de propiedades físicas y químicas particulares. Los estados de agregación de la materia son sólido, líquido y gaseoso. El estado de una sustancia, a temperatura ambiente, es una propiedad física. Las temperaturas a las cuales cambia el estado de una sustancia son propiedades físicas de la sustancia. Por ejemplo: La temperatura de fusión es aquella en la cual un sólido pasa al estado líquido. La temperatura de condensación o licuefacción es aquella temperatura en la cual un gas pasa al estado líquido. La densidad de una muestra de materia es la cantidad de materia (masa en gramos) por unidad de volumen, normalmente medida en mililitros (ml). Por ejemplos: la densidad del agua es 1.0gr/ml, el aluminio de 2.70 gr/ml, el plomo es de 11.34 gr/ml y la del oro es de 19.31 gr/ml, es decir de todas estas cuatro sustancias el oro es el más pesado. Las propiedades químicas de una sustancia describen los cambios químicos que experimenta las mismas, en donde se altera la naturaleza interna de las sustancias, es decir, se transforman en nuevas sustancias. Los cambios químicos implican que los átomos de las sustancias se reacomodan para formar otras sustancias. Una reacción química es otro nombre que se le da a un cambio químico. En una reacción química, los átomos nunca se crean o se destruyen. TRABAJO DE INVESTIGACIÓN PARA ENTREGAR Comprensión de conceptos. 1. Menciona dos diferencias entre una mezcla y una sustancia pura. 2. ¿Por qué un compuesto es distinto de una mezcla? Razonamiento crítico. 3. El elemento oxígeno es un gas que constituye cerca del 20% de la atmósfera de la tierra. También es el elemento más abundante de la corteza terrestre, y sin embargo, ésta no es un gas. Explica esta aparente contradicción. 4. Aplicaciones de la química. Materiales de todos los días. La materia se puede subdividir en elementos, compuestos y mezclas homogéneas y heterogéneas. Describe un material que se halle en la alacena de tu casa que corresponda a cada una de estas categorías. Comprensión de conceptos: 5. Para cada uno de los siguientes incisos, señala cuál es una propiedad física y cuál es una propiedad química de la sustancia. a. El oro se puede laminar con gran facilidad. b. El sulfato de cobre se disuelve en el agua. c. El magnesio arde en el aire. d. El bióxido de manganeso es un polvo gris. e. El flúor es un elemento muy reactivo- 6. Diferencia entre cada uno de los cambios entre químicos y físicos: a. Un cerillo se enciende cuando se raspa. b. El aire se presiona con una bomba para forzarlo a entrar a la llanta de un auto. c. Cuando el polvo de hornear se humedece, burbujea y libera CO 2. d. Un tazón de agua hierve en la estufa. e. La formación del arco iris. f. Una fruta se fermenta y produce alcohol. g. Una termita que come madera y produce gas metano. h. El vinagre y el aceite no se mezclan. i. La densidad del agua se incrementa cuando se le añade sal. Razonamiento crítico: 7. Aplica los conceptos. Un amigo te cuenta que un diario desapareció al quemarse en un incendio. Utiliza la ley de la conservación de la masa para escribirle a tu amigo y explicarle lo que en realidad le sucedió al periódico. Aplicaciones de la química 8. Fogatas. En las noches heladas, una fogata calienta el cuerpo y el espíritu. ¿la combustión de los leños es una reacción endotérmica o exotérmica? Comprensión de conceptos 9. Escribe los símbolos de los siguientes elementos: hierro, sodio, antimonio y tungsteno. Explica por qué estos símbolos no corresponden a los nombres de los elementos en español. 10. ¿Dos objetos con el mismo volumen podrían tener distintas masas? ¿Cuál de los dos tendría más materia? 11. ¿Qué significa materia pura? 12. ¿Qué papel juega la energía en la química? 13. Haz una distinción entre reacción endotérmica y reacción exotérmica y da un ejemplo de cada una. 14. ¿Qué significa densidad? ¿Habría alguna manera de que una bolsa de pelotas de esponja de estireno (el que se usa como aislante para techos y paredes) fuera más pesada que una bolsa de piedras? 15. El oro se congela a 1064°C. ¿Cuál es el punto de fusión del oro? Aplicación de conceptos 16. El proceso completo de digestión de la comida en tu cuerpo, ¿es un proceso endotérmico o exotérmico? Explica tu respuesta. 17. Un cubo de hielo flota en tu vaso de agua, igual que un iceberg flota en el océano. ¿Qué conclusión puedes sacar acerca de la densidad del agua líquida y la del agua sólida? 18. Un medicamento con un nombre comercial muy conocido también lo puede fabricar otra compañía y venderlo a precio más bajo. En ambos medicamentos se especifica que tiene la misma fórmula química y los dos son aprobados por la secretaría de salud. ¿Será mejor usar el medicamento de la marca conocida? Explica tu respuesta. 19. Una perilla de una puerta está recubierta con una aleación de latón. ¿Qué es una aleación? Cita tres ejemplos de ellas y de qué están compuestos. 20. Cuando mezclas vinagre y bicarbonato de sodio, la mezcla hace espuma y burbujea. Suponiendo que pesas el vinagre y el bicarbonato antes de mezclar y después de que han reaccionado, ¿cómo se comparan las masas? Explica tu respuesta. 21. Cuando se advierte que el jugo de naranja está puro, ¿quiere decir que el jugo es una sustancia pura? Explica tu respuesta.