TÍTULO: MUJER DE 45 AÑOS ... ABDOMINAL. AUTORES: Juan Carlos Gavilán Carrasco. Servicio ...
Anuncio

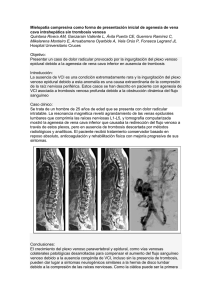
TÍTULO: MUJER DE 45 AÑOS CON TROMBOSIS VENOSA PROFUNDA Y MASA ABDOMINAL. AUTORES: Francisco Navarro Romero, José Ramírez Bollero, Radka Ivanova Georgieva, Juan Carlos Gavilán Carrasco. Servicio de Medicina Interna. Hospital Clínico-Universitario Virgen de la Victoria. Málaga. INTRODUCCIÓN La enfermedad tromboembólica venosa (ETV) es una entidad que comprende la trombosis venosa profunda (TVP) y su complicación más grave, el tromboembolismo pulmonar (TEP). En un estudio epidemiológico realizado recientemente en España, se ha considerado una tasa de ETV de 154 casos/100000 habitantes/año.1,2 El tromboembolismo venoso es una complicación frecuente en los pacientes con cáncer, conocido desde hace más de 140 años, concretamente en 1865 cuando Trosseau describió la existencia de trombosis venosa como un síndrome paraneoplásico.3 Un estudio de casos y controles, realizado en el año 2000 por Heit y colaboradores, demostró que las enfermedades neoplásicas constituían la cuarta causa de enfermedad tromboembólica, tras la cirugía, el traumatismo y la inmovilización.4 Se presenta el siguiente caso por la importancia clínica que tiene la ETV relacionada con el cáncer, puesto que el manejo diagnóstico y terapéutico tiene algunas peculiaridades que deben conocerse y que pueden suponer algunas dudas de actuación en nuestra práctica clínica habitual. CASO CLÍNICO Mujer de 45 años, con antecedentes personales de retraso psicomotor connatal, sin factores de riesgo cardiovascular ni otros antecedentes médicos ni quirúrgicos de interés. Sin tratamiento previo. Fue remitida al Servicio de Urgencias por su Médico de Atención Primaria ante la presencia de dolor y tumefacción en el miembro inferior izquierdo de dos semanas de evolución. La paciente refería además molestias abdominales inespecíficas, difusas, con buena tolerancia a la dieta y sin alteraciones del hábito intestinal. A la exploración física presentaba una tensión arterial de 110/75 mmHg, frecuencia cardiaca de 76 lpm, sin fiebre. El estado general era conservado, con buen nivel de consciencia, obesidad grado 1. Auscultación cardiorrespiratoria rítmica, sin soplos, con buena ventilación bilateral. Abdomen con distensión, molestias difusas a la palpación y sensación de masa intraabdominal de gran tamaño. No signos de peritonismo. El miembro inferior izquierdo presentaba tumefacción y aumento del perímetro desde raíz del muslo, con aumento de la temperatura local y empastamiento de la masa muscular gemelar. La analítica de urgencias mostró la serie blanca y plaquetas normales, Hb 10,1 g/dL. Coagulación normal. Glucosa 93 mg/dL, creatinina 0,9 mg/dL, iones y enzimas de función hepática normales. La ecografía-doppler del miembro inferior izquierdo objetivó signos de trombosis a nivel del sistema femoral superficial y profundo de todo el miembro inferior izquierdo, así como edema de pared desde muslo. Se realizó una ecografía de abdomen en urgencias, que mostró la existencia de una gran masa que ocupa la totalidad de la cavidad abdominal, heterogénea, con gran componente quístico y otro multiloculado con áreas sólidas, con extensión desde la pelvis hacia el epigastrio y ambos flancos, ocupando toda la región centroabdominal. Mediante la ecografía no fue posible determinar la organodependencia de la masa ni visualizar ninguna de las estructuras intraabdominales ni pélvicas. Con este estudio realizado en urgencias, y diagnósticos de masa intraabdominal a estudio y trombosis venosa profunda del miembro inferior izquierdo, ingresa en planta de hospitalización de Medicina Interna. Se inició tratamiento anticoagulante con heparina de bajo peso molecular (HBPM) a dosis terapéutica y tratamiento postural de la extremidad afectada. En la analítica solicitada posteriormente para ampliar el estudio, destacaba una elevación de los marcadores tumorales CA125 y CA19,9, sin encontrarse alteraciones en la bioquímica. Se continuó el estudio mediante TC abdómino-pélvico con contraste intravenoso, con hallazgos de: gran masa quística intraperitoneal (figura 1) de diámetros aproximados 13 x 30 x 25 cm, con gran polo sólido (realce heterogéneo) en su pared anterior de 9 x 12 x 16 cm, que sugieren lesión anexial sólido-quística como primera posibilidad. El hígado tenía un tamaño normal y no presentaba lesiones ocupantes de espacio. En el resto de los órganos abdominales no se observaron alteraciones, ni habían adenopatías retroperitoneales ni en espacios pélvicos, ni existía líquido libre intraperitoneal. Ante la presencia de la gran masa intraabdominal en los estudios realizados, que parece depender de anexos pélvicos, la paciente es valorada por Ginecología, y se decide realizar la intervención quirúrgica para la exéresis de la masa. Previamente a la intervención se decide colocar un filtro en la vena cava inferior como prevención del tromboembolismo pulmonar, dado que existe riesgo de hemorragia durante la intervención quirúrgica y por ello va a suspenderse el tratamiento anticoagulante. Se realizó el estudio flebográfico de la vena cava inferior y superior, observándose compresión de la cava inferior con gran disminución de su luz, extendiéndose ésta compresión hasta por encima de las venas renales. La cava suprarrenal e intrahepática era permeable. Se posiciona el filtro de vena cava temporal tipo Recover (Bard) a nivel de la vena cava suprarrenal. Es intervenida con resección de toda la tumoración intraabdominal y de los anejos pélvicos. El tumor presentaba un tamaño de 31 x 25 x 16 cm y pesaba 4720 g. El estudio anatomopatológico de la masa intraabdominal dio el diagnóstico de cistoadenocarcinoma mucinoso de bajo grado de origen ovárico. A los tres días de la intervención quirúrgica la paciente sufre hematoma de pared abdominal relacionada con la herida quirúrgica, que precisó drenaje mediante cirugía. Tras la desaparición del riesgo hemorrágico se ha reiniciado tratamiento con HBPM. Está en seguimiento por el Servicio de Oncología y pendiente de posterior retirada del filtro de vena cava. DISCUSIÓN Las alteraciones trombóticas de los pacientes con cáncer incluyen trombosis arterial, trombosis venosa, tromboflebitis migratoria, endocarditis trombótica no bacteriana y síndromes sistémicos, como la microangiopatía trombótica y la coagulación intravascular diseminada. La más frecuente de todas las citadas es la enfermedad tromboembólica venosa, que incluye tanto la trombosis venosa profunda como el tromboembolismo pulmonar, y que representa una importante entidad clínica por su elevada frecuencia, morbimortalidad en la fase aguda y secuelas a largo plazo. La mortalidad de ETV es 8 veces mayor en pacientes oncológicos frente a no oncológicos. Además, la ETV en pacientes con cáncer se asocia con mayor frecuencia de recurrencias y de complicaciones hemorrágicas.5 Los pacientes con cáncer presentan un estado de hipercoagulabilidad debido a las propiedades procoagulantes de las células malignas, por lo que basalmente tienen una predisposición mayor a la ETV. Pero además se han descrito una serie de factores de riesgo relacionados con mayor incidencia de ETV en estos pacientes (tabla 1), como el tipo de cáncer, la enfermedad metástasica, la presencia de trombocitosis previa al tratamiento con quimioterapia, intervenciones terapéuticas como colocación de catéter central, el tratamiento quimioterápico, situaciones de hospitalización… Son casos en los que el riesgo de ETV es mayor.5 También es importante señalar que la ETV puede ser la primera manifestación de una neoplasia previamente no identificada. Su frecuencia es mayor en pacientes que presentan ETV idiopática, estadios tempranos del cáncer, ETV recurrente, bilateral, en extremidades superiores, y con niveles elevados de dímero D o anemia.6 Actualmente no existen protocolos de actuación que orienten el estudio del paciente con ETV idiopática hacia la búsqueda de una posible neoplasia oculta. Por ello la ESMO recomienda, mientras no existan datos que demuestren una mayor supervivencia con la utilización de pruebas diagnósticas y seguimiento intensivos, realizar el estudio de estos pacientes con la historia clínica y exploración física, estudio analítico básico, pruebas de sangre oculta en heces, radiología de tórax, revisión urológica en hombres y ginecológica en mujeres. Se recomienda hacer una búsqueda más exhaustiva, con pruebas como la tomografía computerizada, endoscopia digestiva, marcadores tumorales… en los casos con alta sospecha clínica fundamentada.7 El tratamiento inicial de la ETV no difiere del paciente no oncológico, y su objetivo incluye la estabilización médica del paciente, el alivio de los síntomas, la resolución de la obstrucción vascular y la prevención de las complicaciones y las recurrencias. La 9ª Conferencia de Concenso de la ACCP sobre el tratamiento antitrombótico recomienda para pacientes con ETV con cáncer el tratamiento con HBPM subcutánea, heparina no fraccionada intravenosa o subcutánea monitorizada, o Fondaparinux subcutánea.8 En la mayoría de los casos, estos objetivos se alcanzan con el tratamiento anticoagulante convencional. Pero una minoría de pacientes van a requerir otros tipos de tratamiento, como el trombolítico o medidas mecánicas como la colocación del filtro de vena cava.5 En nuestro caso, la paciente recibió tratamiento para la TVP con HBPM subcutánea a dosis terapéutica, tal y como establecen las guías de actuación actuales. Ante la necesidad de realizar la intervención quirúrgica para extirpar la gran masa intraabdominal, fue necesaria la suspensión temporal del tratamiento con HBPM por el riesgo de hemorragia mayor. En estos casos, y puesto que la paciente presentaba una TVP proximal y el riesgo de TEP era alto, se indica la colocación de un filtro de vena cava temporal. Los filtros de vena cava están recomendados en pacientes con TEP o TVP proximal y contraindicación para la anticoagulación, y en los pacientes con TEP recurrente a pesar de un correcto tratamiento anticoagulante.7,8 Existen, además, otras situaciones en las que su empleo es más controvertido, una de éstas es la ETV con riesgo elevado de sangrado, en los que se puede recomendar la colocación del filtro de vena cava hasta que desaparezca este riesgo. Existen dos tipos de filtros de vena cava, permanentes y temporales. Hay estudios en los que se sugiere que la colocación de filtro de vena cava añadido al tratamiento anticoagulante reduce el riesgo de TEP, pero sin embargo aumenta la incidencia de TVP.9 En una revisión de la Biblioteca Cochrane los filtros permanentes de vena cava se asociaron con mayor incidencia de TVP a largo plazo.10 Los filtros recuperables tienen ventajas potenciales sobre los filtros permanentes; la primera es la posibilidad de retirarlos si ya no son necesarios, y por lo tanto evitar las secuelas de TVP a largo plazo. Se necesitan estudios que comparen los dos tipos de filtros. Se recomienda iniciar la anticoagulación en los pacientes portadores de filtro de vena cava una vez desaparezca el riesgo hemorrágico. BIBLIOGRAFÍA 1. Gil S. Importancia clínica de la enfermedad tromboembólica en el paciente médico. En: Méndez M, Díez JM, editores. La enfermedad tromboembólica venosa (ETV) en el paciente médico. Madrid: Think-In Pharma Services, S.L.; 2011. p. 58-73. 2. Guijarro RG, Montes J, San Roman CM. Epidemiología hospitalaria de la enfermedad tromboembólica venosa en España. Med Clin (Barc) 2008;131:2-9. 3. Sorensen HT, Mellemkjaer L, Olsen JH, Baron JA. Prognosis of Cancers Associated with Venous Thromboembolism. N Engl J Med 2000;343:1846-50. 4. Heit JA, Silverstein MD, Mohr DN, Petterson TM, O’Fallon WN, Molton JM. Risk factors for deep vein thrombosis and pulmonary embolisms. Arch Intern Med 2000;160:809-15. 5. Pérez G, Rodríguez AM, Ballesteros M, Infante ME, Iñigo B. Enfermedad tromboembólica en el paciente oncológico. En: Méndez M, Díez JM, editores. La enfermedad tromboembólica venosa (ETV) en el paciente médico. Madrid: Think-In Pharma Services, S.L.; 2011. p. 140-71. 6. Trujillo-Santos J, Prandoni P, Rivron-Guillot K, Roman P, Sánchez R, Tiberio G, et al, the RIETE Investigators. Clinical outcome in patients with venous thromboembolism and hidden cáncer: findings from the RIETE Registry. J Thromb Haemost 2008;6:2515. 7. Mandalà M, Falanga A, Roila F; ESMO Guidelines Working Group. Management of venous thromboembolism in cancer patients: ESMO clinical recommendations. Ann Oncol 2008;19:ii126-7. 8. Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ, et al. Antithrombotic therapy for VTE disease: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (9th edition). Chest 2012;141:419S-94 S. 9. PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prevention du Risque d’Embolie Pulmonaire par Interruption Cave) randomized study. Circulation 2005;112:416. 10. Young T, Tang H, Aukes J, Hughes R. Filtros en la vena cava para la prevención de la embolia pulmonar (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.updatesoftware.com. FIGURAS: FACTORES DE RIESGO SITUACIÓN RIESGO ETV 1. Dependientes del paciente: Raza afroamericana. Obesidad. Trombofilias. Historia previa de ETV. Comorbilidades: enfermedad pulmonar o renal, insuficiencia cardiaca, tromboembolismo arterial, infección. 2. Dependientes de la enfermedad de base: Población general 1/1000 personas año Población oncológica / no oncológica x 4-6; 1/200 Población oncológica + factor V Leiden / población no oncológica + factor V Leiden x 12 Población oncológica portadora de catéter central Población oncológica ambulante con quimioterapia Población oncológica ambulante con manipulación hormonal Población oncológica con inhibidores de la angiogénesis: (1) talidomida en combinación, (2) lenalidomida en combinación, (3) bevacizumab. Población oncológica con eritropoyetina o darbopoyetina Población oncológica hospitalizada / hospitalizada no oncológica Población con cirugía oncológica / cirugía no oncológica 4/100 Tipo de cáncer. Enfermedad extensa o metastásica. Fase inicial: primeros 3-6 meses. Trombocitosis previa a quimioterapia. 3. Dependientes de intervenciones terapéuticas: Catéter central. Tratamiento quimioterápico: tratamiento con agentes antiangiogénicos, tratamiento hormonal, agentes estimulantes de la eritropoyesis. Situaciones de hospitalización o cirugía. x 6,5 x 2,5 (1) 15/100 (2) 8-75/100 (3) X 1,3; 6,3-11,9/100 Aumenta 67% riesgo de ETV x 2; 5,4% x 2 ETV, x 3 TEP Mayor fracaso de tromboprofilaxis Tabla 1: Riesgo de enfermedad tromboembólica (ETV) en pacientes oncológicos.