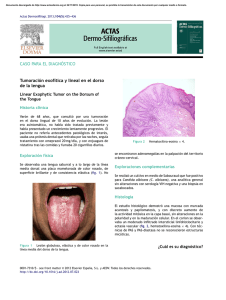
Los hongos constituyen un conjunto de seres vivos que incluye... hasta organismo pluricelulares macroscópicos. Están formados por células eucariotas... OBSERVACION Y CULTIVO DE HONGOS LEVADURIFORMES
Anuncio

Universidad Mariano Gálvez Facultad de Ciencias Médicas y de la Salud Carrera de Médico y Cirujano OBSERVACION Y CULTIVO DE HONGOS LEVADURIFORMES PRACTICA 9 1. Introducción Los hongos constituyen un conjunto de seres vivos que incluye desde organismos unicelulares hasta organismo pluricelulares macroscópicos. Están formados por células eucariotas con una pared rígida, y se caracterizan por ser inmóviles, presentar nutrición heterótrofa por absorción y reproducción sexual y asexual. Los hongos unicelulares son microscópicos, poseen forma redondeada y se denominan levaduras. La mayoría de los hongos poseen un papel importante en la naturaleza, en la que se hallan ampliamente distribuidos, degradando y reciclando materia orgánica muerta. Algunos hongos microscópicos pueden causar diversas enfermedades denominadas micosis; sin embargo, son escasas las especies adaptadas estrictamente al hombre y la mayoría de las que producen enfermedad tienen su reservorio natural en el medio ambiente. En general las células micóticas se observan bien por microscopia convencional, aunque pueden requerir tinciones especiales para facilitar su visualización. Crecen fácilmente en los medios de cultivo convencionales dando lugar a colonias visibles macrocópicamente, con morfología bien diferenciada según estén formadas por levaduras y hongos filamentosos. Candida albicans es la levadura más frecuente en Guatemala y se caracteriza porque crece en agar sangre y agar nutritivo de forma similar a bacterias pero también en agar Sabouraud. 2. Objetivos Que el estudiante: 1. Explique la importancia de la realización de un adecuado diagnostico. 2. Diferencie levaduras de bacterias, en medios de cultivo utilizados en análisis de rutina. 3. Identifique la especie Candida albicans. 3. Alcance En esta práctica el estudiante diferenciara macroscóica y microscópicamente bacterias y hongos levaduriformes e identificar a Candida albicans. 4. Antecedentes Entre los hongos levaduriformes los géneros más importantes en patología son Candida albicans y Cryptococcus, ambos de distribución universal. Las infecciones por Candida son, junto con las causadas por dermatofitos, las infecciones fúngicas más frecuentes en nuestro medio y prácticamente las únicas que se producen en personas sanas. El género Candida está formado por diversas especies (C. albicans, C. tropicales, C. krusei, C.parapsilosis, C. guillermondi y otras) que se hayan ampliamente distribuidas como saprofitas en la naturaleza, y como comensales en la piel, tubo digestivo y vagina. Presentan una forma Pag. 1/5 Universidad Mariano Gálvez Facultad de Ciencias Médicas y de la Salud Carrera de Médico y Cirujano ligeramente ovalada y un tamaño de 5 a 7 micrómetros, claramente observables con tinción de gram. Las especies de Candida crecen bien en medios bacteriológicos usuales y en el medio de Sabouraud. Entre las 48-72 horas dan lugar a colonias macroscópicamente visibles. La especie C. albicans se identifica por su capacidad para producir tubos germinales en poco tiempo al inocularla en suero sanguíneo. Las diversas especies de Candida pueden producir infecciones por un factor predisponerte o general, por lo que puede considerarse a Candida como un genero oportunista. Los procesos localizados afectan a las mucosas oral y vaginal, piel en las zonas húmedas y de roce, vía urinaria en pacientes con sondas y tratados con antibacterianos. Es muy característica la candidiasis esofágica en los enfermos con síndrome de inmunodeficiencia adquirida (SIDA). Durante muchos años, la especie más frecuente ha sido C. albicans, sin embargo debido al creciente número de pacientes inmunodeprimidos, se ha identificado muchas especies más como agentes etiológicos de diversas infecciones. 5. Materiales y equipo 1. Microscopio óptico 2. Porta objetos limpio y desgrasado 3. Cubre objetos limpios 4. Marcador indeleble para vidrio 5. Varillas de vidrio para coloración 6. Colorantes para gram 7. Cajas de Staphylococcus sp. y Candida sp. identificados únicamente con números. 8. Cajas de agar sangre, agar nutritivo y agar sabouraud. 9. Tubos con 1.0 ml de suero sanguíneo 10. Papel limpia lentes 11. Lentes de protección 12. Pizeta con alcohol al 70% 13. Pizeta con cloro al 5% 14. Pizeta con agua destilada 15. Gotero con solución de cristal violeta 16. Gotero con solución de lugol 17. Gotero con solución de alcohol-acetona 18. Gotero con solución de safranina 19. Gotero con aceite de inmersión 20. Guantes de latex 21. Papel mayordomo 22. Torundas de algodón (1/A) 23. Beackers con cloro Pag. 2/5 Universidad Mariano Gálvez Facultad de Ciencias Médicas y de la Salud Carrera de Médico y Cirujano 24. Asas en argolla 25. Bolsas para descarte de basura 6. Procedimiento a. Identificar las laminas portaobjetos a utilizar. b. Con un marcador trazar una línea dividiendo en dos partes iguales cada una de las cajas de medios de cultivo e identificarlas. PARTE I. Prueba de tubos germinales a. Trabajar frente al mechero. b. Escoger una colonia bien aislada de la caja de aislamiento sospechosa de Candida. c. Rozar la colonia por arriba con un asa en argolla e inocular en un tubo de rosca con 1 ml de suero sanguíneo. d. Incubar el suero a 37 C durante dos horas. PARTE II. Inoculación de medios de cultivo En cada mesa encontrara cajas con dos tipos diferentes de microorganismos (bacterias y levaduras). a. Elija una colonia, muy bien aislada d la caja de un tipo de microorganismo. Destape con cuidado la caja de petri, roce la colonia elegida con la punta del asa en argolla estéril e inocule en la mitad correspondiente del agar nutritivo. Estriando como se indica en el dibujo. b. Elija una colonia, muy bien aislada de la caja del otro tipo de microorganismo. Repita el procedimiento anterior, inoculando en la otra mitad del agar nutritivo. c. Repetir los incisos b y c en el agar sangre. d. Repetir los incisos b y c en el agar sabouraud. PARTE III. Preparación del frotis y tinción de Gram a. Colocar una gota de agua en un portaobjetos previamente identificado. b. Elegir una colonia de una de las cajas con crecimiento y rozarla suavemente. Preparar con mucha precaución un frotis. c. Elegir una colonia de la otro caja con crecimiento y rozarla suavemente y agregar el frotis del paso anterior, procurando dejarlo homogéneo y finalmente extendido. d. Dejarlo secar a temperatura ambiente. e. Fijar a la llama del mechero. f. Cubrir los frotis con solución de Cristal Violeta y dejar por un minuto. g. Lavar con agua d chorro y escurrir. Pag. 3/5 Universidad Mariano Gálvez Facultad de Ciencias Médicas y de la Salud Carrera de Médico y Cirujano h. Cubrir con solución de Lugol durante un minuto. i. Lavar suavemente con agua de chorro y escurrir. j. Gotear alcohol acetona sobre la preparación hasta que deje de soltar color violeta. k. Cubrir la lamina con solución de Safranina, durante un minuto. l. Escurrir el colorante y lavar suavemente la lamina con agua de chorro. m. Colocar una hoja de papel mayordomo doblada en dos sobre la mesa de trabajo y colocar allí las laminas, ligeramente inclinadas para que terminen de escurrir y sequen a temperatura ambiente. PARTE IV. Preparación de tubos germinales a. Limpie y desgrase 1 lámina portaobjetos. b. Prepare una cámara húmeda (caja de petri, con algodón, humedecido con agua destilada) c. Agite suavemente el tubo que contiene el suero inoculado con Candida sp. d. Extraiga una gota de la muestra, con ayuda de una pipeta pasteur y deposítela sobre la lámina ya numerada. e. Descarte la pipeta pasteur, en el Beacker que contiene cloro (pero no la perilla de goma). f. Coloque un cubre objetos sobre la preparación. PARTE V. Observación al Microscopio a. Lleve al microscopio las preparaciones y observe. (tubos germinales con objetivo de 10X y 40X, gram con objetivo de 100X). b. Fotografíe o dibuje. c. Reporte las estructuras observadas PARTE VI. Lectura de cajas. a. Leer las cajas 48 horas después de inoculadas. b. Observar y describir la morfología, superficie, bordes, color y apariencia de las colonias en cada tipo de medio de cultivo. 7. Cuidados y otros aspectos relevantes de seguridad a. Lávese las manos después de realizar cualquier tarea dentro de laboratorio de microbiología. b. No dejar por ningún motivo cajas, tubos o cualquier otro material contaminado, en lugares que no corresponda al área de trabajo. Pag. 4/5 Universidad Mariano Gálvez Facultad de Ciencias Médicas y de la Salud Carrera de Médico y Cirujano c. Todo material empleado en las prácticas microbiológicas, se descarta en las bolsas de color rojo. NINGUN EQUIPO DE PROTECCIÓN SUSTITUYE EL CUIDDO, ORDEN Y PRECAUCIÓN QUE DEBE TENER CADA ESTUDIATE AL REALIZAR SU TRABAJO 8. Formato de presentación de resultados 1. Incluya las fotografías realizadas de cada una de las láminas de acuerdo con formato de laboratorio. 2. Conteste el cuestionario. 9. Cuestionario a. ¿Qué diferencias y que similitudes encontró entre las levaduras y las bacterias? b. ¿Qué medio de cultivo considera mejor para Candida sp. y porque? c. ¿Qué importancia tiene la diferencia entre Candida sp. y bacterias? 10. Bibliografía de referencia Campollo E. Practicas de Microbiología 1. Universidad Mariano Gálvez. Facultad de Ciencias Médicas. 2005. Torres M. 1999 “Manual práctico de Bacteriología Medica. 2da Edición. Editorial Serviprensa C.A Guatemala, Guatemala. Bernard, John. 1991 “Todd- Sandford-Davidsohn Diagnostico y Tratamiento Clínicos por el Laboratorio”. 8ª Edición. Editorial Salvat. Barcelona España. Koneman y Col. 1992 “Diagnostico Microbiologico”. 3ª Edición. Editorial Médica Panamericana. Buenos Aires, Argentina. Pag. 5/5