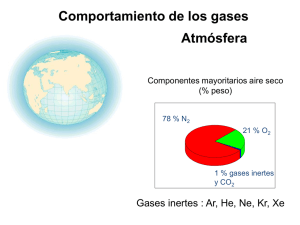
3 - Colegio Marista La Inmaculada
Anuncio
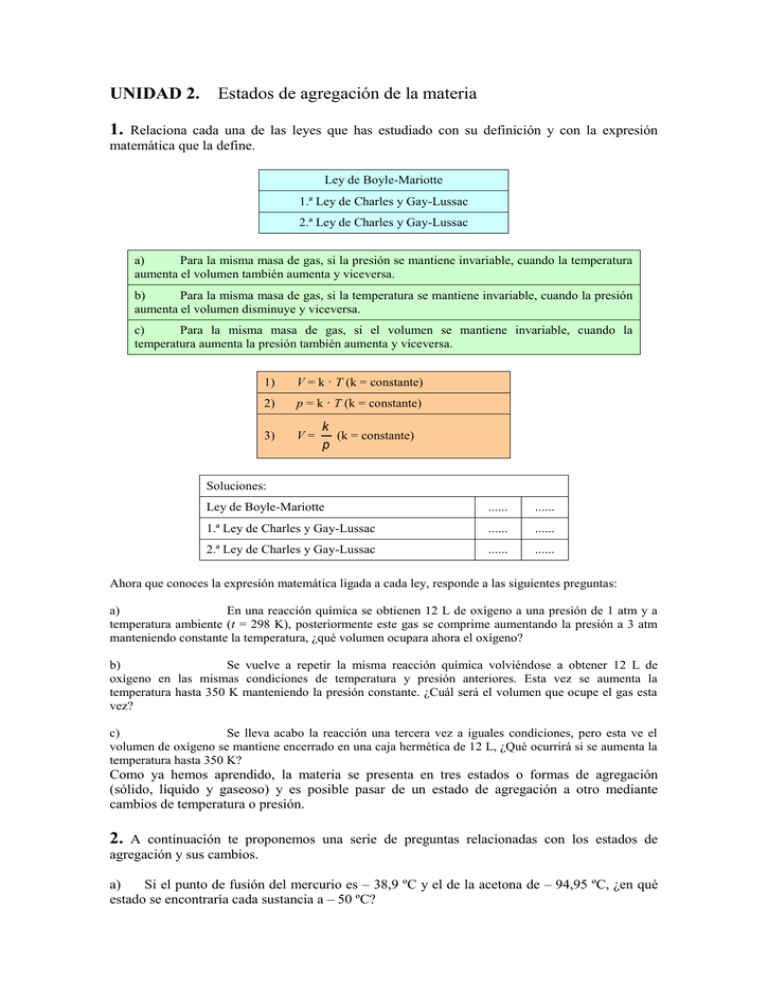
UNIDAD 2. Estados de agregación de la materia 1. Relaciona cada una de las leyes que has estudiado con su definición y con la expresión matemática que la define. Ley de Boyle-Mariotte 1.ª Ley de Charles y Gay-Lussac 2.ª Ley de Charles y Gay-Lussac a) Para la misma masa de gas, si la presión se mantiene invariable, cuando la temperatura aumenta el volumen también aumenta y viceversa. b) Para la misma masa de gas, si la temperatura se mantiene invariable, cuando la presión aumenta el volumen disminuye y viceversa. c) Para la misma masa de gas, si el volumen se mantiene invariable, cuando la temperatura aumenta la presión también aumenta y viceversa. 1) V = k · T (k = constante) 2) p = k · T (k = constante) 3) V= k (k = constante) p Soluciones: Ley de Boyle-Mariotte ...... ...... 1.ª Ley de Charles y Gay-Lussac ...... ...... 2.ª Ley de Charles y Gay-Lussac ...... ...... Ahora que conoces la expresión matemática ligada a cada ley, responde a las siguientes preguntas: a) En una reacción química se obtienen 12 L de oxígeno a una presión de 1 atm y a temperatura ambiente (t = 298 K), posteriormente este gas se comprime aumentando la presión a 3 atm manteniendo constante la temperatura, ¿qué volumen ocupara ahora el oxígeno? b) Se vuelve a repetir la misma reacción química volviéndose a obtener 12 L de oxígeno en las mismas condiciones de temperatura y presión anteriores. Esta vez se aumenta la temperatura hasta 350 K manteniendo la presión constante. ¿Cuál será el volumen que ocupe el gas esta vez? c) Se lleva acabo la reacción una tercera vez a iguales condiciones, pero esta ve el volumen de oxígeno se mantiene encerrado en una caja hermética de 12 L, ¿Qué ocurrirá si se aumenta la temperatura hasta 350 K? Como ya hemos aprendido, la materia se presenta en tres estados o formas de agregación (sólido, líquido y gaseoso) y es posible pasar de un estado de agregación a otro mediante cambios de temperatura o presión. 2. A continuación te proponemos una serie de preguntas relacionadas con los estados de agregación y sus cambios. a) Si el punto de fusión del mercurio es – 38,9 ºC y el de la acetona de – 94,95 ºC, ¿en qué estado se encontraría cada sustancia a – 50 ºC? b) ¿Qué tipo de termómetro usarías para medir temperaturas muy bajas (de 50 bajo cero por ejemplo), de mercurio o de acetona? c) Los ambientadores líquidos que deben enchufarse a la red eléctrica para que dispersen el olor se basan en provocar un cambio de estado en el ambientador. ¿Cuál? d) Cuando nieva, se echa sal sobre el hielo para quitarlo de las carreteras. ¿Por qué? e) Cuando llega el verano, guardamos la ropa de invierno con un antipolillas (alcanfor, naftalina,...) Al sacarla en otoño, las bolas han disminuido de tamaño o han desaparecido, no dejando restos de líquido en la ropa. ¿Qué cambio de estado se ha producido? f) Cuando cocinamos al baño maría (con agua), ¿a qué temperatura se mantiene lo que estamos cocinando cuando lo calentamos al máximo? ¿Por qué?