introduccion a la estructura y función de las proteínas
Anuncio

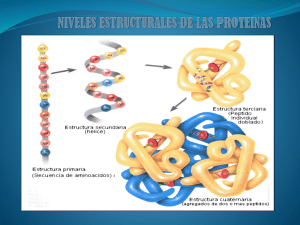
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación de la Asociación Argentina de Kinesiología Palabras Claves: Kinesiología – Estética – Fisioterapia - Célula – Proteína – Aminoácidos. INTRODUCCION La vida de la célula depende de miles de interacciones químicas y reacciones muy coordinadas entre sí en el tiempo y en el espacio, bajo la influencia de las instrucciones genéticas y su ambiente. Como todos sabemos ya, la vida surgió en un medio acuoso, este constituye el 70 a 80% del peso de la mayoría de las células, es la molécula más abundante de los sistemas biológicos. Alrededor del 7% del peso de la materia viva está compuesta de iones inorgánicos y moléculas pequeñas, como aminoácidos (componente estructural de la proteína), nucleótidos (componentes del ADN y ARN), lípidos (los componentes que constituyen las biomenbranas), y los azúcares (componentes estructurales que conforman los almidones y la celulosa), el resto son macromoléculas y agregados macromoleculares constituidos por estas unidades. Muchas moléculas biológicas (azúcares) se disuelven en agua, y se denominan hidrófilas, otras moléculas como las grasas (trigriseroles), evitan el agua y son llamadas hidrófobas, otras moléculas como los fosfolípidos, a las que se conocen como “anfipáticas” , tienen regiones hidrófilas e hidrófobas, se las utiliza para construir membranas que rodean las células. El funcionamiento equilibrado de las células, tejidos y organismos dependen de todas estas moléculas. La proteína es un elemento con el que trabajamos diariamente en nuestra profesión, por tal motivo, no podemos desconocer su accionar, creemos que comprendiendo su estructura y fundamentalmente su funcionamiento podemos comprender mejor el objetivo, la modificación, la dosificación, y la acción de nuestras herramientas diarias en función de un tratamiento más efectivo para la mejora de nuestros pacientes. Como detallaremos en este trabajo la proteína juega un papel crucial en el buen funcionamiento de la célula, estas estructuras son muy complejas, y requieren para su eficiencia, de una coordinada acción en su secuencia, la cual es constantemente agredida por agentes externos e internos que ponen el juego su accionar. Debemos comprender que el mal funcionamiento de las proteínas para nosotros significa enfermedad, tomando esta palabra en su más amplio aspecto que van desde una contractura, hasta el cáncer. El objetivo de este trabajo es poner en conocimiento el funcionamiento, someramente de las proteínas en general, para luego en un próximo trabajo detallar el comportamiento de otras proteínas, como es el colágeno. QUE ES UNA PROTEINA Podríamos decir que las proteínas son las operarias, las trabajadoras en las células, quienes llevan adelante el programa de actividades codificado por los genes. Las proteínas juegan un papel crucial en todos los procesos biológicos, para mantener el funcionamiento correcto, de este programa, se requiere de un esfuerzo coordinado de muchos tipos diferentes de proteínas, que trabajan en forma secuencial, si hay algún error en alguna parte de la secuencia, se pierde la eficiencia de sus funciones, (considerado este error, por muchos investigadores, como el inicio de las enfermedades). Entender el diseño funcional de las proteínas es darse cuenta que muchas tienen partes “móviles” y que son capaces de transmitir diversas fuerzas y energías de una manera ordenada. El significado y característica de las proteínas se las puede clasificar en: 1) CATÁLISIS ENZIMÁTICA: Casi todas las reacciones químicas en los sistemas biológicos vienen catalizados por macromoléculas llamadas “Enzimas”. Todas las enzimas conocidas son proteínas, así que las proteínas juegan un papel muy importante, único, en determinar las características de las transformaciones químicas. Las enzimas normalmente aumentan las velocidades de las reacciones al menos un millón de veces, sin las enzimas, las reacciones químicas en los sistemas biológicos serían muy lentos. 2) TRANSPORTE Y ALMACENAMIENTO: Muchos iones y moléculas pequeñas son transportadas por proteínas específicas, por ejemplo, la hemoglobina transporta oxígeno en el eritrocito, la mioglobina lo transporta en el músculo. 3) MOVIMIENTO COORDINADO: Las proteínas son el componente mayoritario del músculo, la contracción se lleva a cabo por dos clases de filamentos proteicos. 4) SOPORTE MECÁNICO: La enorme fuerza de la piel y de los huesos se debe al colágeno proteína alargada que forma fibras muy fácilmente. 5) PROTECCION INMUNE: los anticuerpos son proteínas altamente específicas que reconocen y se combinan con sustancias como los virus. 6) GENERACION Y TRANSMISION DE IMPULSOS NERVIOSOS: Las respuestas de las células nerviosas a los estímulos están mediados por receptores proteicos. 7) CONTROL DEL CRECIMIENTO Y DIFERENCIACION: La expresión de la información genética controlada secuencialmente es esencial para el crecimiento y diferenciación de la célula, también está a cargo de grupos proteicos especializados. LAS PROTEÍNAS ESTÁN FORMADAS POR AMINOÁCIDOS Los aminoácidos son las unidades estructurales de las proteínas. Un aminoácido consiste en un grupo amino (NH2), un grupo carboxilo (COOH), un átomo de hidrógeno (H) y un grupo distintivo “R” o cadena lateral, enlazado al átomo de carbono que se llama “carbono alfa”, por ser el primero en haberse aislado. Por la cadena lateral es por donde se rompen los enlaces de unión y se adhieren a otra sustancia para formar estructuras nuevas, esta estructura vuelve a oxidarse (reducirse) formando otra, los pasos que siguen estas modificaciones se las llama “secuencia” de una proteína. Solamente veinte tipos de cadenas laterales de aminoácidos que varían en tamaño, forma, carga, capacidad de enlace, y reactividad química, se encuentran comúnmente en todas las proteínas. El extraordinario conjunto de funciones en las que intervienen las proteínas es el resultado de la diversidad y del gran número de ellas que pueden construirse con distintos ordenamientos de los veinte aminoácidos. Algunas proteínas contienen aminoácidos especiales que suplementan el conjunto básico de los veinte aminoácidos mencionados. Por ejemplo, el colágeno, contiene hidroxiprolina, que es un derivado hidroxílico de la prolina. Todos los aminoácidos especiales en las proteínas están formados por modificaciones de un aminoácido común después que ha sido incorporado a la cadena polipeptídica. Los aminoácidos están ligados por enlaces peptídicos para formar una cadena polipeptídica. En las proteínas el grupo alfa carboxílico de un aminoácido se une al grupo alfa amínico de otro aminoácido por medio de un enlace peptídico. La formación de un DIPEPTIDO a partir de los aminoácidos por pérdida de una molécula de agua. El equilibrio de esta reacción queda desplazado hacia la hidrólisis en vez de hacia la síntesis. De aquí que la biosíntesis de los enlaces peptídicos requiere una adición de energía mientras que su hidrólisis está termodinámicamente favorecida. La energía requerida para romper un enlace proviene de los masajes, las técnicas manuales, la fisioterapia, de los desbalances musculares, estres, alteraciones psicológicas, y por supuesto del normal funcionamiento de los movimientos permanentes del sujeto. Muchos aminoácidos, normalmente más de 100, vienen unidos por enlaces peptídicos para formar una cadena polipeptídica, que es una estructura no ramificada. Unidad de aminoácidos en una cadena polipeptídica se llama “RESIDUO”. Una cadena polipeptídica consiste en una parte regularmente repetida, llamada “cadena principal”, y una parte variable, las cadenas laterales que son distintas. Estas cadenas polipeptídicas tiene una dirección porque sus elementos constructores tienen extremos diferentes, es decir, los grupos alfa amino y el alfa carboxílico, (El extremo amínico se toma como el comienzo de una cadena polipeptídica. La secuencia de aminoácidos de una cadena polipeptídica se escribe comenzando con el residuo amino Terminal). En algunas proteínas, unas pocas cadenas pueden estar ligadas por puentes o enlaces disulfuros. Estos enlaces cruzados se forman por la oxidación de los residuos de cisteína. El disulfuro resultante se llama cistina. No existen normalmente otros enlaces cruzados covalentes entre las proteínas. Una cadena corta de aminoácidos unida por enlaces peptídicos y que tiene una secuencia definida es llamada PÉPTIDO, las cadenas más largas se denominan POLIPÉPTIDOS. Los péptidos suelen contener menos de 20 – 30 residuos de aminoácidos, mientras que los polipéptidos contienen hasta 4000 residuos, (queda implícito que las proteínas y los péptidos son productos naturales de una célula, se toma como la proteína a los polipéptidos). Las proteínas conocidas, tienen un peso molecular promedio de 52728 y contienen, en promedio 466 residuos. El peso molecular promedio de los aminoácidos en las proteínas es de 113, si se considera su abundancia relativa media. Este valor puede utilizarse para estimar el número de residuos en una proteína a partir de su peso molecular, o su peso molecular a partir del número de residuos, estos datos tienen su importancia para nosotros porque podemos saber cuanta sustancia podemos ingresar a la célula, movilizar, o transportar. Las proteínas constan de una o más cadenas polipeptídicas. Muchas proteínas, como la mioglobina, están constituidas por una sola cadena polipeptídica, otras contienen dos o más cadenas que son idénticas o diferentes. Las proteínas pueden ser separadas entre sí y de otros tipos de moléculas sobre la base de características tales como el tamaño, la solubilidad, la carga, y la afinidad específica de enlace. También pueden ser separadas sobre la base de su carga neta, si una proteína tiene una carga positiva, (a PH neutro 7), se ligará normalmente a una columna de intercambio iónico que contenga grupos carboxílicos, mientras que una proteína con carga negativa no lo hará. Las proteínas que tienen una baja densidad de carga positiva, tenderán a salir primero seguidas de aquellas que tienen una densidad de carga más alta. La carga de la proteína influye también sobre la velocidad de migración, en un campo eléctrico, este punto es muy importante para nosotros los Kinesiólogos y esteticistas, para ser más exactos en la dosificación de nuestros tratamientos. SECUENCIA DE LAS PROTEINAS En 1953 Federick, Sanger determinó la secuencia de aminoácidos de la insulina; este trabajo es un hito en la biología porque mostró, por primera vez, que una proteína tiene una secuencia de aminoácidos precisa, definida y única. Además las proteínas están sintetizadas a partir de sus constituyentes aminoácidos, por un mecanismo común. Es importante determinar las secuencias de aminoácidos de las proteínas, por cuatro razones: 1) La determinación de la secuencia de la proteína es una etapa significativa hacia la interpretación de la base molecular de su actividad biológica. Una secuencia es particularmente informativa si se considera junto a otros datos físicos y químicos. 2) La secuencia y las estructuras detalladas tridimensionales de numerosas proteínas necesitan ser conocidas para que puedan ser deducidas las reglas que gobiernan el plegamiento de las cadenas polipeptídicas en formas tridimensionales altamente específicas. (recordemos aquí que una cadena polipeptídica desplegada no tiene función biológica, necesariamente debe de formarse tridimencionalmente). La secuencia de aminoácidos es la conexión entre el mensaje genético en el DNA y la estructura tridimensional que es la base de la proteína. 3) Las alteraciones en la secuencia de aminoácidos pueden producir un funcionamiento anormal y enfermedad. La determinación de la secuencia es pues parte de la patología. 4) La secuencia de aminoácidos de una proteína revela mucho acerca de su historia evolutiva. ESTRUCTURA JERARQUICA DE LA PROTEINA (estructura molecular) PRIMARIA secuencia SECUNDARIA plegamiento local TERCIARIA plegamiento alcance CUATERNARIA organización multimérica a largo SUPRAMOLECULAR ensamblaje de gran escala Regulación Estructura Movimiento Señalización FUNCION Transporte Catálisis A pesar de estar construidas en cadenas lineales por la polimerización de tan solo 20 aminoácidos diferentes, las proteínas llevan a cabo increíble cantidad de tareas diversas. Una cadena de proteína se pliega adquiriendo una forma única, estabilizada por interacciones no covalentes entre regiones de la secuencia lineal de aminoácidos. Esta organización espacial de una proteína (su forma tridimensional), es una clave para el entendimiento de su función. Sólo cuando una proteína se encuentra en su estructura tridimensional correcta o conformación, es capaz de funcionar con eficiencia. Un concepto clave en la comprensión de cómo trabajan las proteínas es que la función deriva de la estructura tridimensional y esta está estabilizada por la secuencia de aminoácidos. Hay cuatro niveles de organización comenzando por sus monómeros constitutivos, los aminoácidos. La estructura primaria, es su disposición lineal de aminoácidos. Los átomos repetidos NAmino, el carbono alfa, y el C del carbonilo de cada residuo de aminoácido forman la cadena principal de una molécula de proteína, desde la cual se proyectan los distintos grupos de las cadenas laterales. Como consecuencia del enlace peptídico, la cadena principal exhibe polaridad porque todos los grupos amino se localizan del mismo lado de los átomos C alfa de esta manera, uno de los extremos de una proteína tiene un grupo amino libre (no unido) al NTerminal y el otro extremo tiene un grupo carboxilo libre el C-Terminal, entonces, la secuencia de una cadena de proteína con su aminoácido N-Terminal a la izquierda y su aminoácido CTerminal a la derecha. La estructura primaria de una proteína es simplemente la disposición lineal, o secuencia, de los residuos de aminoácidos que la componen. La estructura secundaria son los elementos cruciales de la arquitectura de la proteína, consiste en diversas disposiciones espaciales, que resultan del plegado de partes localizadas de una cadena polipeptídica. Un único polipéptido puede exhibir múltiples tipos de estructuras secundarias según su secuencia. En ausencia de interacciones estabilizadoras no covalentes, un polipéptido asume una estructura denominada “enrollamiento al azar”. Sin embargo, cuando entre ciertos residuos se forman enlaces de hidrógeno estabilizadores, parte de la cadena principal se pliegan en una o más estructuras periódicas bien definidas: “la hélice alfa”, “la hoja beta”, o un “giro” corto en forma de U. En una proteína promedio, el 60% de la cadena polipeptídica se encuentra en forma de hélice alfa y hoja beta, el resto de la molécula aparece con plegamiento y giro al azar, en consecuencia la hélice y la hoja son el principal elemento interno de sostén en la proteína. LA HÉLICE ALFA: En un segmento polipeptídico plegado en una hélice alfa el átomo del carboxilo de cada enlace peptídico se une mediante un enlace de hidrógeno con el átomo de hidrógeno amido del aminoácido ubicado cuatro residuos más allá, en dirección al C-Terminal. Esta disposición regular de enlace confiere polaridad a la hélice porque todos los donantes en los enlaces de hidrógeno tienen la misma orientación. La disposición estable de aminoácidos en la hélice alfa mantiene la cadena principal como un cilindro similar a un bastón desde el cual parten las cadenas laterales apuntando hacia el exterior. La cualidad hidrófoba o hidrófila de la hélice está determinada enteramente por las cadenas laterales, dado que los grupos polares de la cadena principal peptídico ya están comprometidos en los enlaces de hidrógeno de la hélice. HOJA BETA: Está constituida por hebras beta agrupadas lateralmente cada hebra beta es un segmento polipeptídico corto (5 – 8 residuos), casi totalmente extendido. La unión mediante enlaces de hidrógeno entre los átomos de la cadena principal, en hebra beta adyacente dentro de la misma cadena polipeptídica o entre cadenas polipeptídicas diferentes, forma una hoja beta. La planaridad del enlace peptídico fuerza a la hoja beta a ser plegada, por ello también se la llama “hoja beta plegada”. Al igual que la hélice alfa, las hojas beta, tienen una polaridad definida por la orientación del enlace peptídico. Por lo tanto, en una hoja plegada, las hebras beta adyacentes pueden estar orientadas en la misma dirección (paralelas) o en la opuesta (antiparalela) una respeto de la otra. En ambas disposiciones, las cadenas laterales se proyectan desde las dos caras de la hoja. GIROS: Compuestos por tres o cuatro residuos, los giros se localizan en la superficie de una proteína, formando plegamientos agudos que vuelven a dirigir la cadena principal polipeptídica hacia el interior. Estas estructuras secundarias cortas en forma de U son estabilizadas mediante un enlace de hidrógeno entre los residuos terminales. Es frecuente encontrar glicina y prolina en los giros. La ausencia de una cadena lateral grande en la glicina y la presencia de una curvatura intrínseca en la prolina le permiten a la cadena principal polipeptídica plegarse para formar una estructura rígida en forma de “U”. Los giros les permiten a las proteínas grandes plegarse para formar estructuras altamente compactas. Una cadena principal polipeptídica también puede contener curvaturas más largas o bucles. La estructura terciaria: se refiere a la composición global de una cadena polipeptídica, es decir, la disposición tridimensional de todos sus residuos de aminoácidos. Esta estructura es estabilizada principalmente por interacciones hidrófobas entre las cadenas laterales no polares, enlaces de hidrógeno entre la cadena laterales polares y enlaces peptídicos. Estas fuerzas estabilizadoras mantienen compactos los elementos de la estructura secundaria, sin embargo, como las interacciones estabilizadoras son débiles, la estructura terciaria no se mantiene fija, sino que sufre una fluctuación continua y momentánea. Esta variación en la estructura tiene como consecuencia importante en el funcionamiento y la regulación de las proteínas. “Los Motivos” o plegamientos, construyen la estructura terciaria de una proteína, en algunos casos, los motivos poseen una topología particular para una función específica, por ejemplo, (hélice – bucle – hélice) es un motivo de unión de Ca+2 que se caracteriza por la presencia de ciertos residuos hidrófilos en posiciones invariables en la hélice. Los átomos de oxígeno de los residuos invariables unen un Ion de calcio mediante enlaces de hidrógeno. Debido a que las cadenas laterales hidrófilas (solubles en agua) se extienden desde un lado de la hélice y las cadenas laterales hidrófobas (no soluble en agua) se extienden desde el lado opuesto, la estructura helicoidal general es “anfipática”. El carácter anfipático de estas hélice alfa permite que dos, tres, o cuatro hélices se enrollen una alrededor de la otra y formen una espiral enrollada, de allí el nombre de motivo. “Los Dominios”, la estructura terciaria de la proteína de peso molecular de 15000 está subdividida en diferentes regiones denominadas “dominios”. Desde el punto de vista estructural, un dominio es una región de un polipéptido plegado en forma compacta. Un dominio estructural esta compuesto por 100 – 150 residuos en diversas combinaciones de motivos. A menudo un dominio se caracteriza por presentar alguna particularidad estructural interesante, una abundancia inusual de un determinado aminoácido (por ejemplo, un dominio rico en prolina). Los dominios están definidos en términos funcionales, la actividad de una proteína se localiza en una pequeña región a lo largo de su longitud. Así, una región o regiones particulares de una proteína pueden ser responsables de su actividad catalítica (por ejemplo, un dominio de cinasa), o la capacidad de unión (un dominio de unión al ADN, un dominio de unión a la membrana). El dominio del factor de crecimiento epidérmico (EGF) es un ejemplo de un módulo que está presente en varias proteínas. El EGF es una hormona peptídico soluble pequeña que se une a las células en la piel y al tejido conectivo en el adulto e induce su división. Se genera por escisión proteolítica entre dominios EGF repetidos en la proteína precursora de EGF, que queda anclada en la membrana celular por medio de un dominio que atraviesa la membrana. La estructura cuaternaria: este nivel de organización describe el número y las posiciones relativas de las subunidades en las proteínas multiméricas. Otras proteínas multiméricas pueden estar compuestas por cualquier número de subunidades idénticas o no. La naturaleza miltimérica de muchas proteínas es crítica para los mecanismos que regulan sus funciones. Además, las enzimas de la misma vía pueden estar asociadas como sub unidades de una gran proteína multimérica dentro de la célula incrementando de este modo la eficiencia del funcionamiento de la vía. Por consiguiente este cuarto nivel de la estructura de una proteína es la asociación de proteínas para formar asociaciones macromoleculares. Estas estructuras son muy grandes, se aproximan de 30 – 300nm en tamaño y contienen decenas a cientos de cadenas polipeptídicas así como ácidos nucleicos, otras macromoléculas actúan como maquinarias moleculares, llevando a cabo los procesos celulares más complejos al integrar las funciones individuales en un único proceso coordinado, por ejemplo, la maquinaria transcripcional (RNA). CONCLUSIÓN Las proteínas juegan un papel crucial en todos los procesos biológicos, para mantener el funcionamiento correcto, de este programa, se requiere de un esfuerzo coordinado de muchos tipos diferentes de proteínas, que trabajan en forma secuencial. Es nuestro deber comprender el funcionamiento de las cadenas laterales o residuos de aminoácidos, sabiendo que son los elementos que podemos influenciar con el uso, por ejemplo, de la fisioterapia, para equilibrar, recuperar, modificar, o introducir alguna sustancia, y así corregir el funcionamiento de una célula, un tejido, un sistema. De la comprensión del funcionar de la hélice, el cilindro o bucle, la hoja, y el giro, por donde llegamos al plegamiento tridimensional de una proteína, (que es donde se registra su mayor potencial biológico), es que podemos llegar a ser más eficientes en el tratamiento del uso de técnicas o corrientes, y saber, por ejemplo, cuanta sustancia podemos transportar por las membranas, y ser ingresados a la célula. BIBLIOGRAFÍA 1. Stryer, L Bioquímica (edición revisada y corregida) – Editorial Reverte, S.A. 2. De Robertis (h) – HIP – Ponzio Biología celular y molecular – Editorial El Ateneo, 6ª edición 2008. 3. Lodish – Berk – Matsudaira – Kaiser – Krieger – scout – Zipursky – Darnell Biología celular y molecular – Editorial Panamericana, 5ª edición 2006. 4. Vidos,Claudio – Importancia de la membrana extracelular y su aplicación en Kinesiología y Estética – DEMIK Electromedicina – 2010.