Física para Ciencias: Gas Ideal
Anuncio

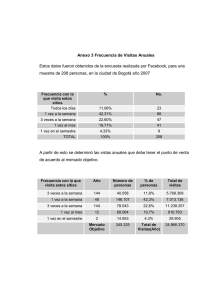
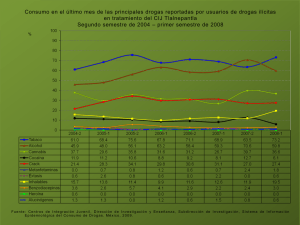
Física para Ciencias: Gas Ideal Dictado por: Profesor Aldo Valcarce 1er semestre 2014 FIS109C – 2: Física para Ciencias 1 er semestre 2014 El gas ideal Se estudian las propiedades de un gas de masa 𝒎 confinada a un recipiente con volumen 𝑽, presión 𝑷, y temperatura 𝑻. La relación entre 𝑷, 𝑽 y 𝑻 es llamada ecuación de estado y es en general complicada. Sin embargo, la ecuación de estado es simple para una presión cercana a 1 Atm, siempre que el gas no esté cerca de su punto de licuefacción. También se considerarán sólo estados de equilibrio, es decir aquellos estados en los que 𝑷 y 𝑻 son iguales en todo el sistema y no cambian en el tiempo. FIS109C – 2: Física para Ciencias 1 er semestre 2014 Ley de los gases ideales Las tres leyes siguientes, se encuentran de forma experimental. Para una cantidad fija de gas se cumplen las siguientes leyes empíricas: Ley de Boyle 𝟏 𝑽∝ 𝑷 𝒄𝒐𝒏 𝑻 𝒄𝒕𝒆 Ley de Charles 𝑽∝𝑻 𝒄𝒐𝒏 𝑷 𝒄𝒕𝒆 Ley de Guy Lussac 𝑷∝𝑻 FIS109C – 2: Física para Ciencias 𝒄𝒐𝒏 𝑽 𝒄𝒕𝒆 1 er semestre 2014 Ley de los gases ideales Estas tres ecuaciones se pueden combinar: 𝑽 𝑷 = 𝒄𝒕𝒆 𝑻 (Para una cantidad fija de gas ideal) La cantidad de partículas del gas se mide frecuentemente con el número de moles, 𝒏. 1 𝑚𝑜𝑙 = 6,02214129 × 1023 Incluyendo el número de moles, se encuentra que, 𝑷𝑽 = 𝒄𝒕𝒆 = 𝑹 𝒏𝑻 o equivalentemente, FIS109C – 2: Física para Ciencias 𝑹 es la constante del gas ideal, 𝑹 = 8.135𝐽/(𝑚𝑜𝑙 𝐾) 𝑷𝑽 = 𝒏𝑹𝑻 Ley de los gases ideales 1 er semestre 2014 Amedeo Avogadro Fue quién propuso por primera vez que el volumen de un gas (a una determinada presión y temperatura) es proporcional al número de átomos o partículas, independientemente de la naturaleza del gas. 1 mol = NA de algo Número de Avogadro (por Jean Perrin) NA = 6,02214129 × 1023 mol-1 Número de átomos de carbono-12 en 12 gramos. Amedeo Avogadro (1776-1856) Italiano FIS109C – 2: Física para Ciencias 1 er semestre 2014 Ley de los gases ideales En vez de escribir la cantidad del gas en términos del número de moles, 𝒏, sería posible hacerlo en términos del número de partículas (átomos o moléculas), 𝑵: El número de Avogadro, 𝑨 6,02 × 1023 1/𝑚𝑜𝑙 𝑵 = 𝒏𝑵 Entonces o bien 𝑵 𝑷𝑽 = 𝒏𝑹𝑻 = 𝑹𝑻 𝑵𝑨 𝑷𝑽 = 𝑵𝒌𝑩 𝑻 Constante de Boltzmann, 𝑘𝐵 = 1,38 × 10−23 𝐽/𝐾 FIS109C – 2: Física para Ciencias 1 er semestre 2014 Temperatura… … ¡siempre en kelvin! Vol Vol -273 0 FIS109C – 2: Física para Ciencias T oC 0 T K 1 er semestre 2014 Masa molar El número de moles 𝒏 de una sustancia se relaciona con su masa 𝒎 por medio de la expresión 𝒎 𝒏= 𝑴 donde 𝑴 es la masa molar de la sustancia. Masa Molar FIS109C – 2: Física para Ciencias 1 er semestre 2014 Ejercicio 1 ¿Cuál es el volumen de un mol de gas a 1 Atm y 0oC? FIS109C – 2: Física para Ciencias 1 er semestre 2014 Ejercicio 2 Una botella de aire cerrada herméticamente a 27𝑜𝐶 tiene un volumen de 30 𝑐𝑚3 de aire a presión atmosférica. Si se calienta la botella a 200𝑜𝐶, ¿Cuál es la presión dentro de la botella? FIS109C – 2: Física para Ciencias 1 er semestre 2014 Ejercicio 3 Un cilindro vertical cuya área de sección transversal es de 0,05 𝑚2 está dotado de un pistón ajustado y sin roce, cuya masa es de 5 𝑘𝑔. Si hay 3 moles de un gas ideal en el cilindro a 227𝑜𝐶, determine la altura h a la que el pistón estará en equilibrio por su propio peso. FIS109C – 2: Física para Ciencias 1 er semestre 2014 Resumen Ley de Boyle Ley de Charles Ley Guy-Lussac 𝟏 𝑽∝ 𝑷 𝒄𝒐𝒏 𝑻 𝒄𝒕𝒆 𝑽∝𝑻 𝒄𝒐𝒏 𝑷 𝒄𝒕𝒆 𝑷∝𝑻 𝒄𝒐𝒏 𝑽 𝒄𝒕𝒆 Gases Ideales 𝑷𝑽 = 𝒏𝑹𝑻 FIS109C – 2: Física para Ciencias 𝑷𝑽 = 𝑵𝒌𝑩 𝑻 1 er semestre 2014