DETERMINACION DE ENZIMAS PROTEOLITICAS EN HIGO (Ficus
Anuncio

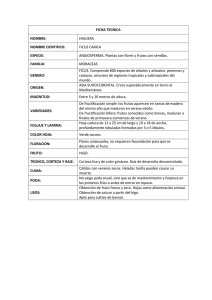
DETERMINACION DE ENZIMAS PROTEOLITICAS EN HIGO (Ficus carica). Cruz y Victoria, M.T., Palma-Orozco, G., Anaya-Sosa, I. Graduados en Alimentos. Escuela Nacional de Ciencias Biológicas. Instituto Politécnico Nacional. México, D.F. tere.ipn@hotmail.com Introducción. La higuera es originaria de Asia y fue traída por los monjes franciscanos en la colonia a América. El fruto de higuera es el higo y este presenta diversas formas y colores. El higo presenta una concentración alta de calcio, proteína y fibra. El higo se consume como fruto de mesa en estado maduro, pero las pérdidas son muy grandes, ya que los pájaros se comen la mayor cantidad en el estado maduro. Las enzimas proteolíticas presente en el látex de la higuera, han sido extensamente estudiadas y son las denominadas "ficinas", comparando su actividad con la bromelaína y la papaína. Sin embargo, en el fruto de la higuera, el higo, no se han reportado estudios sobre la actividad proteolítica y coagulante que estos presentan. Objetivo. Es el estudiar la presencia de enzimas proteolíticas, determinando el contenido de actividad proteolítica y coagulante en el higo en tres estados de maduración: verde. Intermedio y maduro. Desarrollo experimental y metodología. Los higos se recolectaron en los 3 estados de maduración: verde, intermedio y maduro, estos estados son fácilmente diferenciados por los colores extremos que hay entre el estado verde y maduro. Con cada etapa de maduración se prepararon extractos con soluciones de NaCl (0.1N, 0.5N, 1N, 5%, 10) con el objeto de determinar en donde se solubilizaba la mayor cantidad de proteína, y por lo consiguiente de actividad enzimática, se dejaron en reposo 24h, se centrifugaron y el precipitado fue reextraído dos veces mas con las mismas soluciones.. La actividad proteolítica se hizo sobre caseína al 1%, pH-7.6, 35°C, haciendo la actividad en función del tiempo de reacción y variando la cantidad de extracto en el volumen de reaccióny determinando según el sea el caso las unidades internacionales de tirosina (UT) para la actividad proteolítica, la actividad coagulatoria se hizo en leche a pH de 5.5, a 35°C, determinando las unidades internacionales de coagulación Belrridge- Foltman (UBF) Resultados. La mayor concentración de proteína se presentó en el fruto maduro (1101 μg/ml) con NaCl 10%. La actividad proteolítica mas alta se presentó en los extractos del fruto verde con NaCl 1N (1117 UT), la actividad menor fue con los extractos de higos maduros. La actividad coagulatoria alta en unidades Belrridge-Foltman, fue también con frutos verdes (409 UBF/ mg de proteína). La proteína aumenta al madurar el higo, pero, la actividad proteolítica y la de coagulación disminuyen y son muy altas en frutos verdes. El higo puede ser utilizado en la preparación de extractos concentrados de enzimas proteolíticas y ser utilizados en la industria alimentaria. Conclusiones. Para cualquier estado de maduración, la solución con NaCl al 10%, permite obtener el grado de extracción mas alto para la proteínas del higo. Se observó una relación inversa en el aumento en la concentración de proteína total y la disminución de actividad proteolítica a medida que se presentan las fases de la maduración, debido probablemente a los cambios metabólicos que favorecen la ingesta del sicono Bibliografía: 1. Andrean, A. (1988). Milk-clotting activity of vaious rennets and coagulants, background and information regarding. Bull. Int. Dairy Fed., 332: 9-14 2. British Standard institution (1993). Method for the determination of milk-coagulation power of rennet. British Standard 3624 3. Ortega y Del Castillo, L.M. (1964). Actividad de la mexicaína en presencia de altas concentraciones de urea. Ciencia. México, pp 24, 274.