AMINOÁCIDOS ENLACE PEPTÍDICO PROPIEDADES de las
Anuncio

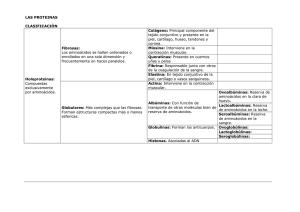
PRÓTIDOS . PROTEÍNAS (Completa los contenidos de la pg.147) - Concepto.Las proteínas son biomoléculas formadas básicamente por C, H, O y N. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre entre otros elementos. Se definen como polímeros lineales de unas moléculas denominadas aminoácidos, unidos mediante enlaces peptídicos (Los AA serían, por tanto, los monómeros unidad). La unión de un número bajo de aminoácidos da lugar a un péptido (2AA forman un dipéptido, 3AA=tripéptido...). Aunque no existe unanimidad en este asunto, si el nº de AA es superior a 10 se llama polipéptido y si es superior a 50 AA (ó 100, según autores) se habla ya de proteína. AMINOÁCIDOS - Concepto.Son compuestos orgánicos cuya molécula contiene, al menos, un grupo carboxilo y un amino. Se conocen 20 aminoácidos proteicos, es decir, constituyentes de las proteínas. R - CH - COOH Todos ellos presentan un grupo carboxilo y un amino unidos al C2, llamado Cá, al que I se une, además, un radical que diferencia unos AA de otros. NH2 Su fórmula general se indica al margen. - Propiedades. Carácter anfótero.En disolución acuosa, los aminoácidos muestran un comportamiento anfótero, es decir, dependiendo del pH del medio, pueden ionizarse como un ácido liberando protones y quedando el carboxilo como -COO– , o actuar como base , los grupos -NH2 captan protones, quedando como -NH3 + . También pueden actuar como ácido y base a la vez. En este caso los aminoácidos se ionizan doblemente, apareciendo la llamada forma dipolar neutra o ión híbrido. (Representar a la vuelta del folio). ENLACE PEPTÍDICO - Concepto.Es aquel mediante el cual se unen los AA para formar las proteínas. Se trata de un enlace covalente que se forma al reaccionar el grupo carboxilo de un AA con el amino de otro, desprendiéndose una molécula de agua (Representado en pg.147) . (NOTA: Los dos grupos citados se encuentran unidos al Cá. Si el radical contiene un carboxilo o un amino, nunca intervienen en un enlace peptídico). - Propiedades.El enlace peptídico tiene un parcial comportamiento de doble enlace, es decir, presenta una cierta rigidez que inmoviliza en un plano los átomos que lo forman (recuadro azul de la pg.147). Este hecho tiene importantes consecuencias en la estructura espacial que adquieren las proteínas. ESTRUCTURA de las PROTEÍNAS (Pg.147 y gráficos de apoyo en la web del Cole). PROPIEDADES de las PROTEÍNAS Especificidad.- La especificidad, por una parte, se refiere a su función: cada proteína lleva a cabo una determinada función y lo realiza porque posee una determinada estructura primaria y una conformación espacial propia; por lo que un cambio en la estructura de la proteína puede significar una pérdida de la función. - Además, no todas las proteínas son iguales en todos los organismos, cada individuo posee proteínas específicas suyas que se ponen de manifiesto en los procesos de rechazo de órganos transplantados. - Por otra parte, la semejanza entre proteínas es un indicador del grado de parentesco entre individuos, por lo que sirve para la construcción de "árboles filogenéticos" en la clasificación de especies. [Filogenia V.- (Del griego: phylon=tribu, raza; genea=origen, procedencia).- Parte de la biología que estudia el origen y desarrollo evolutivo de las especies, y en general, las relaciones de parentesco entre los distintos grupos de seres vivos]. Desnaturalización.- (Pg.147). CLASIFICACIÓN de las PROTEÍNAS Como se ha indicado al principio, debemos distinguir entre péptidos y proteínas. Existen péptidos de interés como ciertas hormonas (insulina...), algunos antibióticos, etc. A partir de aquí, nos centraremos en la clasificación de las proteínas propiamente dichas. 1 HOLOPROTEÍNAS.- Formadas solamente por aminoácidos. Se las clasifica en . . . - Pr. globulares.- Estructura molecular a modo de ovillo. Ver ejemplos y funciones en el esquema adjunto. - Pr. fibrosas.- Estructura molecular en filamentos (fibras). Ver ejemplos y funciones en el esquema. HETEROPROTEÍNAS.- Formadas por una fracción proteínica (aminoácidos) + una molécula de naturaleza no proteica, que se denomina "grupo prostético” según el cual se clasifican así . . . - Cromoproteínas.- (Cromo=color) El grupo prostético es una molécula coloreada. Ejemplos... • Hemoglobina y hemocianina, que transportan oxígeno en sangre. • Mioglobina que transporta oxígeno en el músculo. - Glucoproteínas.- Su grupo prostético es un glúcido. Ejemplos importantes son: • Los anticuerpos (inmunoglobulinas) creados por los leucocitos (del tipo linfocitos-B) como defensa frente a agentes extraños. • Las glucoproteínas del grupo sanguíneo ABO y Rh presentes en la membrana de los glóbulos rojos. • Las mucinas que forman parte de flemas y mucosidades en el aparto respiratorio, digestivo... - Lipoproteínas.- Su grupo prostético son lípidos. Como ejemplo destacamos las proteínas que transportan triglicéridos y colesterol en la sangre, conocidas como HDL (High Density Lipoprotein) y LDL (Low Density Lipoprotein). - Nucleoproteínas.- Su grupo prostético son los ácidos nucleicos: • Las que contienen ADN constituyen la cromatina del núcleo. • Las que contienen ARN forman los ribosomas, por ejemplo... - Fosfoproteínas.- Su grupo prostético es ácido fosfórico. Ej.- La caseína de la leche. De lo anteriormente expuesto podemos deducir fácilmente la enorme versatilidad funcional de las proteínas, dentro de los organismos. En el siguiente apartado se resumen sus funciones. 2 FUNCIONES de las PROTEÍNAS (y ejemplos) Son las biomoléculas que mayor diversidad de funciones desempeñan en los seres vivos. - F. Estructural.- Forman parte de muy diversas estructuras. Ej.• Las proteínas y glucoproteínas que forman parte de las membranas celulares. • Las histonas que forman parte de la cromatina y los cromosomas. • El colágeno de las fibras del tejido conjuntivo, en los tendones y otras muchas estructuras. • La queratina de la epidermis, pelo, uñas, plumas, pezuñas . . . - F. Enzimática.- Los enzimas son proteínas que actúan como catalizadores favoreciendo/acelerando las reacciones bioquímicas. Son las proteínas más numerosas y especializadas. Se estudiarán más adelante. - F. Transportadora.- Citaremos . . . • Las proteínas que transportan sustancias a través de las membranas celulares. • La Hemoglobina y hemocianina transportan oxígeno en la sangre de animales y la mioglobina lo hace en el músculo. • Las proteínas sanguíneas HDL y LDL transportan triglicéridos y colesterol. - F. Defensiva/Protectora.• Las inmunoglobulinas nos defienden frente a infecciones. • El fibrinógeno nos protege de hemorragias. - F. Hormonal.- Algunas hormonas son péptidos. Por ejemplo . . . • La hormona del crecimiento, segregada por la glándula hipófisis. • La insulina y el glucagón, segregadas por el páncreas, regulan la glucemia (nivel de glucosa en la sangre). - Movimiento.• La actina y miosina presentes en las células musculares son responsables de la contracción de éstas. • La tubulina, que constituye los microtúbulos, genera el movimiento de cilios y flagelos. - Reserva de aminoácidos.- Tal es el caso de . . . • La ovoalbúmina de la clara de huevo. • La lactoalbúmina de la leche. NOTA.- La función energética es la menos frecuente en las proteínas. Por regla general, las células sólo utilizan los aminoácidos como combustible metabólico cuando no disponen de glúcidos o lípidos. Estas circunstancias se dan en casos de ayuno severo y prolongado (se consumen las proteínas constitutivas de la célula) o cuando la dieta incluye una ingestión masiva de proteínas. 3