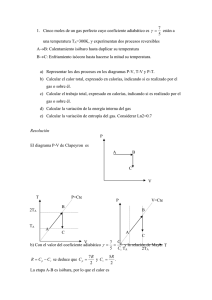
El ciclo reversible de Otto, está formado por dos procesos
Anuncio

El ciclo reversible de Otto, está formado por dos procesos adiabáticos y dos procesos isócoros, en sentido horario. Dos moles de un gas perfecto monoatómico (γ=5/3) realizan un ciclo de Otto, reduciéndose el volumen a la tercera parte durante la compresión adiabática y triplicándose la presión durante el calentamiento isócoro. a) Calcular las temperaturas de los estados B, C y D, sabiendo que la temperatura del estado inicial A es TA=400 K. b) Calcular el rendimiento del ciclo y el rendimiento de un ciclo de Carnot que funcione entre las mismas temperaturas extremas. c) Calcular la variación de entropía en cada una de las etapas. P Considerar 32/3 =2 B 3PA C PA A D V VA 3VA Resolución 1. a) En el proceso A-B se triplica la presión, manteniendo constante el volumen, por lo que V = Cte = nRTA nRTB = de donde la temperatura de B es triple de la de A PA 3 PA TB = 3T A = 3·400 K = 1200 K ; en el proceso adiabático B-C T BV Aγ −1 = TC ( 3V A )γ −1 , por tanto la 1 temperatura de C es TC = TB ⎛⎜ ⎞⎟ ⎝3⎠ γ −1 TB = 3 = 2/3 TB , su valor es TC = 600 K 2 En el proceso adiabático D-A el volumen se reduce a la tercera parte, por tanto γ −1 T AV A = T D ( 3V A ) γ −1 , ⎛ 1⎞ TD = T A ⎜ ⎟ ⎝3⎠ γ −1 = TA 3 2/3 = TA 2 , su valor es TD = 200 K b) El trabajo realizado en el ciclo es suma de todos los calores, ya que la variación de energía interna es nula; en las etapas B-C y D-A no se intercambia calor, por ser adiabáticas W = Q AB + Q BC + QCD + Q DA = Q AB + QCD El rendimiento es η = Q W = 1 + CD Q AB Q AB El calor intercambiado en los procesos isócoros A-B y C-D es Q AB = ncV ( TB − T A ) QCD = ncV ( TD − TC ) QCD ncV ( TD − TC ) 200 − 600 = = = −0 ,5 Q AB ncV ( TB − T A ) 1200 − 400 η = 1 − 0 ,5 = 0 ,5 El rendimiento de un ciclo de Carnot que trabaje entre las mismas temperaturas extremas es η= 1200 − 200 5 = 6 1200 c) La variación de entropía en las dos etapas adiabáticas (B-C y D-A) es nula TB En los procesos isócoros es S B − S A = ∫ TA TD S D − SC = ∫ TC ncv dT T cal cal L3 = 6 L3 = nc v L B = 2 mol·3 TA mol·K K T ncv dT T cal cal L3 = −6 L3 = nc v L D = −2mol·3 TC mol·K K T