ejercicios aplicados
Anuncio

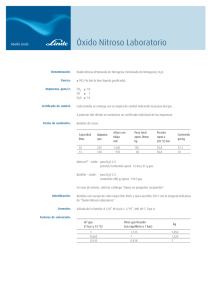
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA –UNAD Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente-ECAPMA Programa. Ingeniería Ambiental TRABAJO COLABORATIVO FISICOQUÍMICA AMBIENTAL-FA Prof: Jairo Granados., MSc EJERCICIOS APLICADOS 1. Diez(10) gramos de hielo con temperatura de -10°C, se mezclan adiabáticamente a presión constante, en un calorímetro, con 50 gramos de agua contaminada, que está a 30°C; teniendo en cuenta que el calor específico del agua líquida es: Cp=1 cal/g°C, el del hielo es: Cp=0,5cal/g°C y que el calor latente de fusión del hielo es: ∆Hf=80cal/g°C, a 0°C. 1.1 Realizar el balance de calor para determinar la temperatura final del sistema:T f 1.2.Si la muestra de agua se recolecta en el río Bogotá, con las siguientes condiciones:T=18°C y Volumen(V) de 250mL, y luego se mezclan con 50 g de hielo (T= -4°C),en la bomba calorimétrica, ¿Cuál será la temperatura final del sistema? 2.Una burbuja que tiene un diámetro de 10mm en el fondo de un lago, donde la temperatura es 5°C y la presión 3 atm, sube a la superficie, donde la temperatura es 45F y la presión: 760mmHg ¿Cuál será el diámetro (en cm) de la burbuja cuando llegue a la superficie? Tener en cuenta: No existe presencia de vapor de agua en la burbuja Vesfera=4/3πR3 ; P1.V1/ T1= P2.V2/ T2 3. El óxido nitroso (N2O) es un poderoso gas con efecto invernadero (GEI), ataca la capa de ozono, reduciendo el ozono a oxígeno molecular y liberando dos moléculas de monóxido de nitrógeno; por lo cual, las emisiones de este gas, junto con las de: CO2, CH4 y algunos aerosoles, contribuyen en gran proporción al calentamiento global y por ende al cambio climático. En un experimento, se siguió la cinética de la descomposición del óxido nitroso, a T=25°C, obteniéndose los valores mostrados en la tabla 1: 1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA –UNAD Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente-ECAPMA Programa. Ingeniería Ambiental TRABAJO COLABORATIVO FISICOQUÍMICA AMBIENTAL-FA Prof: Jairo Granados., MSc EJERCICIOS APLICADOS Tabla 1:Datos cinéticos para la descomposición del óxido nitroso t(s) C(mmol/L) 0 4,61 5 3,71 10 2,98 20 1,96 30 1,23 *t=tiempo en segundos; C= concentración del N2O en milimol/litro Con base en los datos anteriores: 3.1 Graficar. C versus t, y analizar 3.2 Graficar: LogC, versus t, y analizar 3.3 Linealizar la anterior gráfica (3.2), por el método estadístico de los mínimos cuadrados, encontrar la pendiente, intercepto sobre el eje Y, lo mismo que el coeficiente de correlación(r2) y analizar estos valores. 3.4 Con base en la pendiente de la recta, calcular la constante de velocidad (K) y el período de vida media ó semiperíodo(t1/2) ,para la descomposición del óxido nitroso. 4. Las constantes cinéticas (K) para la producción de ácido yodhídrico, en fase gaseosa: H2 + I2 2HI Fueron determinadas a varias temperaturas como se muestran en la tabla 2: 2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA –UNAD Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente-ECAPMA Programa. Ingeniería Ambiental TRABAJO COLABORATIVO FISICOQUÍMICA AMBIENTAL-FA Prof: Jairo Granados., MSc EJERCICIOS APLICADOS Tabla 2:Datos cinéticos para la produción del HI *103.K *T(K) 0,54 599 2,51 629 14 667 25 683 64 700 *k=constante de velocidad en: L/mol.s, multiplicada por 1000 ; T=temperatura en grados kelvin A partir de los datos anteriores: 4.1 Graficar K versus T, y analizar 4.2 Graficar LogK, versus 1/T 4.3 Linealizar la gráfica 4.2, por el método estadístico de los mínimos cuadrados y encontrar pendiente(m), intercepto(b) y coeficiente de correlación(r2) 4.4 Con base en la pendiente y el intercepto hallados, calcular: Energía de activación de la reacción(Ea) en kcal/ mol , teniendo en cuenta que: m = -Ea / 2,303.R Constante de Arrhenius ó factor de frecuencia de colisiones(A), teniendo en cuenta que: b = Log A 4.5 Analizar e interpretar estos resultados. 3