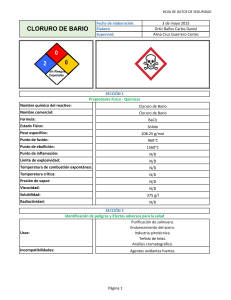
BARIO (Ba) ¿Cómo es el bario? Historia. Fue aislado en 1808 por el
Anuncio

BARIO (Ba) ¿Cómo es el bario? Historia. Fue aislado en 1808 por el científico inglés sir Humphry Davy, quien le dio nombre. Previamente, en 1774, Carl W. Scheler (1742-1786) señaló su existencia al establecer las diferencias entre cal y la barita, a la que llamó tierra pesada. Abundancia y estado natural. Debido a su reactividad no existe libre en la naturaleza. Sus compuestos más importantes son los minerales baritina (BaSO4) y witherina (BaCO3). Ocupa la posición número 14 en abundancia y constituye el 0.05% de la corteza terrestre. Propiedades. Es un metal blanco plateado, parecido al calcio en su aspecto, es blando y muy reactivo. Se oxida rápidamente en contacto con el aire, por lo general debe guardarse en petróleo, y descompone vigorosamente el agua fría liberando hidrógeno. En los ensayos, da a la llama un color verde característico. Preparación. Se extrae por electrólisis de una disolución de su cloruro correspondiente, mediante un cátodo de mercurio y destilando en el vacío la amalgama formada. También se extrae por electrólisis del cloruro fundido y por reducción del BaO con aluminio. Usos. Como metal tiene pocas aplicaciones prácticas, aunque se utiliza en algunas ocasiones para cubrir conductos eléctricos en aparatos electrónicos y en sistemas de ignición de automóviles. El sulfato de bario purificado se usa en radiología para diagnosticar problemas gastrointestinales; el paciente ingiere una papilla de sulfato de bario que es opaco a los rayos X y permite observar las zonas de bloqueo en el proceso digestivo. El nitrato de bario se emplea en pirotecnia para dar color verde. También se utiliza en pinturas, vidrios, como componente en algunos raticidas y para extraer el americio a partir de fluoruro de americio (AmF3). RADIO (Ra) ¿Qué es el radio? Historia. Su nombre procede del latín radius, Que significa rayo. El isótopo 226 descubierto en 1898, en Francia, por los esposos Curie y su colaborador M, G. Bémont en los residuos obtenidos mientras trataban la pechblenda. Se dieron cuenta de que el mineral era más radiactivo que su componente principal, el uranio, y separaron el mineral en muchas fracciones químicas con el fin de aislar las fuentes desconocidas de radioactividad. Una de las fracciones, aislada mediante sulfuro de bismuto, contenía una sustancia nueva fuertemente radiactiva que los Curie llamaron polonio. En otra de las fracciones, un cloruro de bario altamente radiactivo, reconocieron la presencia de otro nuevo elemento, el radio. En 1910, André-Lous Debierne (1874-1949) y Marie Curie aislaron radio metálico. Abundancia y estado natural. Se encuentra en los minerales de uranio. De los isótopos del radio, con número másico 206 hasta el 232, el más abundante y estable es el isótopo de masa 226. El 226Ra es de 1620 años. Emite partículas alfa para formar el gas noble radón. Propiedades. Es un elemento metálico, blanco plateado, blando y radiactivo. El isótopo más estable es el 226Ra. Se oxida inmediatamente por exposición al aire y reacciona fácilmente con el agua, a la que descompone. Casi nunca se utiliza en estado metálico, sino en forma de cloruro o bromuro. En los ensayos, las sales de radio dan color rojo a la llama. Preparación. El radio se forma por desintegración radiactiva del uranio y se encuentra, por tanto, en todos los minerales de éste. La proporción media en el mineral de uranio es de 1 parte de radio por cada 3 millones de uranio. La extracción desde el mineral se realiza por precipitación de los sulfatos insolubles de bario y de radio que posteriormente se convierten en carbonato o sulfuro y se disuelven en ácido clorhídrico. A partir de aquí pueden emplearse técnicas de separación por intercambio iónico o 3procedimientos de cristalización fraccionada de las soluciones de cloruro. Otra fuente importante de radio es la recuperación como subproducto en los reactores nucleares. Usos. El radio ha sido durante mucho tiempo el único radioisótopo utilizado en tratamientos de irradiación terapéutica. La irradiación con radio tiene un efecto nocivo en las células vivas, y la sobreexposición produce quemaduras. Las células cancerosas, sin embargo, son con frecuencia más sensibles a la radiación que las células normales, y pueden eliminarse sin dañar seriamente los tejidos sanos si se controla y se dirige adecuadamente la radiación. No obstante, el radio se usa ahora únicamente en el tratamiento de unos pocos tipos de cáncer.