Ciencias Naturales ASIGNATURA
Anuncio

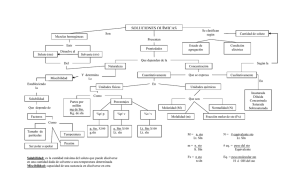
INSTITUTO TÉCNICO MARÍA INMACULADA CIENCIA, VIRTUD Y LABOR PLAN DE CLASE GRADO Undécimo ÁREA: Ciencias Naturales ASIGNATURA: Química TEMA: Concentración de las soluciones TIEMPO: 10 horas DOCENTE: José Beethoven Lerma LOGRO: Adquiere habilidad y destreza para resolver problemas de concentración GUÍA PEDAGÓGICA DE QUÍMICA 1. Motivación: El tema de la concentración de las soluciones, es nuevo en la asignatura de química, pero no en la cotidianidad, ya que a diario nosotros, y específicamente en la cocina de nuestro hogar constantemente preparamos soluciones de diferentes concentraciones, por ejemplo, preparamos una limonada, un jugo de mora, un tinto, etc. Esto significa que tenemos soluciones de diferentes concentraciones, es decir, diferente relación soluto solvente. También encontramos en nuestro hogar varios frascos rotulados así: VINAGRE (ácido acético al 5% m/v), alcohol etílico al 90% v/v, cloruro de magnesio al 15% m/m. Te invito a reflexionar el por qué de estas especificaciones y comprender significativamente el tema que estamos abordando. 2. Lectura: En la biblioteca de tu colegio encuentras el libro de química 1 de norma, procede a leer en la pagina 204 “productos necesarios y peligrosos”, seguidamente desarrolla en tu cuaderno la competencia lectora, averigua por el vocabulario y la profundización. Plantea algunas preguntas sobre el tema de la lectura, entre tus compañeros. 3. Presentación del tema: a. Construye tu mismo el concepto de solución. b. Identifica los componentes de una solución. c. TIPOS DE SOLUCIONES ESTADO FÍSICO DE LA SOLUCIÓN GASEOSO LÍQUIDO SÓLIDO ESTADO FÍSICO DE LOS COMPONENTES PUROS GAS EN GAS LÍQUIDO EN GAS SÓLIDO EN GAS GAS EN LÍQUIDO LÍQUIDO EN LÍQUIDO SÓLIDO EN LÍQUIDO GAS EN SÓLIDO LÍQUIDO EN SÓLIDO SÓLIDO EN SÓLIDO EJEMPLOS AIRE, MEZCLAS GASEOSAS AGUA EN AIRE, BROMO EN CLORO NAFTALENO EN METANO AMONÍACO EN AGUA ALCOHOL EN AGUA AZÚCAR EN AGUA HIDRÓGENO EN PALADIO MERCURIO EN TALIO ORO EN PLATA d. Averigua que es solubilidad e. Cuales son los factores que afectan la solubilidad? De qué depende la velocidad de disolución? f. Concentración de las soluciones: De la concentración de las soluciones dependen las propiedades físicas y químicas. Soluciones diluidas y concentradas: 1 gr de (NaCl) en solución, es una solución diluida cuando se compara con el mismo volumen, de una solución que contenga 20 gr de (NaCl). El término diluido se usa para expresar una solución que contiene una cantidad relativamente pequeña de soluto disuelto. Consecuentemente, una solución concentrada contiene una cantidad relativamente grande de soluto disuelto. Solución saturada, insaturadas y sobresaturadas: Saturada; cuando el soluto disuelto, se encuentra en equilibrio dinámico con el soluto sin disolver. Qué es un equilibrio dinámico? Soluto (sin disolver) Soluto (disuelto) Una solución saturada siempre será una solución concentrada? Insaturada; cuando contiene menos soluto por unidad de volumen, que su correspondiente solución saturada. Sobresaturada; cuando contiene más soluto por unidad de volumen que su correspondiente solución saturada. Qué son propiedades coligativas, y cuales son? CONCENTRACIÓN DE LAS SOLUCIONES EN UNIDADES FÍSICAS a. Porcentaje en masa: es la masa de soluto por 100 gr de solución. Así, una solución de NaOH al 15 por ciento por masa sobre masa, contiene 15 gr de hidróxido de sodio y 85 gr de agua. % m/m = (masa del soluto en gramos / masa de la solución en gramos) x 100 masa de la solución = masa de soluto + masa del solvente Ejemplo: una solución contiene 4,5 gr de NaCl y 90 gr de agua. Calcular el % m/m de la solución. % m/m = gr sto/ gr sln x 100 gr sln = gr sto + gr ste gr sln = 4.5 gr + 90 gr gr sln = 94.5 gr % m/m = 4.5 gr/94.5 gr x 100 % m/m = 4.76 % b. Porcentaje en volumen: significa mililitros de soluto en 100 ml de solución. Así, una solución de alcohol al 40% volumen/volumen, contiene 40 ml de alcohol y 60 ml de agua. % v/v = (volumen del soluto en mililitros / volumen de la solución en mililitros) x 100 Volumen de la solución = volumen de soluto + volumen de solvente Ejemplo: Cual es el porcentaje en volumen de alcohol en una solución que se prepara a partir de 70 ml de alcohol isopropílico en 30 ml de agua. % v/v = v sto/v sln x 100 v sln = v sto + v ste % v/v = 70 ml/100 ml x 100 v sln = 70 ml + 30 ml v sln = 100 ml % v/v = 70% c. Porcentaje masa a volumen: significa la cantidad en gramos de soluto por cada 100 ml de solución. Una solución de Ca(OH) 2 al 25% masa sobre volumen es la que está formada por 25 gr de hidróxido de calcio en 100 ml de solución. % m/v = (masa de soluto en gramos / volumen de la solución en mililitros) x 100 Ejemplo: si en 150 ml de una solución existen 15 gr de ( KI ), cual es el % m/v. % m/v = m sto/v sln x 100 % m/v = 15 gr/ 150 ml x 100 % m/v = 10 d. Partes por millón = miligramos de soluto/kilogramos de solución = miligramos de soluto/ litros de solución. Cuando es necesario medir concentraciones muy pequeñas, como por ejemplo la concentración de cromo en aguas residuales y provenientes de las curtiembres (industria del cuero), se emplea una unidad de concentración denominada partes por millón (ppm). Como su nombre lo indica, expresa el número de partes de masa o volumen de soluto presentes en un millón de partes de solución. Generalmente se expresa en mg/Kg para soluciones sólidas, y en mg/Lt para soluciones líquidas. Ppm = mg sto/Kg sln = mg sto/ lt sln Ejemplo 1: Una solución contiene 10 ppm de ión fosfato ( PO4 )-3. Cuantos miligramos de dicho ión habrá en 250 ml de esta solución. Ppm = 10 ppm = mg sto / lt sln mg sto = ppm x lt sln mg sto = 10 x 0,25 mg sto = 2,5 V sln = 250 ml = 0,25 lt mg sto = ? Ejemplo 2: Una solución de Na3PO4 se prepara disolviendo 16,4 gramos de fosfato de sodio, en 100 gramos de agua. Encuentre las concentraciones en ppm para cada ión asumiendo disociación total. Moles de fosfato n H3PO4 n =WM n=16,4 gr164 gr/n 3 n de Na+ X 1 mol de H3PO4 0,1 mol de H3PO4 1 mol de H3PO4 0,1 mol de H3PO4 Na3PO4 disociación 3Na+ + PO4-3 1 n PO4-3 X x = 0,1 n de Po4-3 x = 0,3 n de Na I mol de Na+ 0,3 mol de Na+ = 0,1 23000 mg X 1 mol de PO4-3 0,1 mol de PO4-3 X = 6900 mg ppm Na=mg stoKg sln 95000 mg X X = 9500 mg ppm Na=69000,1 = 69000 ppm ppm PO4=mg stoKg sln ppm PO4=950000,1 = 950000 ppm Resuelve los siguientes ejercicios utilizando las ppm. Ejemplo 3.Calcular la concentración en partes por millón de cloruro férrico (FeCl3) presente en una muestra de agua analizada por parte de invima, si en 900 ml de solución hay 4,5 mg de la sal. Ejemplo 4. En un análisis que se realizo a una muestra de suelo de 8500 gr se encontró que contenía 2,2 mg de (Pb). Cual es la concentración de (Pb) en ppm? Ejemplo 5. Una muestra de 350 ml de agua contiene 1,5 mg de Mg+2. Cual es la concentración en partes ppm? Ejemplo 6. El límite máximo para el contenido de (Hg) en pescado es 0,5 mg de soluto por millón de mg de alimento. El análisis de un pescado revela que una muestra de 10 gr contiene 72 µgr (microgramos) de Hg. Excede el contenido de Hg de este pescado el limite máximo permitido? CONCENTRACIÓN DE LAS SOLUCIONES EN UNIDADES QUÍMICAS a. Fracción molar. Son las moles de cada componente en una mol de solución. Una solución 0,1 moles de tolueno en dos moles de benceno nos dará estos valores de las correspondientes fracciones molares: 0,048 para el tolueno y 0,952 para el benceno. La suma de las fracciones molares de los componentes de una solución es igual a 1. Ejemplo; se disuelven 15 gr de glucosa en 115 gr de agua. Determinar las fracciones molares de los componentes de la solución. Hallamos las moles de glucosa presentes en 15 gr con la fórmula n = W / PM n = 15 / 180 n = 0,083 moles. Hallamos las moles de agua presentes en 115 gr con la fórmula n = W / PM n = 115 / 18 n = 6,38 moles Sabemos que el soluto en esta solución es la glucosa y el solvente es el agua. Fracción molar de soluto = moles de soluto / moles de soluto + moles de solvente Fracción molar de solvente = moles de solvente / moles de soluto + moles de solvente Remplazamos fracción molar por ( X ) Entonces X sto = n sto / n sto + n ste X sto = 0,083 / 0,083 + 6,38 X sto = 0,012 X ste = 6,38 / 0,083 + 6,38 X ste = 0,987 X sto + X ste = 1 X ste = n ste / n sto + n ste 0,012 + 0,987 = ≈ 1 b. Molaridad. Puede definirse la molaridad de una solución como el número de pesos moleculares gramo (moles) de soluto, disueltos en un litro de solución. Para preparar una solución molar se coloca la cantidad de soluto determinada y se le agrega el solvente hasta completar un litro de solución. La molaridad se representa con la letra (M). Molaridad = moles de soluto / volumen de la solución en litros M = n sto / v sln Ejemplo: cuantos gramos de hidróxido de potasio (KOH) se requieren para preparar 600 ml de una solución 0,45 M M = n sto / v sln n sto = M x v sln n sto = 0,45 x 0,6 lt n sto = 0,27 . Como nos están pidiendo gramos, entonces pasamos las moles de soluto a gramos con la fórmula n = W / PM W = n x PM W = 0,27 n x 56,1 gr/ n W = 15,1 gr de KOH c. Normalidad. La normalidad de una solución (N), es el número de equivalentes gramo de soluto contenido en un litro de solución. Para hallar el peso de un equivalente gramo de un ácido, se calcula dividiendo el peso de una mol de dicho ácido por el número de hidrógenos reemplazables que posea el ácido. Para hallar el peso de un equivalente gramo de una base o hidróxido, se calcula dividiendo el peso de una mol de dicha base por el número de grupos (OH) que contenga la mol. Para hallar el peso de un equivalente gramo de una sal, se calcula dividiendo el peso de un mol de la sal por el número de cargas positivas. Ejemplo: FÓRMULA HCL H2SO4 H3BO3 NaOH Ca(OH)2 Al(OH)3 Al2(SO4)3 Na3PO4 PESO DE UNA MOL 36,4 gr 98 gr 61,8 gr 40 gr 74 gr 78 gr 342 gr 164 gr PESO DE UN EQUIVALENTE GRAMO 36,4 / 1 = 36,4 gr 98 / 2 = 49 gr 61,8 / 3 = 20,6 gr 40 / 1 = 40 gr 74 / 2 = 37 gr 78 / 3 = 26 gr 342 / 6 = 57 gr 164 / 3 = 54,7 gr Zn3(PO4)2 NaCl 386,2 gr 57,5 gr Normalidad = Número de equivalentes / Volumen (lt) 386,2 / 6 = 64,4 gr 57,5 / 1 = 57,5 gr N = # eq. gr / V Ejemplo: determinar el # eq. gr, contenido en 500 ml de una solución 6 N de ácido carbónico. # eq. gr = N x V # eq. gr = 6 x 0,5 # eq. gr = 3 d. Molalidad. Es el número de moles de soluto contenido en un kilogramo de solvente. Ejemplo; una solución formada por 98 gr de ácido sulfúrico (H2SO4) y 1000 gr de agua, es una solución 1 molal ( 1 m ).Una solución que contiene 4 moles de NaCl en 1000 gr de agua es ( 4 m ). La molalidad se representa con la letra (m) minúscula. m = n sto / Kgr ste 1. Ejercicio. Se disuelven 147 gr de ácido sulfúrico en 750 ml de agua. Cual es la molalidad de la solución. n = W / PM n = 147 gr / 98 gr/n m = 1,49 n sto / 0,75 Kg ste n = 1,49 moles de H2SO4 m = 1,98 2. Ejercicio. Calcular la molalidad de una solución preparada por disolución de 29,2 gr de NaCl en 100 gr de agua. n = W/PM n = 29,2 gr/ (58,4 gr/mol) n = 0,5 de NaCl 100 gr de agua = 0,10 Kgr de agua m = n sto / Kgr ste m = 0,5/0,1 m = 5 DILUCIÓN DE SOLUCIONES: Es agregar el volumen adecuado de solvente a una cantidad medida de la solución concentrada. En este caso el número de moles o cantidad de soluto es constante. La solución se va a llevar de unas condiciones iniciales a otras finales. La fórmula para problemas de dilución es la siguiente. V1 x C1 = V2 x C2 Ejemplo: Qué volumen de agua se debe agregar a 10 ml de HCl 12N para preparar una solución 2N ? Solución: V1 = 10 ml de HCl V2 = ? C1 = 12N C2 = 2N Agua que se agrega = V2 - V1 De la ecuación principal despejamos a V2 60 ml - 10 ml = 50 ml V2 = V1 x C1 / C2 V2 = 10 x 12 / 2 V2 = 60 ml Es decir, se deben agregar a la solución 50 ml Desarrolla el siguiente ejercicio: Tenemos 250 ml de H2SO4 en solución 2M. ¿Qué volumen final de ácido 1M se podrá obtener agregando agua?. 4. Aplicación práctica (taller) En el cuadro siguiente, complete los valores correspondientes a cada incógnita utilizando los valores que en él se dan. FÓRMULA SOLUTO KClO3 NaCl % m/m % m/v ? 15 % v/v SOLUTO SOLVENTE 40 gr ? 70 gr SOLUCIÓN 120 ml DENSIDAD KMnO4 AgNO3 KNO3 C2H5OH C3H6O CCl4 KCl 15 20 ? ? ? ? ? 25 gr 13,33 ml 8 ml 2 ml ? ? ? ? 35 2,5 ml 78 gr 320 ml 112 ml 60 ml ? 1,19 gr/ml 0,79 gr/ml 500 ml 1,18 gr/ml En el cuadro siguiente, complete los valores correspondientes a cada incógnita, utilizando los valores que en él se dan, si es necesario. FÓRMULA SOLUTO FÓRMULA SOLVENTE P.M. SOLUTO X STO X STE H2O H2O H2O 101 ? ? ? ? ? ? H2SO4 C2H5OH 98 ? ? H3PO3 H2O 82 KNO3 Na2SO4 KOH Al(OH)3 CANTIDA D STO 202 gr 10 moles 20 gr CANTIDAD STE (M) (N) (m) 900 gr 1000 ml 80 gr ? ? ? ? ? ? ? ? ? 250 gr 500 ml ? ? ? n =? 1 galón 1800 ml gr =? DENSIDAD STO 1,198 gr/ml 1,456 gr/ml 6 5 Desarrolla los siguientes ejercicios de dilución. - Se tienen 100 ml de una solución 2M de NaOH. Cuantos ml de agua se deben agregar para que la solución quede 0,5M? R/ta: 300ml - A qué volumen deben diluirse 20 ml de H2CO3 1,5M para obtener una solución 0,5M R/ta: 60 ml - Cuantos gramos de NaCl se necesitan para preparar 100 ml de una solución 1,2M de esta sal? Qué volumen de agua debe agregarse a dicha solución para diluirla hasta 0,4M? R/ta: 7 gr de NaCl, 200 ml de agua - El jugo gástrico del estomago tiene aproximadamente 0,25% P/V de HCl. Cual es su molaridad? - Cual es la molaridad resultante cuando se mezclan 30 ml de H3PO4 0,5M y 70 ml de H3PO4 0,1M? R/ta 0,22M 5. Síntesis En el siguiente cuadro se resume la fundamentación teórica, en cuanto a las fórmulas para obtener las diferentes concentraciones de las soluciones. RESUMEN DE LAS UNIDADES DE CONCENTRACIÓN NOMBRE Porcentaje en masa Porcentaje en masa - volumen Porcentje en volumen Partes por millón %m/m %m/v %v/v ppm ABREVIATURA Fracción molar de soluto Fracción molar de solvente Molaridad Normalidad Molalidad X sto X ste M N m UNIDADES gr sto/ gr sln x 100 gr sto / ml sln x 100 ml sto / ml sln x 100 mg sto / Kg sln mg sto / lt sln X sto = n sto / n sto + n ste X ste = n ste / n sto + n ste M = n sto / v sln (lt) N = Eq. gr sto / v sln (lt) m = n sto / Kg ste Dilución dsln V1 x C 1 = V2 x C 2 6. Plenaria Mediante una plenaria, donde participen todos los estudiantes de undécimo grado, se socializará el tema de la concentración de las soluciones para observar los avances en el proceso de aprendizaje hacia el logro como es, adquirir habilidades y destrezas para resolver problemas de concentración de las soluciones. Conocidas las posibles dificultades en la consecución de los logros se procederá a retroalimentar la fundamentación teórico practica para llegar a las metas propuestas. 7. Evaluación Para la evaluación de este tema, se tendrá en cuenta el trabajo en clase individual y grupal de los estudiantes, por parte del jurado encargado de la heteroevaluación. El docente también tendrá en cuenta la participación en clase, y el desempeño en las posibles pruebas objetivas que se efectúen. Además la autoevaluación seria, honesta y responsable de cada uno de los estudiantes.