ELECTROQUÍMICA b) en una celda electroquímica Reacciones
Anuncio

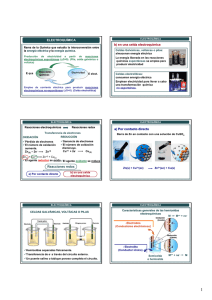
ELECTROQUÍMICA ELECTROQUÍMICA Rama de la Quí Química que estudia la interconversió interconversión entre la energí energía elé eléctrica y la energí energía quí química. mica. Producció Producción de electricidad a partir de reacciones electroquí electroquímicas espontá espontáneas (ΔG<0). (Pila, celda galvá galvánica o voltaica) E qca Reacciones Químicas Electricidad E elect. Empleo de corriente eléctrica para producir reacciones electroquímicas no-espontáneas (ΔG>0). (Celda electrolí electrolítica) ELECTROQUÍMICA Reacciones electroquí Reacciones redox electroquímicas Transferencia de electrones REDUCCIÓ REDUCCIÓN OXIDACIÓ OXIDACIÓN b) en una celda electroquí electroquímica Celdas Galvánicas, voltaicas o pilas: almacenan energía eléctrica La energía liberada en las reacciones químicas espontáneas se emplea para producir electricidad Celdas electrolíticas: consumen energía eléctrica Emplean electricidad para llevar a cabo una transformación química no espontánea. ELECTROQUÍMICA a) Por contacto directo Barra de Zn en contacto con una solución de CuSO4 9Ganancia de electrones 9Pérdida de electrones 9El número de oxidación 9El número de oxidación disminuye. aumenta. Cu(S) Cu+2 + 2eZn(S) – 2eZn+2 Zn(s) + Cu+2 Zn+2 + Cu(s) 9El agente reductor se oxida 9El agente oxidante se reduce Reacciones redox a) Por contacto directo b) en una celda electroquímica ELECTROQUÍMICA CELDAS GALVÁ GALVÁNICAS, VOLTÁ VOLTÁICAS O PILAS Cu2+(ac) + Zn(s) Cu(s) + Zn2+(ac) ELECTROQUÍMICA Caracterí Características generales de las hemiceldas electroquí electroquímicas M Mn+ + ne-Electrodos -Electrodos (Conductores electrónicos) electrónicos) (Conductores 9Hemiceldas separadas físicamente. 9Transferencia de e- a través del circuito externo. 9Un puente salino o tabique poroso completa el circuito. Electrolito -- Electrolito (Conductor iónico) iónico) (Conductor Semicelda o hemicelda Mn+ + ne- M ELECTROQUÍMICA ELECTROQUÍMICA Celda ZnZn-Cu (Pila de Daniell) Fuerza electromotriz (fem), Galvan5.swf Eºcel = 1,103V potencial o voltaje de la celda (Ecelda): diferencia de potencial entre los electrodos de una celda. Se mide en voltios (V) 1V = 1J/C Carga electró electrón = 1,60x10 -19 Coulomb ¿De qué qué depende la fem o Ecelda? 9De la naturaleza de los electrodos Zn(s) Hemicelda anódica Hemicelda catódica Zn2+(ac) + 2e- Cu2+(ac) + 2e- Cu(s) Zn(s) + Cu2+(ac) Zn2+(ac) + Cu(s) Reacció Reacción global 9De la concentración de las especies químicas involucradas. 9De la temperatura ELECTROQUÍMICA ELECTROQUÍMICA Diagrama de celda Condiciones está estándar: Media celda de oxidación 9 T = 25ºC 9 Disoluciones: C = 1M Media celda de reducción 9 Gases: P = 1 atm Celda en condiciones estándar Potencial de la celda Potencial está estándar (Eºcelda) Celda está estándar Fase en menor estado de oxidación Fase en mayor estado de oxidación Límite entre dos fases Fase en Fase en mayor estado menor de oxidación estado de oxidación Límite entre las hemiceldas Para la pila de Daniell Eºcelda = Eº Eºcátodo-Eºánodo ÁNODO CÁTODO Zn / Zn2+(ac,1M) // Cu+2(ac,1M) / Cu ELECTROQUÍMICA Potenciales estándar de electrodo ELECTROQUÍMICA Ejemplos No es posible medir el potencial de un electrodo (o hemicelda) individual Electrodo de referencia: Electrodo está estándar de hidró hidrógeno (EEH) Electrodo normal de hidró hidrógeno (ENH) Reversible, reproducible Pt(s)/H2(1atm)/H+(1M) // Cu2+(1M)/Cu(s) 2 H+ (ac, 1M) + 2 eEº = 0,0 V H2(g, 1 atm) Al conectarlo con otra semicelda: el Eºcelda medido corresponde al potencial estándar del electrodo en cuestión H2(g) + Cu2+(ac) Eºcelda = Eºcátodo- Eºánodo 0,34 V = Eº(Cu2+/Cu) – 0 Cu(s) + 2H+(ac) Eºcelda = Eº(Cu2+/Cu) - Eº(H+/H2) Eº(Cu2+/Cu) = 0,34 V ELECTROQUÍMICA ELECTROQUÍMICA Tabla de potenciales normales de reducció reducción Eº(celda) = 0,76V SEMIRREACCIÓN ELEMENTO F2 Ag Cu H2 Zn/Zn2+(1M) // H+(1M)/ H2(1atm)/Pt(s) Zn(s) + 2H+(ac) Zn Zn2+(ac) + H2 (g) Al Eºcelda = Eº(H+/H2) - Eº(Zn2+/Zn) 0,76 V = 0 - Eº(Zn2+/Zn) Eº(Zn2+/Zn) = -0,76 V Li ELECTROQUÍMICA F2 + 2e- 2F- Ag+ + e- Ag Cu2+ + 2e- Cu 2H+ + e- H2 Zn2+ + 2e- Zn Al3+ + 3e- Al Li+ + e- Li Eº(REDUCCIÓ (REDUCCIÓN) + 2,87 V + 0,80 V + 0,34 V 0,0 V -0,76 V - 1,66 V -3,05 V ELECTROQUÍMICA Potenciales estándar de reducción a 25º C 9 E es una propiedad intensiva. Fuerza oxidante Fuerza reductora Si cambian los coeficientes estequiométricos de una hemirreacción, el valor de E no cambia I2 (s) + 2 e- → 2 I2 I2 (s) + 4 e- →4 E0 = 0,53V I- E0 = 0,53V 9 E es una magnitud termodinámica. Si se invierte el sentido de la reacción cambia el signo. Ered =- E oxid ELECTROQUÍMICA 9 La tabla de potenciales permite predecir si una reacción redox será espontánea, tanto en una celda como por contacto directo de los reactivos, en condiciones estandard. 9 Las hemirreacciones son reversibles. Cada electrodo puede actuar como cátodo o como ánodo, de acuerdo a la naturaleza del otro electrodo involucrado. Ejemplo: Cu2+/Cu0 E0 = +0,34V Ni2+/Ni0 E0 = -0,26V Zn2+/Zn0 E0 = -0,76 V cátodo:Cu; ánodo: Ni cátodo:Ni; ánodo: Zn ELECTROQUÍMICA Potenciales estándar de reducción a 25º C ELECTROQUÍMICA ELECTROQUÍMICA Cu en contacto con una solución de AgNO3 Cu(s) + 2Ag+(ac) Cu2+(ac) + 2 Ag(s) Al en contacto con una solución de CuSO4 2Al(s) + 3Cu2+(ac) 2Al3+(ac) + 3Cu(s) Cu en contacto con solución de Zn(NO3)2 Comportamiento de los metales frente a los ácidos 9Metales con potenciales de electrodo estándar de reducción negativos desplazarán al H2(g) de sus disoluciones ácidas (ácidos no oxidantes) Oxidación: M(s) Reducción: 2H+(ac) Global: Eº (H+/H2) = 0 y Eº(M2+/M) < 0 9El agente oxidante es el H+ ELECTROQUÍMICA Celda Cu-Ag 3(Ag(s) NO3- (ac) + 4H+ (ac) + H2(g) M2+(ac) + H2(g) Eºcelda = Eº (H+/H2) – Eº(M2+/M) > 0 ELECTROQUÍMICA 9Algunos metales que no reaccionan con hidrácidos, reaccionan con ácidos que contienen un anión que es mejor agente oxidante que el H+, por ejemplo HNO3 : + 2e- M(s) + 2H+(ac) Cu(s) + Zn2+(ac) No hay reacción M2+(ac) + 2e- ¿Cómo calculamos el Eº de la celda? Ánodo(-) Cátodo(+) Eºcelda = Eºcátodo- Eºánodo Empleamos potenciales estándar de reducción Ag+(ac) + e-) 3e- 3 Ag (s) + NO3- (ac) + 4H+ (ac) Buen agente oxidante en medio ácido Eºcelda = Eºred. catodo - Eºred. anodo NO(g) +2 H2O 3 Ag+(ac) + NO(g) + 2 H2O Eº(NO3-/NO) = 0,96V Eº(Ag+/Ag) = 0,8 V (Ánodo) Cu(s) Cu2+(ac) + 2e- (Cátodo) 2[Ag+(ac) + eCu(s) + 2Ag+(ac) Eº(Cu2+/Cu) = +0,34V Ag (s)] Eº(Ag+/Ag) = +0,80V Cu2+(ac) + 2 Ag(s) Eºcel= (0,80 – 0,34)V = +0,46V IMPORTANTE! Los valores de Eº no se ven afectados por los cambios de estequiometría de la reacción . ELECTROQUÍMICA Ejemplos ¿Cuál es el significado del valor de E? Calcular fem estándar de las reacciones que se establecen entre los siguientes pares: Eºred Ag+/Ag = 0,80V Eºred Fe2+/Fe Eºred Cr+3/Cr = - 0,45V Termodinámica Relació Relación entre Ecelda y ΔG Proceso espontáneo: ΔG < 0, ΔG = wmax En una celda electroquímica : ΔG = w max = welec = - q. Δvelec =-n.F.Ecelda y Eºred ELECTROQUÍMICA Al+3/Al = -1,66V = - 0,74V Nº de e- transferidos en la reacción carga eléctrica por mol de eF = 96.485 C/mol ∴ΔG ΔG==-nFE nFE ∴ Ecelda celda ΔG < 0 Reacción espontánea E>0 ΔG > 0 Reacción no espontánea E<0 ELECTROQUÍMICA ELECTROQUÍMICA ΔG ==- nFE nFE ΔG Ecelda celda Unidades: Joule = moles de e-(coulomb/ mol e-). voltios J = C.V C = J/V V = J/C - nFEºcelda = -2,303.R.T.log K ΔGº ==- nFE nFEº ΔGº Eºcelda celda Para una celda estándar Ejemplo: en la pila de Daniell Zn(s) + Cu2+(ac) Relación entre Eºcelda y K ΔGº = -RT ln K ΔGº = -nFEºcelda ΔGº = -2,303.R.T.log K R = 8,31 J/K.mol = 8,31VC/Kmol ΔGº = - 2 (96.500 C).1,1 V = - 2. 96.500 (J/V).1,1 V = - 212.300 J = = - 212,3 KJ º E celda ELECTROQUÍMICA ΔG = ΔGº + RT ln Q Q= ΔG = ΔGº + 2,303 RT log Q ΔGº = -n.F.Eº n.F.Eºcelda º Ecelda = Ecelda − 2,303.R.T logQ nF Ecelda = 2,303 R.T ( log K - log Q) nF Si Q = 1: Ecelda = 2,303 R.T . log K K R P nF Q K > 1 Eº > 0 Q = 1 K = 1 Eº = 0 Q = 1 1 R = P Si Q = 1 Ecelda = Eºcelda K < 1 Eº < 0 Q = 1 K P R lo g .T. 3 .R 30 -2, - nF Eº ce lda º Ecelda = Ecelda − º= ΔG ΔG º= ELECTROQUÍMICA K 2 ,303 .R .T . log K nF Eºcelda ΔGº Positivo Negativo >1 Reacció Reacción en condiciones está estándar Espontánea 0 0 =1 Equilibrio Negativo Positivo <1 No espontánea K 0,059V Eºcelda = 2,303 R.T log K nF 1 ELECTROQUÍMICA º = E celda K = 10 Ecelda = Eºcelda - 2,303 R.T log Q nF [Productos] [Reactivos] -n.F.Ecelda = -n.F.Eºcelda + 2,303 RT log Q Dividiendo ambos miembros por (-nF) obtenemos: Relación entre ΔGº, K y Eº Eºcelda n. E 0 celda 0,059V. = logK n ELECTROQUÍMICA Dependencia del potencial de la celda (Ecelda) con las concentraciones. ¿Cómo calcular Ecelda en condiciones nono-está estándar? Ecuació Ecuación de Nernst K = 10 n.F.E0 celda 2,303.R.T Cuando T = 25º 25ºC = 298K el té término: 2,303.R.T/F = 0,059 V Cu(s) + Zn2+(ac) Eº = 1,1 V, n =2 ΔG = -n.F.Ecelda log K = n.F.Eºcelda 2,303 R.T Eºcelda = 2,303 R.T log K nF 2,303.R.T logQ nF Indica la variación del potencial de la celda (Ecelda) con las concentraciones de la misma y con T. Si T = 298K 0 ,059 V º log Q E celda = E celda − n 9Si E y Eº se conocen, se puede determinar la concentración de algunas de las especies involucradas. Ejemplo: Pila de Daniell E = 1,10V – 0,059V log [Zn2+] 2 [Cu2+] ELECTROQUÍMICA ELECTROQUÍMICA La ecuación de Nernst se puede aplicar a un electrodo o hemicelda Cu2+(ac) + 2eCu(s) Zn(s) Zn2+(ac) + 2eZn(s) + Cu2+(ac) Dependencia del la fem con el pH MnO4- + 8H+ + 5e- Zn2+(ac) + Cu(s) ECu = EºCu – 0,059V log 1 2 [Cu2+] ECu↑ si [Cu2+]↑ EZn = EºZn – 0,059V log 1 2 [Zn2+] - EZn EEcelda celda==EE cucu- EZn EZn↑ si [Zn2+]↑ Ered Eºcu––Eº EºZn––0,059V 0,059Vlog log[Zn [Zn2+2+] ] EEcelda celda==Eº cu Zn [Cu2+2+] ] 22 [Cu Eºcelda Eº celda EMn+2/MnO4- = EºMn+2/MnO4- – 0,059V log [Mn+2] 5 [MnO4-][H+]8 EMn+2/MnO4- = Eº – 0,059V log [Mn+2] + 0,059V 8 log[H+] 5 5 [MnO4-] Ecelda↑ si [Cu2+]↑ Ecelda↓ si [Zn2+]↑ Mn+2 + 4H2O pH = -log [H+] EMn+2/MnO4- = Eº – 0,059V log [Mn+2] - 0,059V 8 pH 5 [MnO4-] 5 ELECTROQUÍMICA ELECTROQUÍMICA Celdas de Concentració Concentración CELDAS ELECTROLÍ ELECTROLÍTICAS Utilizan energía eléctrica para producir reacciones químicas no espontáneas. El proceso se denomina electró electrólisis Proceso espontáneo Eº > 0 Pila de Daniell: Zn(s) + Cu2+(ac) Cu(s) + Zn2+(ac) Eºcelda = + 1,103 V Proceso no espontáneo: Cu(s) + Zn2+(ac) Zn(s) + Cu2+(ac) EºZn––Eº EºCu Eºcelda==Eº Eº celda Zn Cu eCátodo (-) Ánodo (+) Eºcelda = - 1,103 V (Eº<0) Ánodo: Cu(s) Cu2+ (ac, 0,1M) + 2e- Cátodo: Cu2+ (ac, 1M) + 2e- Cu(s) Se invierte el sentido de circulación de los e- Global: Cu2+ (ac, 1M) Cu2+ (ac, 0,1M) Voltaje de la bateria V > 1,103 V ELECTROQUÍMICA ELECTROQUÍMICA Electró Electrólisis de NaCl acuoso (concentració (concentración moderada) Electró Electrólisis de NaCl fundido Cátodo (-) Ánodo (+) Celda de Downs → Na+ OHCl2 Ánodo: Cátodo: 2Cl2 (Na+ + e2 Cl- + 2 Na+ Cl2(g) + 2 eNa(liq)) Cl2(g) + Na(liq) PF(NaCl) = 801ºC PF(Na) = 97,8ºC Cl- H2 9 Se libera H2 en el cátodo. 9 En la vecindad del mismo la solución se vuelve básica. 9 Se libera Cl2 en el anódo. 9 Se forma NaOH, como subproducto H+ Reacciones posibles: Cátodo: Na+ Anódo: 2Cl2H2O(l) e- + Na(s) Eº = - 2,71 V 2OH- + H2(g) Eº = - 0,83 V 2H2O(l) + 2 eCl2(g) + 2 eO2(g) + 4 H+(ac) + 4e- Eº = 1,36 V Eº = 1,23 V ELECTROQUÍMICA ELECTROQUÍMICA Eº (V) Reacciones de la celda: Anódo: 2Cl- Cátodo: 2H2O + 2 2Cl- + e- 2H2O Cl2(g) + 2 e- Eº = 1,36 V O2/H20 2OH- Eº = - 0,83 V + H2(g) Cl2/Cl- 0 H20/H2 -0,83 V Cl2(g) + H2(g) Ocurre la reacción que requiere menor voltaje El O2 presenta un sobrepotencial O2/H20 ECl = 1,36 - 0,059 log [Cl-]2 2 [Cl2] ENa = -2,71 + 0,059 log ECl aumenta y supera a EO Cl2/Cl- 0 H20/H2 2H2O(l) 0 H20/H2 Electró Electrólisis del agua Na+/Naº Cl2/Cl- Menor voltaje a aplicar [Na+] O2(g) + 4 2(2H2O(l) + 2 e6 H2O Para altas concentraciones de NaCl No se desprende O2 O2/H20 Se desprende O2 Eºcelda = Ec – Ea = -0,83V –1,36V = -2,19V. Ecelda ≠ Eºcelda Para bajas concentraciones de NaCl Soluciones diluídas H+(ac) + Na+/Naº (ánodo) 4e- 2OH- + H2(g) ) (cátodo) O2 + 2H2 + 4 H+ + 4OH2 H2O O2 + 2H2 Na+/Naº ELECTROQUÍMICA ELECTROQUÍMICA Purificació Purificación electrolí electrolítica del cobre Electró Electrólisis del agua Fuente de corriente Ánodo: Cu impuro Cátodo: Cu puro Reacción Anódica: Reacción Catódica: Cu2+ + 2e- → Cu Cu → Cu2+ + 2e- ELECTROQUÍMICA ELECTROQUÍMICA Baterí Baterías Pila seca o celda de Leclanché Leclanché Primarias: La reacción es irreversible → se agotan Pila seca Pila alcalina Pila de botón Ánodo: Zn Cátodo: C (grafito) Secundarias: Reacciones reversibles, se invierte el sentido por paso de corriente → recargables Electrolito: NH4Cl Emax= 1,55V Acumulador de Pb Baterías de flujo o celdas de combustible: los reactivos, productos y electrolito pasan a través de la celda Celda de hidrógeno Zn(s) Zn2+ + 2e- 2 MnO2(s) + H2O + 2e- Mn2O3(s) + 2OH- 2 MnO2(s) + Zn + 2H2O Mn2O3(s) + 2OH- + Zn2+ ELECTROQUÍMICA ELECTROQUÍMICA Pila de Botón El electrolito es ácido NH4+ + OH- NH3 + H2O Zn2+ + 2NH3 + 2 Cl- [Zn(NH3)2]Cl2 ↓ 9 Se acumulan productos. 9 El amoniaco se adsorbe en los electrodos y modifica la corriente. Ánodo: Zn + 2OH- Cátodo: Ag2O + H2O + 2eZn + Ag2O Electrolito: NaOH o KOH 9 El Zn no se disuelve tan fácilmente en medio alcalino. 9 La batería mantiene su voltaje ELECTROQUÍMICA Acumulador de plomo Batería secundaria utilizada en los automóviles Cátodo: PbO2 Electolito: H2SO4 C: PbO2 (s) + 4H+ + PbSO4 (s) + 2e- SO4= + 2e- Pb(s) + PbO2 (s) + 2H2SO4 descarga carga ZnO + 2Ag Ecelda=1,8V ELECTROQUÍMICA Ánodo: Pb 2Ag + 2OH- 9Reactivos y productos sólidos 9Permite un diseño pequeño Pila alcalina A: Pb(s) + SO4= ZnO + H2O + 2e- PbSO4 (s) + 2H2O 2PbSO4 (s) + 2H2O Ecelda= 2,05V Batería de 12V.Celdas en serie Eº O2/H2O = 1,23V Eº H2O/H2 = -0,83V Celda de hidró hidrógeno