clase 1
Anuncio

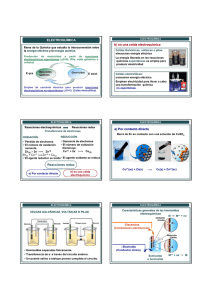
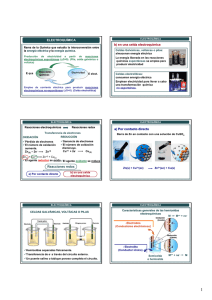
ELECTROQUÍMICA ELECTROQUÍMICA Reacciones electroquí electroquímicas Rama de la Química que estudia la interconversión entre la energía eléctrica y la energía química. REDUCCIÓ REDUCCIÓN OXIDACIÓ OXIDACIÓN Reacciones químicas espontáneas pueden utilizarse para producir electricidad, energía química → energía eléctrica La electricidad puede utilizarse para forzar reacciones químicas no espontáneas, energía eléctrica → energía química Reacciones redox Transferencia de electrones 9Ganancia de electrones 9Pérdida de electrones 9El agente reductor se oxida 9El agente oxidante se reduce 9El número de oxidación 9El número de oxidación disminuye aumenta Reacciones redox a) Por contacto directo ELECTROQUÍMICA a) Por contacto directo Barra de Zn en contacto con una solución de CuSO4 Cu2+(ac) + Zn(s) → Cu(s) + Zn2+(ac) ELECTROQUÍMICA b) en una celda electroquí electroquímica Celdas Galvánicas, voltaicas o pilas: almacenan energía eléctrica La energía liberada en las reacciones químicas espontáneas se emplea para producir electricidad Celdas electrolíticas: consumen energía eléctrica Emplean electricidad para llevar a cabo una transformación química no espontánea. b) en una celda electroquímica ELECTROQUÍMICA ELECTROQUÍMICA CELDAS GALVÁ GALVÁNICAS, VOLTÁ VOLTÁICAS O PILAS Celdas galvánicas o pilas Al cátodo se le da el signo positivo Al ánodo se le da el signo negativo 9 Transferencia de e- a través del circuito externo (conductores de primera especie) 9 Hemiceldas separadas físicamente. Los iones transportan la carga (conductores de segunda especie) 9 Un puente salino o tabique poroso completa el circuito. ELECTROQUÍMICA ELECTROQUÍMICA Celda Zn-Cu (Pila de Daniell) ¿Qué son los 1.103 que muestra el display? Fuerza electromotriz (FEM), potencial o voltaje de la celda (Ecelda): diferencia de potencial entre los electrodos de una celda (en condiciones en las que no circula corriente por el circuito). Una buena aproximación a la FEM se obtiene midiendo la diferencia de potencial entre los electrodos empleando un voltímetro con una alta Zn(s) → Zn2+(ac) + 2 e- Reacción anódica Cu2+(ac) + 2 e- → Cu(s) Reacción catódica Zn(s) + Cu2+(ac) → Zn2+(ac) + Cu(s) Reacción global resistencia interna. ELECTROQUÍMICA ELECTROQUÍMICA La diferencia de potencial se mide en voltios (V) 1V = 1J / C 1 V = diferencia de potencial eléctrico necesaria para impartir un joule de energía a una carga de un coulomb ¿De qué depende el valor de la FEM o Ecelda? 9 De la naturaleza y de la concentración de las especies químicas involucradas. Condiciones estándar: 9 Soluciones: 1M 9 Gases: 1 atm Potencial de celda estándar Celda en condiciones estándar (Eºcelda) Vamos a trabajar con datos a 25 oC El potencial de celda depende del potencial de cada hemirreacción 9 De la temperatura. Eºcelda = Eºcátodo- Eºánodo 9 De la naturaleza de los electrodos. Condiciones estándar Siempre + ELECTROQUÍMICA Diagrama de celda Hemicelda de oxidación Hemicelda de reducción ELECTROQUÍMICA Para extraer energía o trabajo eléctrico de una pila, necesitamos los dos electrodos, no es posible hacerlo con una media celda Necesitamos una media celda de referencia Electrodo estándar de hidrógeno (EEH) Fase en menor estado de oxidación Fase en mayor estado de oxidación Fase en mayor Fase en menor estado de oxidación estado de oxidación Reversible, reproducible H++ (ac, (ac, 1M) 1M) ++ 22 ee-22 H Eº == 0,0 0,0 VV Eº Límite entre dos fases H2(g, (g, 11 atm) atm) H 2 Límite entre las hemiceldas ÁNODO CÁTODO Zn / Zn2+(ac,1M) // Cu+2(ac,1M) / Cu Pt(s)/H2(g,1 atm)/HCl(ac, 1 M) Al conectarlo con otra semicelda en condiciones estándar, el Eºcelda medido corresponderá al potencial estándar de la misma