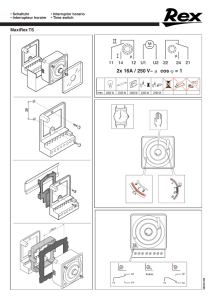
Silverton Spinal Fixation and Silverton-D Deformity
Anuncio

FU7721 0310CE 05 S ve on qxp 10 16 14 2 26 PM Page 1 S ve on Sp na F xa on and S ve on D De o m y Sys ems 1 MPORTANT NFORMAT ON ON THE S VERTON SP NA F XAT ON AND S VERTON D DEFORM TY SYSTEMS • • • Symbol Definition Manufacturer, Fabricante, Hersteller, Fabricant, Fabbricante, Fabrikant • • Authorised Representative in the European Community, Representante autorizado en la Comunidad Europea, Bevollmächtigter in der Europäischen Gemeinschaft, Mandataire dans la Communauté européenne, Rappresentante autorizzato per la Comunità europea, Gevolmachtigd vertegenwoordiger in de Europese Gemeenschap • • Catalogue Number, Numero di catalogo, Bestellnummer, Número de catálogo, Numéro de reference, Catalogusnummer Batch Code, Codice del lotto, Chargenbezeichnung, Código de lote, Numéro de lot, Partijcode CONTENT OR CONTENTS Package Content(s), Contenuto della confezione, Packungsinhalt, Contenido del envase, Contenu de l'emballage, Inhoud van de verpakking O O SHEET 1 o 2 FU7721 0310CE 05 Caution: consult accompanying documents, Attenzione - Consultare la documentazione accompagnatoria, Vorsicht: Begleitdokumente beachten, Precaución: Consulte los documentos acompañantes, Mise en garde : consulter les documents d'accompagnement, Let op: raadpleeg de meegeleverde documenten B ome Sp ne LLC 310 n e ocken Pa kway Su e 120 B oom e d CO 80021 USA 800 447 3625 303 443 7500 www b ome sp ne com Use By, Usare entro, Verwendbar bis, Fecha de caducidad, À utiliser avant le, Uiterste gebruiksdatum Do Not Reuse, Non riutilizzare, Nicht zur Wiederverwendung, No reutilizar, Ne pas réutiliser, Niet opnieuw gebruiken B ome U K L d Wa e on ndus a Es a e B dgend Sou h Wa es CF31 3XA Un ed K ngdom 441 65 66 55 221 Non-Sterile, Non sterile, Unsteril, No estéril, Non sterile, Niet-steriel MPORTANT NFORMAT ON ON THE S VERTON SP NA F XAT ON AND S VERTON D DEFORM TY SYSTEMS S ve on Sp na F xa on and S ve on D De o m y Sys ems Ti-6AI-4V ELI Co-28Cr-6Mo Titanium Alloy, Lega di titanio, Titanlegierung, Aleación de titanio, Alliage de titane, Titaniumlegering Cobalt Chrome Molybdenum Alloy, Lega cobalto-cromo-molibdeno, KobaltChrom-Molybdän-Legierung, Aleación de cobalto-cromo-molibdeno, Alliage de cobalt-chrome-molybdène, Kobaltchroommolybdeenlegering Federal law (USA) restricts this device to sale by or on the order of a physician, La legge federale statunitense limita la vendita di questo dispositivo ai medici o su prescrizione medica, Nach USamerikanischem Bundesgesetz ist der Verkauf dieses Systems auf Ärzte bzw. auf Anweisung eines Arztes beschränkt, Las leyes federales estadounidenses restringen la venta de este dispositivo a médicos o por prescripción facultativa, En vertu de la législation fédérale des ÉtatsUnis, ce dispositif ne peut être vendu que par un médecin ou sur ordonnance médicale, Volgens de Amerikaanse (federale) wetgeving mag dit hulpmiddel alleen door of op voorschrift van een arts worden verkocht English SILVERTON SPINAL FIXATION SYSTEM AND SILVERTON-D DEFORMITY SYSTEM INSTRUCTIONS FOR USE Purpose The Biomet Spinal Fixation System (SFS) (also known as the Silverton and Silverton-D Systems) represents a complete and comprehensive pedicle screw system consisting of implants and instruments to provide vertebral stabilization of spinal segments in skeletally mature patients in the thoracic, lumbar, and sacral spine. As with all orthopedic surgical procedures, detailed preoperative planning is essential. Preoperative diagnostic evaluation followed by carefully executed surgical technique is required. Post-operative care, individualized to suit the particular injury/disease requirements, is essential for optimum outcome. The surgeon must be fully aware of the risks and complications inherent to this type of surgery. Only those individuals with specialized training and experience in spinal surgery should attempt use of the implants. Device Description The Silverton and Silverton-D systems are a posterior attachment spinal fixation system composed of an anatomically scaled series of pedicle screws, hooks, longitudinal rods, set screws, nuts, various connectors, dedicated surgical instruments, and sterilization cases. The components are used to build a construct to provide stabilization of spinal segments in the thoracic, lumbar and sacral spine to support fusion. The Silverton and Silverton-D devices are part of the Biomet Spinal Fixation System, which offers the surgeon a variety of implant components from which to assemble a suitable construct according to each individual patient’s needs and requirements. After a solid fusion occurs, the system serves no functional purpose and should be removed. Removal is indicated because the implants are not intended to transfer or support forces developed during normal activities. However, any decision to remove the device must be made by the physician and the patient, taking into consideration the patient’s general medical condition and the potential risk to the patient of a second surgical procedure. Materials The Silverton and Silverton-D systems are made from titanium alloy described by ISO 5832-3 and ASTM F136 specifications, commercially pure titanium described by ASTM F67 specifications, and cobalt chrome alloy described by ASTM F1537 specifications. Titanium and cobalt chrome may be used together within the same construct. Titanium and cobalt chrome implants should never be used with stainless steel implants. Indications for Use The Silverton and Silverton-D systems are intended to be used to help provide immobilization and stabilization of spinal segments in skeletally mature patients as an adjunct to fusion of the thoracic, lumbar, and/or sacral spine. The system is intended for use with autograft or allograft. The Silverton and Silverton-D systems are intended for posterior, non-cervical (T1-S2/Ilium) pedicle and nonpedicle spinal fixation, to provide immobilization and stabilization of spinal segments in skeletally mature patients as an adjunct to fusion in the treatment of the following instabilities or deformities: degenerative disc disease (DDD, defined as back pain of discogenic origin with degeneration of the disc confirmed by history and radiographic studies); spondylolisthesis; trauma (i.e. fracture or dislocation); spinal stenosis; deformities or curvatures (i.e. scoliosis, kyphosis and/or lordosis); tumor; pseudoarthrosis; and failed previous fusion. Contraindications Contraindications may be relative or absolute. The choice of a particular device must be carefully weighed against the patient’s overall evaluation. Circumstances listed below may reduce the chance of a successful outcome. Contraindications include, but are not limited to: • Allergy to titanium or cobalt chrome alloys, or foreign body sensitivity. Where material sensitivity is suspected, appropriate tests must be made prior to implantation. • Known or suspected infection/immune system incompetence. Acute or chronic infectious diseases of any etiology or localization. • Any abnormality present which affects the normal process of bone remodeling including, but not limited to, severe osteoporosis involving the spine, bone absorption, osteopenia, active infection at the site or certain metabolic disorders affecting osteogenesis. • Morbid Obesity. An overweight or obese patient can produce loads on the spinal system, which can lead to failure of the fixation of the device or failure of the device itself. • Any neuromuscular deficit which places an unusually heavy load on the device during the healing period. • Open Wounds. • Pregnancy. • Any other medical or surgical condition which would preclude the potential benefit of spinal surgery, such as the presence of congenital abnormalities, elevation of sedimentation rate unexplained by other diseases, elevation of the white blood count (WBC), or a marked left shift in the WBC differential count. • Any case requiring the mixing of components from two different systems. • Any case requiring the mixture of stainless steel with titanium, or stainless steel with cobalt chrome implant components. • Fever or leukocytosis. • Signs of local infection or inflammation. • Previous history of infection. • Alcoholism or heavy smoking. • Senility, mental illness or substance abuse, of a severity that the patient may ignore certain necessary limitations and precautions in the use of the implant, leading to failure or other complications. • Any patient unwilling to follow post-operative instructions. • Inadequate tissue coverage over the operative site. Possible Complications Possible complications specific to the device may include: • Early or late implant bending, breakage, failure, loosening or movement/migration • Bone fracture • Allergic reaction to implant material Other general complications associated with any spinal surgical procedure may include: Non-union or delayed union, pseudoarthrosis; pain; second surgery; bleeding; infection, early and late; tissue or nerve damage, including dural tears or other neurological problems; incisional complications; scar formation; damage to blood vessels and cardiovascular system compromise; changes in mental status; damage to internal organs and connective tissue; complications due to the use of bone grafting, including graft donor site complications; respiratory problems; reactions to anesthesia and/or death. Warnings The safety and effectiveness of pedicle screw spinal systems have been established only for spinal conditions with significant mechanical instability or deformity requiring fusion with instrumentation. These conditions are significant mechanical instability or deformity of the thoracic, lumbar and sacral spine secondary to severe spondylolisthesis (grades 3 and 4) of the L5-S1 vertebra, degenerative spondylolisthesis with objective evidence of neurological impairment, fracture, dislocation, scoliosis, kyphosis, spinal tumor, and failed previous fusion (pseudoarthrosis). The safety and effectiveness of these devices for any other conditions are unknown. Patients with previous spinal surgery at the levels to be treated may have different clinical outcomes than previous surgical outcomes. Precautions • The Silverton and Silverton-D implants are for single use only. Never reuse any implant even if it appears unmarked or undamaged. Reuse of the implant components may result in reduced mechanical performance, malfunction, or failure of the device. Any implant implanted and then removed must be discarded. Use only new implants for each case. • The implantation of pedicle screw spinal systems must only be performed by experienced spinal surgeons with specific training in the use of this pedicle screw spinal system due to the technically demanding procedure presenting a risk of serious injury to the patient. • Based on the fatigue testing results, the physician/surgeon must consider the levels of implantation, patient weight, patient activity level, other patient conditions, etc. which may impact on the performance of the system. Preoperatively: The surgeon must be fully conversant with all aspects of the surgical technique and know the indications and contra-indications of this type of implant. The surgeon must have acquainted himself before the operation with the specific technique for insertion of the product, which is available from the manufacturer. As part of the pre-operative examination, the surgeon must check that no biological, biomechanical or other factors will affect the correct conduct of the operation and the post-operative period. An appropriate range of implant sizes must be available at the time of the operation. Intraoperatively: The correct selection of the type and size of implant appropriate to the patient and the positioning of the implant are extremely important. Tapping to size is required for Biomet Turret Screws diameter 8.5mm and larger. Failure to do so could result in damage to the Bone Screw Driver. This may result in patient injury. Failure to place the set screw as instructed (gold top surface is visible prior to insertion) could result in a failure of the instrumentation to properly lock in place as intended. This may result in patient injury. Postoperatively: Patients must be informed of the precautions to be taken in their everyday life to guarantee a maximum implant service life. It is recommended that regular postoperative follow-up is undertaken to detect early signs of failure of the implants and to consider the action to be taken. Deterioration of the device after bone consolidation cannot be considered to constitute a dysfunction or deterioration in the characteristics of the implants. The implant can be removed after bony healing. The Silverton and Silverton-D devices have not been tested for safety and compatibility in the magnetic resonance (MR) environment. The Silverton and Silverton-D systems have not been tested for heating or migration in the MR environment. Mixing of dissimilar metals can accelerate or initiate the corrosion process. Titanium components must NOT be used together in building a construct that involves other implant materials. Titanium and cobalt chrome may be used together within the same construct. Directions for Use The information contained in this package insert is necessary but not sufficient for the use of this device. This information is not intended as a substitute for the professional judgment, skill and experience of the surgeon in: careful patient selection; preoperative planning; device selection; knowledge of the anatomy and biomechanics of the spine; understanding of the material and the mechanical characteristics of the implants used; training and skill in both spinal surgery and use of associated instruments for implantation; securing the patient’s cooperation in following an appropriately defined postoperative management program; and, conducting postoperative follow-up examinations. Record the lot numbers of the implants that were placed in the patient during surgery in the patients chart. Surgical Guidelines Preoperative Procedure The surgeon must be fully conversant with all aspects of the surgical technique and know the indications and contra-indications of this type of implant. The surgeon must be acquainted before the operation with the specific technique for insertion of the product which is available from the manufacturer. As part of the pre-operative examination, the surgeon must check that no biological, biomechanical or other factors will affect the correct conduct of the operation and the post-operative period. An appropriate range of sizes must be available at the time of the operation. Only patients that meet the criteria described in the Indications for Use should be selected. Patient conditions and/or pre-dispositions such as those addressed in the aforementioned contraindications should not be selected. Care should be used in the handling and storage of the Silverton and Silverton-D system components. Implants and instruments should be protected during storage especially from corrosive environments. The type of construct to be assembled for the case should be determined prior to beginning the surgery. The primary surgeon must be fully experienced with the required spinal fusion techniques. Based on the fatigue testing results, the surgeon should consider the levels of implantation, patient weight, patient activity level, other patient conditions, etc. which may have an impact on the performance of the Silverton and Silverton-D system components. An adequate inventory of implant sizes should be available at the time of surgery, including an excess of implant sizes expected to be used and implant sizes larger and smaller than those expected to fit the patient. Review and inspect all instrumentation and implants prior to sterilization. Replace or add any needed components for the planned surgery. Since mechanical parts are involved, the surgeon should be familiar with the various components before using the equipment, and should personally assemble each device to be used to verify that all parts and necessary instruments are present before the surgery begins. Note should be taken to confirm the surgery date with Torque Limiting Handle calibration expiration date. Damaged or defective instruments should not be used. Contact the manufacturer for repair or replacement instructions. All components should be cleaned and sterilized before use. Additional sterile components should be available in case of an unexpected need. Prep, position, and drape the patient in the usual fashion. Operative Procedures The correct selection of the type and size of implant appropriate to the patient and the positioning of the implant are extremely important. Position the patient prone on a radiolucent table and drape in the usual manner. The surgical placement of the Silverton and Silverton-D implants is via posterior exposure of the affected spine. The correct selection of implant size(s) appropriate to the patient and the positioning of the implant are extremely important. Expose the affected area levels via a standard midline incision and tissue dissection. Identify the posterior landmarks, including the pedicles. The Awl is used to penetrate the outer cortex of the pedicle. Locate the pedicle and open a pathway with either the Straight Pedicle Probe or the Curved Pedicle Probe. The Pedicle Probes are laser marked at 10mm intervals to display depth and aid in appropriate screw length selection. Correct rotational insertion of the instrument will allow the probe to follow a path of least resistance without violating the pedicle walls. Utilize the Straight Sounder and/or Curved Sounder to determine the integrity of the pedicle walls and anterior cortex. Taps may be used, although the Biomet Pedicle Screws have a self-tapping tip. Tapping to size is required for Biomet Turret Screws diameter 8.5mm and larger. The Pedicle Screws are inserted with the Bone Screw Driver, which is attached to either the Straight or T Ratcheting Handles. The Bone Screw Driver consists of a Central Shaft, Inner Sleeve, and Outer Sleeve(Straw). Load the Screw onto the Screw Driver by drawing the Inner sleeve with the Outer Sleeve(Straw) upward toward the handle. Orient the prongs of the Screw Driver shaft with the Screw head slots and insert. With the prongs properly seated, the Inner Sleeve assembly is threaded into the Screw head by rotating clockwise. Avoid cross-threading and over tightening. The ratcheting handle must be set for proper rotation direction (clockwise or neutral for insertion). This is accomplished by rotating the metal collar on the handle. Once the desired insertion depth is achieved, the screw can be disengaged from the Screw Driver. While maintaining the position of the ratchet handle and screw driver assembly, unthread the Inner Sleeve from the Screw head and remove. Confirm the appropriate implant location radiographically. Note: For subsequent screw removal or height adjustment, the screw loading sequence must be used. Do not attempt to turn the screw without the sleeve threaded into the Screw head as this may cause the driver tips to be damaged. The polyaxial screw head may be positioned and aligned using the Screw Head Adjuster . Once all the screws are placed, an appropriately sized rod may be chosen. A Rod Template is available to determine the length and curvature of a rod. The Silverton and Silverton-D systems include pre-bent rods in 10mm increments and a 400mm straight rod. The Silverton-D system includes 400mm rigid and malleable rods with a hexagonal end for rod rotation, if required. Rigid 500mm Cobalt Chrome rods are also available. If rod bending/contouring is required, a French Bender or In-situ Benders may be utilized. Using the Rod Inserter, place the selected rod into the Screw heads. If additional insertion is needed, the Rod Holder may be used. Provisional Set Screws may be needed to stabilize the rod. Additional rod manipulation may be needed for Set Screw placement. The Rod Pusher or Set Screw Guide may be used to establish the direct axial pathway to the screw head for Set Screw placement. The Set Screw Guide has a slightly larger distal end that is placed over the screw head and rod. With downward pressure, push the rod into the proper position of the screw head and introduce the Set Screw down the cannulated shaft. The Rod Rocker may be used to introduce the rod into the screw head with the use of a levering action. The Rod Persuader is a powerful device that generates significant force to approximate the screw head and rod. Ensure the instrument is fully disengaged and place arms in the grooves on both sides of the screw head. Gradually squeeze the pistol grip until ratcheting stops. Introduce the Set Screw down the cannulated shaft and provisionally tighten. To disengage the instrument from the screw, release the ratchet lock and rotate the instrument 90 degrees. Once the rod is fully seated, the remaining Set Screws may be placed to secure the rod. The reverse buttress thread design of the Set Screw requires the Set Screw to be oriented correctly prior to insertion. If it is loaded onto the Set Screw Starter upside down, it will not engage the screw head. Ensure the gold top surface is visible prior to insertion. The Set Screw Starter is a self-retaining double-ended instrument designed for initial threading and provisional tightening of the Set Screws. Care must be taken to avoid high torques, as this may damage the instrument tip. When inserting the Silverton-D system malleable and rigid rods, control of the rod and pedicle screw head angulations can be achieved when using the Derotation Wrench on the hexagonal rod end and using the Derotation Tube on the pedicle screw head. Once the rod has been fully seated into all of the polyaxial screw heads and set screws are in place, distraction or compression may be accomplished using either the Distractor or Compressor, respectively. Final tightening is performed using the following three instruments: Counter Torque, Torque Limiting Handle and the Set Screw Tightener. Attach the Torque Limiting Handle to the Set Screw Tightener and insert into the Counter Torque instrument. While retracting the Counter Torque to visualize full engagement of the Set Screw, place the tip of the Set Screw Tightener into the Set Screw for final tightening. Lower the Counter Torque over the screw head engaging the rod and rotate the Torque Limiting Handle clockwise until a snap is heard. Final tightening is accomplished at (9.0 Nm/80 in-lb) (-4/+6%). Either Fixed or Variable Cross Connectors are available. The Fixed version comes in specific lengths for use in situations where rods are parallel; the Variable Cross Connectors can accommodate rods from 40 to 80mm apart. For initial placement or manual tightening of the Cross Connector to the rods, use the Set Screw Driver and back out the Set Screws enough to allow the jaws to adequately encompass the rods. Once the jaws have captured the rods, tighten the Set Screws. Manual tightening of the Variable Cross Connector can be achieved via the central nut using the Central Nut Driver. Final tightening of the Cross Connector may be achieved by using the Torque Limiting Driver (4.5 Nm/40 in-lb) (±5%) in conjunction with the Set Screw Driver for connection to the rods, and the Nut Driver for the central nut, on the Variable Cross Connector. If needed, the Cross Connector Benders may be used. Monoaxial Screws are color coded depending on the screw diameter. Various configurations of screw diameter and lengths are available, ranging from 4.5mm to 8.5mm screw diameters with 25mm to 100mm screw lengths. After the pedicles are prepared, as explained earlier, the Monoaxial Screw is placed using the Mono Bone Screw Driver. If required, the Silverton-D Reduction Screws are available for rod reduction to the screw body or reduction of a spondylolisthesis. Silverton-D Reduction Screws are available in 5.5mm, 6.5mm, and 7.5mm screw diameters with 35mm, 40mm, 45mm, and 50mm screw lengths. After the pedicles are prepared as explained earlier, the Reduction Screws are placed using the Reduction Screw Driver with the Reduction Screw Driver Outer Sleeve(Straw) connected to Ratcheting Handle or T Handle. Following rod reduction, the Set Screws can be secured. To assist in Set Screw alignment with the threads in the head of the Reduction Screw, the Tab Support Ring can be applied and provisional tightening completed. The extended portion of the Reduction Screw can now be removed using the Reduction Screw Tab Pliers. This is accomplished by sliding the Reduction Screw Tab Pliers over each extended tab of the screw head and leveraging first in a medial then lateral direction to avoid possible screw head splay. The medial, lateral action may need to be repeated several times until each tab is broken-off. Final Set Screw tightening can be performed using the Reduction Counter Torque and Torque Limiting Handle, which is calibrated to a torque of (9.0 Nm/80 in-lb) (-4/+6%). Offset Connectors allow lateral and medial variability when connecting screws to a rod. This may be useful when lining-up the screws with hook connection. Closed Offset Connectors must be pre-loaded on the rod prior to placement into the screw or hook head. The Small Set Screws are used for this connection. The regular Set Screws are used to tighten the Open Offset Connectors to the rod. Offset Connectors are offered in three Open lengths of 15mm, 25mm, and 40mm. There is also one Closed Offset Connector with a length of 40mm. After the Offset Connector has been selected and positioned, Set Screw tightening is completed. Open and Closed Offset Connectors use the Set Screw Tightener, and Torque Limiting Handle, (9.0 Nm/80 in-lb) (-4/+6%). Parallel and Axial Connectors are used to either increase the length or approximate two independent rods by joining them together. There are four different configurations of Parallel Connectors and one Axial Connector. After the Rod to Rod Connector has been selected and positioned, Set Screw tightening is completed using the Set Screw Tightener, and Torque Limiting Handle (4.5 Nm/40 in-lb) (±5%). Note: For tightening of the special order items, Parallel Connector Open, and Parallel Connector, Extended Body Open, the Set Screws are tightened using the Set Screw Tightener. Close the wound and dress in the usual fashion. Postoperative Care Ensure that an analgesic, antibiotic, immobilization, and home care regimen is followed. Patients must be informed of the precautions to be taken in their everyday activities to guarantee a maximum implant service life. It is recommended that a routine postoperative follow-up(s) are undertaken to detect early signs of implant failure and to consider appropriate action. Deterioration of the device after bone consolidation cannot be considered to constitute a dysfunction or deterioration in the characteristics of the implant. The implant can be removed after the consolidation of the bone graft. A suitable rehabilitation program must be designed and implemented. The physician’s postoperative directions and warnings to the patient and the corresponding patient compliance are extremely important. Adequately instruct the patient in the appropriate postoperative care. The patient’s ability and willingness to follow instructions are some of the most important aspects of successful healing. Recommended advisories include: • Warn the patient to avoid falls or sudden jolts in spinal position. • Provide detailed instructions on the use and limitations of the device to the patient. If partial weight-bearing is recommended or required prior to firm bony union, the patient must be warned that bending, loosening or breakage of the components are complications which can occur as a result of excessive or early weight-bearing or excessive muscular activity. The risk of bending, loosening, or breakage of an internal fixation device during postoperative rehabilitation may be increased if the patient is active, or if the patient is debilitated, demented, or otherwise unable to use weight supporting devices. • To allow maximum chances for a successful surgical result, the patient or device must not be exposed to mechanical vibrations that may loosen the device construct. Warn the patient of this possibility and instruct them to limit and restrict physical activities, especially those that require lifting, twisting motions and any type of physically demanding sport participation. • Advise the patient not to smoke, utilize nicotine products, and consume alcohol, non-steroids, or antiinflammatory medications, such as aspirin, during the bone graft healing process. • Advise the patient of their inability to bend at the point of spinal fusion and instruct them to compensate for this permanent physical restriction in body motion. If a nonunion develops or if the components loosen, bend, and/or break- revise and/or remove the device(s) immediately before serious injury occurs. Failure to immobilize a delayed nonunion of bone will result in excessive and repeated stresses on the implant. By the mechanism of fatigue these stresses can cause eventual bending, loosening, or breakage of the device(s). The implant may be removed after healing. Particularly in young active patients, implants may loosen, fracture, corrode, migrate, and increase the risk of infection, cause pain, or stress shield bone – even after normal healing. The surgeon must consider the risks and benefits when deciding whether or not to remove an implant. Implant removal must be followed by careful postoperative management to avoid re-fracture. If the patient is older and has a low activity level, the surgeon may elect not to remove the implant in order to eliminate the risks of another surgery. Never reuse explanted surgical implants. Advise patients with implants that they should consider the administration of prophylactic antibiotics before receiving any subsequent surgery (such as dental procedures), for patients who have additional circumstances that increase their risk. The implantation of spinal fixation instrumentation must be performed only by experienced spinal surgeons with specific training in the use of such spinal systems. This is a technically demanding procedure presenting a risk of serious injury to the patient. m • Packaging Check packages for each of the components to ensure that they are intact upon receipt. Carefully check all sets for completeness, and all components for functionality to ensure there is no damage prior to use. Immediately return any damaged packages or products to the manufacturer without using them. Handling and Storage The Silverton and Silverton-D system implants and instruments must be stored with care. Verify the proper function of the specialized surgical instruments needed for the Silverton and Silverton-D systems prior to every surgical procedure. Cleaning and Decontamination The Silverton and Silverton-D implants and instruments are not supplied sterile. All packaging and labeling must be removed before the next steps. Cleaning must be done before processing the implants and instruments for sterilization. Caution: Certain cleaning solutions such as those containing formalin, glutaraldehyde, bleach, and/or other alkaline cleaners may damage some devices, particularly instruments. Such cleaning solutions should not be used. Note: Some instruments may require disassembly prior to cleaning. Machine Cleaning Instructions (Recommended) 1. Prepare cleaning detergent a. Prepare an enzymatic detergent, following the manufacturer’s instructions for preparation and use. b. Saline solutions should NOT be used, as saline has a corrosive effect on stainless steel. c. The detergent should have a near-neutral pH to prevent pitting and tarnishing. 2. Prepare devices for soaking a. To prevent injury, separate out sharp and pointed devices and handle with care. b. Disassemble devices with removable parts. c. Open hinged, toothed or threaded joints. d. Remove heavy or large debris using single-use, non-shedding wipes soaked in appropriate cleaning solution. 3. Clean and soak in bath a. Immerse devices in prepared bath. b. Brush all surfaces of the devices with a cleaning brush (do not use steel brushes) while they are submerged in water, ensuring that all visible soil is removed. c. Whenever applicable: i. Use a pipe cleaner and syringe to clean all cannulae, lumens, crevices, grooves and hard to reach areas. ii. Use a syringe to repeatedly apply rinsing solution under pressure to flush all cannulae, lumens, crevices, grooves and hard to reach areas. iii. Repeatedly operate/bend/articulate movable joints while cleaning. iv. Brush the inside of hollow spaces along their entire length. d. Allow devices to soak in detergent bath for the manufacturer’s recommended soaking time. 4. Load devices into washer a. Place devices so they do not collide during operation. b. Place heavy items at the bottom and hollow objects in the washing machine baskets. c. Ensure no part is obstructed by large objects. d. Place articulating instruments in the fully open position and cannulated instruments horizontally. e. Place disassembled instruments in the washing machine baskets. 5. Washing and drying cycles a. 2 minutes: Prewash with cold water; drain. b. 5 minutes: Detergent wash with hot water; drain. c. 2 minutes: Neutralize with neutral pH detergent; drain. d. 2 minutes: Rinse with hot water; drain. e. Dry with hot air at a maximum of 115°C. 6. Inspect a. Inspect the devices with the naked eye under normal lighting conditions to determine if all adherent visible soil (e.g., blood, protein substances and other debris) has been removed from surfaces, lumen, cannulae, crevices, serrations, threading, etc. b. If visible soil remains, repeat the cleaning procedure. Manual Cleaning Instruction 1. Prepare cleaning detergent a. Prepare an enzymatic detergent, following the manufacturer’s instructions for preparation and use. b. Saline solutions must NOT be used, as saline has a corrosive effect on stainless steel. c. The detergent should have a near-neutral pH to prevent pitting and tarnishing. 2. Prepare devices for soaking a. To prevent injury, separate out sharp and pointed devices and handle with care. b. Disassemble devices with removable parts. c. Open hinged, toothed or threaded joints. d. Remove heavy or large debris using single-use, non-shedding wipes soaked in appropriate cleaning solution. 3. Clean and soak in bath a. Immerse devices in prepared bath. b. Brush all surfaces of the devices with a cleaning brush (do not use steel brushes) while they are submerged in water, ensuring that all visible soil is removed. c. Whenever applicable: i. Use a pipe cleaner and syringe to clean all cannulae, lumens, crevices, grooves and hard to reach areas. ii. Use a syringe to repeatedly apply rinsing solution under pressure to flush all cannulae, lumens, crevices, grooves and hard to reach areas. iii. Repeatedly operate/bend/articulate movable joints while cleaning. iv. Brush the inside of hollow spaces along their entire length. d. Allow devices to soak in detergent bath for the manufacturer’s recommended soaking time. 4. Rinse a. Remove the devices from the soak bath. b. Thoroughly rinse the devices under running water for a minimum of 1 minute. c. Thoroughly flush cannulae, lumens and holes. 5. Ultrasonic bath a. Prepare an ultrasonic bath containing a blood-dissolving detergent, following the manufacturer’s instructions for preparation and use. b. Cover/seal the devices during transport from the rinse to the ultrasonic bath to prevent contamination. c. Place devices in the ultrasonic bath. d. Ensure that the devices are completely submerged and do not overlap. e. Sonicate for 15 minutes. To avoid corrosion, do not exceed 15 minutes. 6. Rinse in sterile water a. Thoroughly rinse the devices with sterile purified water (i.e., RO or DI) for a minimum of 3 minutes. 7. Dry a. Dry the devices with single-use, non-shedding absorbent wipes and/or medical compressed air (e.g., interiors of cannulae). b. Be sure to completely dry the devices immediately after rinse to inhibit corrosion. 8. Inspect a. Inspect the devices with the naked eye under normal lighting conditions to determine if all adherent visible soil (e.g., blood, protein substances and other debris) has been removed from surfaces, lumen, cannulae, crevices, serrations, threading, etc. b. If visible soil remains, repeat the cleaning procedure. Sterilization The Silverton and Silverton-D implants and instruments are provided non-sterile and must be cleaned and sterilized prior to use. The recommended sterilization process is steam autoclave sterilization, using the parameters listed in the tables below. Use of an FDA-cleared wrap is recommended to maintain sterility prior to use. Silverton and Silverton-D System Implant, Instrument, and Set Sterilization Parameters Method Cycle Temperature Exposure Time Minimum Dry Time Steam PreVacuum 132° C (270° F) 10 minutes 55 minutes Steam Gravity 132° C (270° F) 15 minutes 55 minutes Where Immediate Use Steam Sterilization (IUSS) is needed, each of the Silverton and Silverton-D Manual Surgical Instruments may be sterilized individually using the following sterilization parameters. Silverton and Silverton-D System Single Instrument IUSS Parameters Method Cycle Temperature Exposure Time Steam PreVacuum 132˚ C (270˚ F) 3 minutes The recommended sterilization cycles have been validated to assure a Sterility Assurance Level (SAL) of at least 10-6. Product Complaints Communicate suspected deficiencies in the product quality, identity, durability, reliability, safety, effectiveness, and/or performance directly to Biomet Spine by email: spinecomplaints@biomet.com, +1.866.956.7579. When filing a complaint, please provide the component name(s), part number(s), lot number(s), your name and address, the nature of the complaint, surgeon name and the date you became aware of the complaint. Sterilize and return all component(s) to your local Biomet Spine representative or distributor. Notify Biomet Spine immediately of an incident resulting in patient death or serious injury. Surgical Technique Manual The surgical technique guide may be obtained by contacting Biomet Spine customer service (contact information is provided below). Further Information If further directions for use of this system are needed, contact Biomet Spine Customer Service by email: spinecustomerservice@biomet.com, Tel: +1.303.443.7500, Fax: +1.303.443.7501. ©2014 Biomet Spine, LLC. All Rights Reserved. mm N m M C G m m m Descrizione del dispositivo I sistemi Silverton e Silverton-D sono sistemi di fissazione spinale con attacco posteriore composti da una serie anatomicamente dimensionata di viti peduncolari, ganci, barre longitudinali, viti di fissaggio, dadi, connettori di diverso tipo, strumenti chirurgici dedicati e contenitori per la sterilizzazione. I diversi componenti vengono usati per allestire una struttura in grado di stabilizzare segmenti spinali del rachide toracico, lombare e sacrale per promuovere la fusione ossea. I dispositivi Silverton e Silverton-D fanno parte del sistema di fissazione spinale Biomet, il quale offre al chirurgo una gamma diversificata di componenti implantari con cui assemblare la struttura più idonea alle esigenze e ai requisiti di ciascun paziente. Una volta conseguita una fusione stabile, i sistemi dovranno essere rimossi, venendo a mancare lo scopo funzionale del loro utilizzo. La rimozione è indicata perché gli impianti non sono concepiti per il trasferimento o il supporto delle forze sviluppate durante le normali attività del paziente. La decisione di rimuovere i dispositivi dovrà tuttavia essere presa dal medico e dal paziente, tenendo conto delle condizioni mediche generali di quest’ultimo e del potenziale rischio insito in un secondo intervento chirurgico. Materiali I sistemi Silverton e Silverton-D sono fabbricati in lega di titanio conforme alle specifiche ISO 5832-3 e ASTM F136, in titanio commercialmente puro conforme alle specifiche ASTM F67 e in lega di cromo-cobalto conforme alle specifiche ASTM F1537. Il titanio e il cromo-cobalto possono essere usati insieme all’interno della stessa struttura. Non utilizzare mai impianti di titanio e cromo-cobalto insieme ad impianti in acciaio inossidabile. P m m m m m m mm m m m m m m m m m m m Rm m m – m m m m m N – m mm m m m m U m m m m P B m B m m NON m m mm m m m D P m m mm mm m m m m mm m O m m m m m m U m Rm m m H mm m C m – m m m N m U m mm m mm m mm m m m D m m m C m C mm m m m m m m m m m m m m – – –N –R m m m m m m m C m m m m m H m m m m m m m m C m m m D m m m m m m m mm D Q m N m m m M m P m m m m D m m m m m m m m m m m U m m m m m m m P m m m m m NON m D m m m m m m m m m mm m P H mm m C mm m m m m m D U D m m R m m Rm m m m m + % Nm mm P mm mm m mm mm m m m m m mm m O U m m mm Nm ± % m m m m m m m mm mm m mm m m mm U mm m R m Rm mm m D Avvertenze La sicurezza e l’efficacia dei sistemi spinali con viti peduncolari sono state stabilite solo per condizioni spinali con significativa instabilità meccanica o deformità che richiedono la fusione con apposita strumentazione. Le condizioni di cui sopra riguardano una significativa instabilità meccanica o deformità del rachide toracico, lombare e sacrale, secondaria a una grave spondilolistesi (grado 3 e 4) delle vertebre L5-S1, spondilolistesi degenerativa con evidenza oggettiva di menomazioni neurologiche, frattura, dislocazione, scoliosi, cifosi, tumori spinali e pregresse fusioni non riuscite (pseudoartrosi). La sicurezza e l’efficacia di questi dispositivi per qualsiasi altra condizione non sono note. I pazienti che hanno subito precedenti interventi chirurgici agli stessi livelli del rachide possono presentare esiti clinici diversi rispetto a quelli dei precedenti interventi. R D m m m m U Linee guida per il chirurgo Procedura preoperatoria Il chirurgo deve avere completa dimestichezza con tutti gli aspetti della tecnica chirurgica ed essere al corrente delle indicazioni e controindicazioni relative a questo tipo di impianto. Prima dell’intervento, il chirurgo dovrà essersi documentato in merito alla particolare tecnica di inserimento dell’impianto, recuperando le informazioni dal produttore. Nell’ambito della prassi preoperatoria, il chirurgo dovrà accertarsi che nessun fattore biologico, biomeccanico o di altro tipo possa influenzare il corretto andamento dell’intervento e della fase post-operatoria. Al momento dell’intervento si dovrà disporre di un’adeguata gamma di impianti di diverse dimensioni. Devono essere selezionati solo i pazienti che soddisfano i criteri descritti nella sezione Indicazioni per l’uso. Evitare pazienti con le condizioni e/o le predisposizioni elencate nella sezione Controindicazioni. Maneggiare e conservare con cura i componenti dei dispositivi Silverton e Silverton-D. Durante l’immagazzinaggio, gli impianti e gli strumenti devono essere protetti in particolar modo da eventuali agenti corrosivi. Il tipo di struttura da assemblare per il caso specifico deve essere determinato prima dell’intervento. Il responsabile dell’equipe chirurgica deve avere una solida esperienza in materia di tecniche di fusione spinale. In base ai risultati delle prove di fatica, il chirurgodeve considerare i livelli di impianto, il peso del paziente e i suoi livelli di attività, oltre ad altre condizioni del paziente che possono influire sulle prestazioni dei componenti Silverton e Silverton-D. Al momento dell’intervento chirurgico, tenere a disposizione una scorta adeguata di impianti di dimensioni diverse, inclusi imp m m m m m Controindicazioni Le controindicazioni possono essere relative o assolute. La scelta di un particolare dispositivo deve essere attentamente soppesata sulla base di una valutazione globale del paziente. Le circostanze elencate di seguito possono ridurre le probabilità di esito positivo dell’intervento. Segue un elenco non esaustivo delle possibili controindicazioni. • Allergia alle leghe di titanio o cromo-cobalto, o ipersensibilità ai corpi estranei. In caso di sospetta ipersensibilità al materiale si dovranno eseguire test idonei prima dell’impianto. • Infezione nota o sospetta/incompetenza del sistema immunitario. Patologie infettive acute o croniche di qualsiasi eziologia o localizzazione. • Qualsiasi anomalia presente in grado di influire sul normale processo di rimodellamento osseo comprese, tra l’altro, le seguenti: grave osteoporosi con coinvolgimento della colonna vertebrale, assorbimento osseo, osteopenia, infezioni attive nel sito dell’impianto o specifici disordini metabolici con effetto sull’osteogenesi. • Obesità morbosa. Nei pazienti in sovrappeso o obesi possono generarsi carichi eccessivi sul sistema spinale, con conseguente mancato fissaggio del dispositivo o cedimento del dispositivo stesso. • Qualsiasi deficit neuromuscolare che provochi un carico eccezionalmente gravoso sul dispositivo durante il periodo di guarigione. • Ferite aperte. • Stato di gravidanza. • Qualsiasi altra condizione medica o chirurgica che possa precludere i potenziali benefici della chirurgia spinale, come la presenza di anomalie congenite, l’incremento del tasso di sedimentazione non attribuibile ad altre patologie, l’incremento della conta dei globuli bianchi o un marcato spostamento verso sinistra nella conta differenziale dei globuli bianchi. • Qualsiasi situazione che richieda l’impiego congiunto di componenti di due sistemi diversi. • Qualsiasi situazione che richieda l’impiego congiunto di componenti implantari in acciaio inossidabile e titanio, o acciaio inossidabile e cromo-cobalto. • Febbre o leucocitosi. • Segni di infezione o infiammazione localizzate. • Pregresse infezioni documentate. • Alcolismo o tabagismo grave. • Senilità, malattia mentale o abuso di sostanze di gravità tale da impedire al paziente di attenersi alle limitazioni o alle precauzioni necessarie nell’uso dell’impianto, con conseguente rottura o altre complicazioni. • Pazienti incapaci o non disposti ad aderire alle istruzioni postoperatorie. • Copertura tissutale inadeguata sul sito operatorio. Indicazioni per l’uso Le informazioni contenute in questo foglio illustrativo sono necessarie all’uso del dispositivo, ma non sono sufficienti. Queste informazioni non sono da intendersi come un sostituto del giudizio, dell’abilità e dell’esperienza professionale del chirurgo per quanto riguarda gli aspetti seguenti: un’accurata scelta del paziente, una corretta pianificazione preoperatoria, la scelta del dispositivo, la conoscenza dell’anatomia e della biomeccanica della colonna vertebrale, la conoscenza del materiale e delle caratteristiche meccaniche degli impianti da utilizzare, un’adeguata formazione ed esperienza in materia di chirurgia spinale e nell’uso degli strumenti associati all’impianto, la garanzia della cooperazione del paziente nell’applicazione del programma post-operatorio più consono e l’esecuzione di esami di follow-up. Registrare i numeri di lotto degli impianti inseriti nel paziente durante l’intervento chirurgico nella scheda del paziente. m m m m D m m m N Precauzioni • Gli impianti Silverton e Silverton-D sono esclusivamente monouso. Non riutilizzare mai un impianto, anche quando non presenta segni o danni. Il riutilizzo dei componenti dell’impianto può comportare una riduzione delle prestazioni meccaniche, il malfunzionamento o il fallimento del dispositivo. I dispositivi impiantati e successivamente espiantati devono essere gettati. Usare solo impianti nuovi per ogni caso. • L’impianto di sistemi spinali con viti peduncolari deve essere eseguito solo da chirurghi esperti in chirurgia spinale che abbiano ricevuto una formazione specifica nell’uso di questi sistemi; l’elevata tecnicità della procedura di impianto, infatti, è caratterizzata da un potenziale rischio di gravi lesioni per il paziente. • In base ai risultati delle prove di fatica, il medico/chirurgo deve considerare i livelli di impianto, il peso del paziente e i suoi livelli di attività, oltre ad altre condizioni del paziente che possano influire sulle prestazioni del sistema. • Fase preoperatoria – Il chirurgo deve avere completa dimestichezza con tutti gli aspetti della tecnica chirurgica ed essere al corrente delle indicazioni e controindicazioni relative a questo tipo di impianto. Prima dell’intervento, il chirurgo dovrà essersi documentato in merito alla particolare tecnica di inserimento dell’impianto, recuperando le informazioni dal produttore. Nell’ambito della prassi preoperatoria, il chirurgo dovrà accertarsi che nessun fattore biologico, biomeccanico o di altro tipo possa influenzare il corretto andamento dell’intervento e della fase post-operatoria. Al momento dell’intervento si dovrà disporre di un’adeguata gamma di impianti di diverse dimensioni. • Fase intraoperatoria – La scelta corretta del tipo e della dimensione dell’impianto in funzione del paziente, nonché il posizionamento dell’impianto stesso sono fattori di estrema importanza. • Per le viti Turret Biomet con diametro pari o superiore a 8,5 mm è necessario l’impiego di maschiatori. In caso contrario il cacciavite peduncolare potrebbe subire danni, con la conseguente possibilità di lesioni al paziente. • Il posizionamento della vite di fissaggio non conforme a quanto indicato (con la superficie superiore dorata visibile prima dell’inserimento) può ostacolare il blocco della strumentazione nella posizione prevista, con la conseguente possibilità di lesioni al paziente. • Fase post-operatoria – I pazienti devono essere informati in merito alle precauzioni da osservare nella vita quotidiana allo scopo di garantire la massima vita utile dell’impianto. Si consiglia di effettuare un regolare follow-up post-operatorio allo scopo di individuare precocemente eventuali segni di fallimento degli impianti e pianificare le misure da adottare. Il deterioramento del dispositivo dopo il consolidamento osseo non deve essere considerato una disfunzione o un deterioramento delle caratteristiche dell’impianto. L’impianto può essere rimosso una volta completata la guarigione dell’osso. • La sicurezza e la compatibilità dei dispositivi Silverton e Silverton-D nell’ambiente di risonanza magnetica (RM) non sono state verificate. La sicurezza e la compatibilità dei sistemi Silverton e Silverton-D relativamente al riscaldamento o alla migrazione negli ambienti adibiti alla risonanza magnetica (MR) non sono state testate. • L’utilizzo contemporaneo di metalli diversi può accelerare o innescare il processo di corrosione. I componenti in titanio NON devono essere usati per l’allestimento di strutture in cui siano presenti altri materiali implantari. Il titanio e il cromo-cobalto possono essere usati insieme all’interno della stessa struttura. m m P m D m G m Indicazioni per l’uso I sistemi Silverton e Silverton-D sono concepiti per essere utilizzati come supporto nella fissazione e nella stabilizzazione di segmenti spinali in pazienti scheletricamente maturi, come ausilio aggiuntivo nella fusione del rachide toracico, lombare e/o sacrale. Il sistema è concepito per l’uso con autoinnesti o alloinnesti. I sistemi Silverton e Silverton-D sono concepiti per la fissazione spinale posteriore, non cervicale (T1-S2/ilio) peduncolare ed extrapeduncolare, allo scopo di garantire la fissazione e la stabilizzazione di segmenti spinali in pazienti scheletricamente maturi, come supporto alla fusione nel trattamento delle seguenti instabilità o deformità: discopatie degenerative (DDD, definite come lombalgie di origine discogena con degenerazione del disco confermate da anamnesi e analisi radiografiche), spondilolistesi, traumi (es. fratture o dislocazioni), stenosi spinali, deformità o curvature (es. scoliosi, cifosi e/o lordosi), tumori, pseudoartrosi e pregresse fusioni non riuscite. Possibili complicanze Le possibili complicanze correlate specificatamente al dispositivo possono comprendere: • Precoce o tardiva curvatura, rottura, fallimento, allentamento o spostamento/migrazione dell’impianto • Frattura ossea • Reazione allergica ai materiali dell’impianto Altre complicanze generali associate agli interventi di chirurgia spinale possono comprendere: non-unione o unione ritardata, pseudoartrosi, dolore, necessità di reintervento, emorragia, infezione, precoce e tardiva, danni ai tessuti o ai nervi (compresa la lacerazione durale o altri problemi neurologici), complicanze a livello dell’incisione, formazione di cicatrici, danni ai vasi sanguigni e compromissione del sistema cardiovascolare, alterazioni dello stato mentale, danni agli organi interni e al tessuto connettivo, complicanze dovute all’impiego di innesti ossei (comprese le complicanze del sito donatore), problemi respiratori, reazioni all’anestesia e/o morte. m m Scopo Il sistema di fissazione spinale (SFS) Biomet (noto anche come Silverton e Silverton-D) si propone come un sistema completo ed esaustivo di viti peduncolari, consistente in impianti e strumenti atti a fornire la stabilizzazione vertebrale di segmenti spinali in pazienti scheletricamente maturi, a livello del rachide toracico, lombare e sacrale. Come per tutte le procedure chirurgiche ortopediche, è essenziale una dettagliata pianificazione preoperatoria. È necessaria una valutazione diagnostica preoperatoria seguita da una tecnica chirurgica eseguita con cura. Per ottenere risultati ottimali è inoltre indispensabile un trattamento post-operatorio individualizzato, adatto alle particolari esigenze della lesione/patologia in questione. Il chirurgo deve essere pienamente consapevole dei rischi e delle complicanze inerenti al tipo di intervento. L’inserimento degli impianti dovrà essere eseguito solo da personale con un’adeguata formazione ed esperienza in materia di chirurgia spinale. All trademarks are the property of Biomet, Inc. or one of its subsidiaries, unless otherwise indicated. Rx Only. m m SISTEMA DI STABILIZZAZIONE VERTEBRALE SILVERTON E SISTEMA PER DEFORMITÀ SILVERTON-D mm mm mm D mm U mm m mm m mm m m B m m m D m m m m C m m m m m m mm m m m R m mm Nm + % m m m m m m m m Q m m m m m m mm m mm m m mm mm U m N mm m m m Nm m + % m m m m D m m N mm Nm ± % G m m – m C mm m m m m m m m m m m D G m m m m m m m m m m m C N m m m + m m N m m B m m m m m m m @ m m m m m B m mm m m B m m m m M mm B m m R m m N m mm m m mm m m m U m m m m m m m m m m m m mm m m m m © m B m m + B m + C m B m R ON W RB U N G BR UCH N UNG m m mm m ON M UND R ON D D ORM NB H ND UNG M m m w D m m B m D m C m mm W m m w B m O m= m w m W m m R m D m m m mm m @ m m m m m m m N C m N m m m C D m m m m m m m • mm m m C m m R m m mm C m • m M m • m D m m m m m D m m m m C m m m • • • m m P m m C m mm m m D D Q m m m m m C w m m m M m m D m P m m m m m U m m D m m m m m m mB W D O B G D C m Um w W m m m m U m mm w m R m m m m mm w 1 FU7721 0310CE 05 S ve on qxp 10 16 14 2 26 PM Page 2 Beschreibung des Systems Die Silverton- und Silverton-D-Systeme sind posterior anzubringende Wirbelsäulenfixationssysteme, die aus einer Reihe anatomisch skalierter Pedikelschrauben, Haken, Längsstäben, Stellschrauben, Muttern, verschiedener Verbinder, speziell dafür vorgesehenen chirurgischen Instrumenten und Sterilisationsdosen besteht. Die Komponenten werden verwendet, um ein Konstrukt zur Stabilisierung von Wirbelsegmenten im Brust-, Lenden- und Sakralwirbelbereich herzustellen, das die Fusion unterstützt. Das Silverton und das Silverton-D sind Teil des BiometWirbelsäulenfixationssystems, das unterschiedliche Implantatkomponenten enthält, aus denen der Chirurg ein für den Bedarf und die Anforderungen jedes individuellen Patienten geeignetes Konstrukt zusammenstellen kann. Nach Eintritt einer soliden Fusion ist das System funktionell nicht länger von Bedeutung und sollte entfernt werden. Die Entfernung ist indiziert, da die Implantate nicht dazu bestimmt sind, die im Laufe der normalen Aktivitäten entstehenden Kräfte zu übertragen bzw. aufzunehmen. Allerdings muss jede Entscheidung hinsichtlich der Entfernung vom Arzt und vom Patienten getroffen und hierbei der allgemeine medizinische Zustand des Patienten und das potenzielle Risiko eines zweiten chirurgischen Eingriffs für den Patienten berücksichtigt werden. Materialien Die Silverton- und Silverton-D-Systeme bestehen aus einer Titan-Legierung gemäß den Spezifikationen der ISONorm 5832-3 und der ASTM-Norm F136, aus handelsüblichem Reintitan gemäß den Spezifikationen der ASTM-Norm F67 und aus einer Kobaltchromlegierung gemäß den Spezifikationen der ASTM-Norm F1537. Titan- oder KobaltChrom-Komponenten können in ein und demselben Konstrukt verwendet werden. Implantatkomponenten aus einer Titan- oder Kobaltchromlegierung dürfen in keinem Fall mit Edelstahlimplantaten kombiniert werden. Anwendungsbereiche Die Silverton- und Silverton-D-Systeme unterstützen die Immobilisierung und Stabilisierung von Wirbelsegmenten bei Patienten mit ausgereiftem Skelettsystem als Ergänzung zur Fusion im Brust-, Lenden- und/oder Sakralwirbelbereich. Das System ist für die Verwendung mit Auto- oder Allotransplantat vorgesehen. Die Silverton- und Silverton-D-Systeme sind für die posteriore, nicht im Bereich der Halswirbelsäule (T1S2/Ilium) gelegene Wirbelsäulenfixation mit und ohne Einbindung der Pedikel zur Herstellung der Immobilisierung und Stabilisierung von Wirbelsegmenten bei Patienten mit ausgereiftem Skelettsystem als Ergänzung zur Fusion bei der Behandlung von folgenden Instabilitäten oder Deformitäten vorgesehen: degenerative Bandscheibenerkrankung (DDD, definiert als Rückenschmerz diskogenen Ursprungs in Verbindung mit anamnestisch und bildgebend bestätigter Degeneration der Bandscheibe), Spondylolisthese, Trauma (d.h. Fraktur oder Luxation), Spinalstenose, Deformitäten oder Krümmungen (d.h. Skoliose, Kyphose und/oder Lordose), Tumor, Pseudarthrose und gescheiterte vorangegangene Fusion. Kontraindikationen Kontraindikationen können relativ oder absolut sein. Die Wahl eines bestimmten Systems muss sorgfältig gegen das Gesamtergebnis der Untersuchung des Patienten abgewogen werden. Die nachstehend aufgeführten Umstände können die Chance eines erfolgreichen Behandlungsergebnisses schmälern. Zu den Kontraindikationen gehören unter anderem: • Allergie gegen Titan- oder Kobaltchromlegierungen oder Fremdkörperempfindlichkeit. Wenn eine Materialempfindlichkeit vermutet wird, sind vor der Implantation entsprechende Tests durchzuführen. • Bekannte oder vermutete Infektion/Immunschwäche. Akute oder chronische infektiöse Krankheiten jedweder Ätiologie oder Lokalisierung. • Jede vorhandene Anomalie, welche den normalen Vorgang des Knochenaufbaus beeinflusst, einschließlich unter anderem einer schweren Osteoporose mit Einbeziehung der Wirbelsäule, Knochenabsorption, Osteopenie, aktiver Infektion am Implantatsitus oder bestimmter, die Osteogenese beeinflussender Stoffwechselkrankheiten. • Krankhafte Adipositas. Bei einem übergewichtigen bzw. adipösen Patienten ist das Wirbelsystem unter Umständen so starken Belastungen ausgesetzt, dass es zu einem Versagen der Fixierung des Systems oder zu einem Versagen des Systems selbst kommen kann. • Jedes neuromuskuläre Defizit, durch welches das System während der Heilungsphase ungewöhnliche starken Belastungen ausgesetzt ist. • Offene Wunden. • Schwangerschaft. • Jeder sonstige medizinische oder chirurgische Zustand, der einen möglichen Nutzen von Wirbelsäulenoperationen von vornherein ausschließt, z.B. das Vorhandensein angeborener Anomalien, erhöhte Blutsenkung unbekannter Ätiologie, Erhöhung der Leukozytenzahl (LEU) oder eine deutliche Linksverschiebung des LEU-Differenzialblutbilds. • Jede Situation, bei der eine Kombination mit Komponenten aus zwei verschiedenen Systemen erforderlich wäre. • Jede Situation, bei der eine Kombination von Edelstahl- mit Titan- oder von Edelstahl- mit KobaltchromImplantatkomponenten erforderlich wäre. • Fieber oder Leukozytose. • Anzeichen einer lokalen Infektion oder Entzündung. • Infektion in der Krankengeschichte. • Alkoholismus oder starke Raucher. • Senilität, Geisteskrankheit oder Substanzmissbrauch, die so stark ausgeprägt sind, dass der Patient möglicherweise bestimmte erforderliche Einschränkungen und Vorsichtsmaßnahmen bei der Anwendung des Implantats ignoriert, was zu Versagen oder anderen Komplikationen führt. • Nichtbereitschaft eines Patienten zur Einhaltung der postoperativen Anweisungen. • Unzureichende Gewebeabdeckung über der Operationsstelle. Mögliche Komplikationen Es können folgende, für das System spezifische Komplikationen auftreten: • Frühe(s)(r) oder späte(s)(r) Verbiegen, Bruch, Versagen, Lockerung oder Verschiebung/Migration des Implantats • Knochenfraktur • Allergische Reaktion gegen Implantatmaterial Weitere allgemeine Komplikationen in Verbindung mit jedem chirurgischen Wirbelsäulenverfahren umfassen: verzögerte oder Nichteinbindung, Pseudarthrose, Schmerzen, Folgeoperation, Blutungen, frühe und späte Infektionen, Gewebe- oder Nervenschäden, einschließlich Durariss oder anderer neurologischer Probleme, Inzisionskomplikationen, Narbenbildung, Schädigung von Blutgefäßen und Beeinträchtigung des Herz-Kreislauf-Systems, Veränderungen des Geisteszustands, Schädigung von inneren Organen und Bindegewebe, Komplikationen durch die Verwendung von Knochentransplantaten, einschließlich Komplikationen an der Entnahmestelle des Transplantats, Atemprobleme, Reaktionen auf die Anästhesie und/oder Tod. Warnhinweise Die Sicherheit und Wirksamkeit von Wirbelfixierungssystemen unter Anwendung von Pedikelschrauben ist nur für Wirbelsäulenerkrankungen/-zustände mit erheblicher mechanischer Instabilität oder Deformität belegt, die einer Fusion unter Einsatz von Instrumenten bedürfen. Bei diesen Erkrankungen handelt es sich um erhebliche mechanische Instabilitäten oder Deformitäten in der Brust-, Lenden- und Sakralwirbelregion als Folge einer schweren Spondylolisthese (Grad 3 und 4) im Wirbelbereich L5-S1, einer degenerativen Spondylolisthese mit objektivem Nachweis einer neurologischen Störung, Fraktur, Luxation, Skoliose, Kyphose, eines spinalen Tumors und einer gescheiterten vorangegangenen Fusion (Pseudarthrose). Für jegliche sonstige Erkrankungen sind Sicherheit und Wirksamkeit dieser Systeme nicht bekannt. Patienten mit vorangegangenen Wirbelsäulenoperationen an den zu behandelnden Ebenen weisen im Vergleich zu den klinischen Ergebnissen der vorangegangenen Operationen gegebenenfalls andere klinische Ergebnisse auf. Vorsichtsmaßnahmen • Die Silverton- und Silverton-D-Implantate sind nur für den Einmalgebrauch bestimmt. Implantate keinesfalls wiederverwenden, auch wenn sie unmarkiert sind oder unbeschädigt aussehen. Die Wiederverwendung von Implantatkomponenten kann zu einer verringerten mechanischen Leistung, Fehlfunktion oder Versagen des Implantats führen. Implantate, die eingesetzt und wieder entfernt wurden, müssen entsorgt werden. Bei jedem Eingriff muss ein neues Implantat verwendet werden. • Die Implantation von Wirbelfixierungssystemen unter Anwendung von Pedikelschrauben darf nur von einem erfahrenen Wirbelsäulenchirurgen vorgenommen werden, der in der Anwendung dieses PedikelschraubenWirbelfixierungssystems spezifisch geschult wurde, da es sich hierbei um ein technisch anspruchsvolles Verfahren handelt, das mit dem Risiko schwerwiegender Verletzungen des Patienten einhergeht. • Die Ergebnisse von Ermüdungstests weisen darauf hin, dass die folgenden Aspekte vom Chirurgen gründlich zu erwägen sind: die Implantationsebenen, das Gewicht des Patienten und dessen Aktivitätsniveau und andere Patientenbedingungen usw., die sich auf die Leistung des Systems auswirken können. • Präoperativ: Der Chirurg muss mit allen Aspekten des chirurgischen Verfahrens vertraut und genau über die Indikationskriterien und Kontraindikationen für diese Art von Implantat informiert sein. Der Chirurg muss sich vor der Operation mit der spezifischen Technik für das Einsetzen des Produktes vertraut gemacht haben. Angaben zu dieser Technik sind vom Hersteller erhältlich. Der Chirurg muss sich im Rahmen der präoperativen Untersuchung vergewissern, dass keine biologischen, biomechanischen oder anderen Faktoren vorliegen, welche die fachgerechte Durchführung der Operation sowie die postoperative Phase beeinflussen könnten. Zum Zeitpunkt der Operation müssen Implantate in einem geeigneten Größenspektrum vorrätig sein. • Intraoperativ: Die korrekte Auswahl eines Implantats in der für den Patienten geeigneten Art und Größe sowie seine korrekte Positionierung sind von größter Bedeutung. • Bei Biomet-Turretschrauben der Größen ab 8,5 mm muss ein passendes Gewinde vorgeschnitten werden. Wird dies versäumt, kann es zu Schäden am Knochenschraubendreher kommen. Dies kann zu Verletzungen des Patienten führen. • Wird die Stellschraube nicht gemäß der Anweisung (goldene Oberseite vor der Einbringung sichtbar) platziert, führt dies gegebenenfalls dazu, dass das Instrumentarium nicht ordnungsgemäß wie vorgesehen festgestellt werden kann. Dies kann zu Verletzungen des Patienten führen. • Postoperativ: Die Patienten müssen auf die Vorsichtsmaßnahmen, die sie im Alltag befolgen müssen, hingewiesen werden, um eine maximale Lebensdauer des Implantats zu garantieren. Es wird empfohlen, sich nach der Operation regelmäßigen Nachuntersuchungen zu unterziehen, um frühe Anzeichen eines Implantatversagens zu erkennen und geeignete Maßnahmen in Betracht zu ziehen. Eine Beeinträchtigung des Systems nach Knochenkonsolidierung kann nicht als Fehlfunktion oder Verschlechterung der Implantateigenschaften gewertet werden. Das Implantat kann nach dem Ausheilen des Knochens entfernt werden. • Die Silverton- und Silverton-D-Implantate wurden nicht hinsichtlich ihrer Sicherheit und Kompatibilität in einer Magnetresonanz (MR)-Umgebung überprüft. Die Silverton- und Silverton-D-Systeme wurden nicht auf Erwärmung oder Migration in einer MR-Umgebung überprüft. • Eine Kombination von unterschiedlichen Metallen kann den Korrosionsprozess beschleunigen oder auslösen. Titankomponenten dürfen NICHT parallel für die Erstellung eines Konstrukts verwendet werden, das andere Implantatmaterialien einbezieht. Titan- oder Kobalt-Chrom-Komponenten können in ein und demselben Konstrukt verwendet werden. Gebrauchsanleitung Die Packungsbeilage enthält wichtige Informationen. Bei diesen Informationen handelt es sich jedoch nicht um eine ausreichende Beschreibung für die Verwendung des Systems. Diese Informationen dienen nicht als Ersatz für die professionelle Beurteilung, Fachkenntnis und Erfahrung des Chirurgen in den folgenden Bereichen: sorgfältige Patientenauswahl, präoperative Planung, Geräteauswahl, Kenntnisse der Anatomie und Biomechanik der Wirbelsäule, Verständnis des Materials und der mechanischen Eigenschaften der einzusetzenden Implantate, Ausbildung und Fachkenntnis sowohl in der Wirbelsäulenchirurgie als auch in der Verwendung der damit verbundenen Implantationsinstrumente; Sicherstellung der Kooperation des Patienten in der Befolgung eines angemessen definierten postoperativen Versorgungsprogramms und Durchführung von postoperativen Nachuntersuchungen. Die Chargennummern der dem Patienten während der Operation eingesetzten Implantate sind in der Patientenakte zu vermerken. Chirurgische Leitlinien Präoperatives Verfahren Der Chirurg muss mit allen Aspekten des chirurgischen Verfahrens vertraut und genau über die Indikationskriterien und Kontraindikationen für diese Art von Implantat informiert sein. Der Chirurg muss sich vor der Operation mit der spezifischen Technik für das Einsetzen des Produktes vertraut gemacht haben. Angaben zu dieser Technik sind vom Hersteller erhältlich. Der Chirurg muss sich im Rahmen der präoperativen Untersuchung vergewissern, dass keine biologischen, biomechanischen oder anderen Faktoren vorliegen, welche die fachgerechte Durchführung der Operation sowie die postoperative Phase beeinflussen könnten. Zum Zeitpunkt der Operation müssen Implantate in einem geeigneten Größenspektrum vorrätig sein. Es sollten nur Patienten ausgewählt werden, die die beschriebenen Indikationskriterien für das Verfahren erfüllen. Patienten, bei denen die als Kontraindikationen genannten Bedingungen und/oder Prädispositionen vorliegen, sollten nicht ausgewählt werden. Die Silverton- und Silverton-D-Komponenten sind mit Vorsicht zu handhaben und aufzubewahren. Implantate und Instrumente müssen an einem sicheren Ort und vor Korrosion geschützt aufbewahrt werden. Die genaue Art des Konstrukts, die im jeweiligen Fall verwendet wird, muss vor Beginn der Operation bestimmt werden. Der verantwortliche Chirurg muss über profunde Erfahrung in jedem Aspekt der erforderlichen Wirbelsäulenfusionstechniken verfügen. Die Ergebnisse von Ermüdungstests weisen darauf hin, dass die folgenden Aspekte vom Chirurgen gründlich zu erwägen sind: die Implantationssegmente, das Gewicht des Patienten und dessen Aktivitätsniveau und andere Patientenbedingungen usw., die sich auf die Leistung der Komponenten des Silverton und des Silverton-D auswirken können. Zum Zeitpunkt der Operation sollten unterschiedliche Größen des Implantats in ausreichender Menge vorrätig sein. Insbesondere sollten zusätzliche Implantate in der voraussichtlich verwendeten Größe sowie in den angrenzenden Größen vorhanden sein. Das gesamte Instrumentarium und alle Implantate sind vor der Sterilisation zu überprüfen und zu inspizieren. Für die geplante Operation erforderliche Komponenten gegebenenfalls auswechseln oder ergänzen. Da das System mechanische Teile aufweist, sollte sich der Chirurg vor der Verwendung der Ausrüstung mit den verschiedenen Komponenten vertraut machen und vor der Operation jedes zu verwendende Implantat persönlich zusammensetzen, um sicherzustellen, dass alle Teile und notwendigen Instrumente vorhanden sind. Es muss darauf geachtet werden, dass die Kalibrierung des Drehmomentgriffs zum Zeitpunkt der Operation noch gültig ist. Beschädigte oder defekte Instrumente dürfen nicht verwendet werden. Informationen zu Reparaturen oder Ersatzteilen sind vom Hersteller erhältlich. Alle Komponenten müssen vor der Verwendung gereinigt und sterilisiert werden. Für den Notfall sollten außerdem zusätzliche sterile Komponenten vorrätig sein. Den Patienten in der üblichen Weise vorbereiten, positionieren und drapieren. sorgfältiger postoperativer Umgang folgen, um eine erneute Fraktur zu vermeiden. Bei älteren Patienten mit niedrigem Aktivitätsgrad kann sich der Chirurg dafür entscheiden, das Implantat nicht zu entfernen, um die Risiken einer erneuten Operation zu eliminieren. Explantierte chirurgische Implantate dürfen nicht wiederverwendet werden! Die Patienten mit Implantaten unterrichten, dass vor jedem weiteren chirurgischen Eingriff (wie bei Operationen im Dentalbereich) die prophylaktische Verabreichung von Antibiotika in Erwägung gezogen wird, insbesondere für Patienten, deren Risiko aufgrund sonstiger Umstände erhöht ist. Die Implantation eines Instrumentariums zur Wirbelsäulenfixation darf nur von erfahrenen Wirbelsäulenchirurgen durchgeführt werden, die über eine spezielle Ausbildung im Umgang mit derartigen Wirbelsäulensystemen verfügen. Es handelt sich um ein technisch anspruchsvolles Verfahren, das ein Risiko von schwerwiegenden Verletzungen des Patienten birgt. Operationsverfahren Die korrekte Auswahl eines Implantats in der für den Patienten geeigneten Art und Größe sowie seine korrekte Positionierung sind von größter Bedeutung. Den Patienten in Bauchlage auf einem röntgenstrahldurchlässigen Tisch positionieren und in der üblichen Weise abdecken. Die chirurgische Platzierung der Silverton- und Silverton-D-Implantate erfolgt über die posteriore Freilegung des betroffenen Wirbelsäulenbereichs. Die korrekte Auswahl der für den Patienten geeigneten Implantatgröße sowie seine korrekte Positionierung sind von größter Bedeutung. Die betroffenen Ebenen mittels eines gewöhnlichen Medianschnitts und Gewebedissektion freilegen. Posteriore Referenzpunkte, einschließlich der Pedikel identifizieren. Die Ahle wird zur Penetration des äußeren Pedikelkortex verwendet. Den Pedikel lokalisieren und entweder mit der geraden Pedikelsonde oder der geschwungenen Pedikelsonde einen Zugangsweg eröffnen. Die Pedikelsonden verfügen über Lasermarkierungen in 10-mm-Intervallen, um die Tiefe anzuzeigen und die Wahl der geeigneten Schraubenlängen zu erleichtern. Durch die korrekte Einbringung des Instruments unter Anwendung von Drehbewegungen folgt die Sonde dem Weg des geringsten Widerstandes, ohne die Pedikelwände zu verletzen. Zur Bestimmung der Integrität der Pedikelwände und des anterioren Kortex ist die gerade Sonde und/oder die geschwungene Sonde zu verwenden. Auch wenn die Pedikelschrauben von Biomet über eine selbstschneidende Spitze verfügen, können Gewindebohrer eingesetzt werden. Bei Biomet-Turretschrauben der Größen ab 8,5 mm muss ein passendes Gewinde vorgeschnitten werden. Die Pedikelschrauben werden mithilfe des Knochenschraubendrehers eingebracht, der an dem geraden oder dem T-Ratschengriff angebracht ist. Der Knochenschraubendreher besteht aus einem mittleren Schaft, einer Innenhülse und einer Außenhülse (Halm). Den Schraubendreher durch Ziehen der Innenhülse zusammen mit der Außenhülse (Halm) nach oben in Richtung Griff mit der Schraube laden. Die Zacken des Schraubendreherschafts auf die Schraubenkopfschlitze ausrichten und einsetzen. Die Innenhülseneinheit mit ordnungsgemäß eingesetzten Zacken im Uhrzeigersinn in den Schraubenkopf eindrehen. Verschneiden und Überdrehen vermeiden. Der Ratschengriff muss für die ordnungsgemäße Drehrichtung (für den Einsatz im Uhrzeigersinn oder neutral) eingestellt werden. Dies wird durch Drehen des am Griff befindlichen Metallkragens erreicht. Sobald die gewünschte Einsatztiefe erreicht wurde, kann der Schraubendreher von der Schraube gelöst werden. Die Innenhülse unter Beibehaltung der Position des Ratschengriffs und des Schraubendrehers vom Schraubenkopf lösen und entfernen. Die ordnungsgemäße Lage des Implantats röntgenographisch überprüfen. Hinweis: Für die anschließende Entfernung der Schraube oder Höhenverstellung muss die Schraubenladesequenz verwendet werden. Nicht versuchen, die Schraube ohne die angebrachte Hülse in den Schraubenkopf zu drehen, da dies die Spitze des Drehers beschädigen kann. Der Polyaxialschraubenkopf kann mithilfe des Schraubenkopf-Einstellschlüssels positioniert und ausgerichtet werden. Nachdem alle Schrauben positioniert wurden, kann ein Stab geeigneter Größe ausgewählt werden. Zur Bestimmung der Stablänge und -krümmung ist eine Stabschablone erhältlich. Die Silverton-und Silverton-D-Systeme enthalten vorgebogene Stäbe in Abstufungen von 10 mm und einen geraden 400-mm-Stab. Das Silverton-D-System enthält starre und formbare 400-mm-Stäbe mit einem Sechskantanschluss für die Stabdrehung, falls notwendig. Außerdem sind starre 500-mm-Kobalt-Chrom-Stäbe erhältlich. Bei Bedarf kann ein verstellbarer Stabbieger oder Insitu-Bieger zum Biegen/Konturieren des Stabs verwendet werden. Den gewünschten Stab mithilfe des Stabeinsetzinstruments in die Schraubenköpfe einsetzen. Falls ein zusätzlicher Einsatz notwendig ist, kann der Stabhalter verwendet werden. Zur Stabilisierung des Stabes werden gegebenenfalls provisorische Stellschrauben benötigt. Für die Positionierung der Stellschrauben bedarf es womöglich einer zusätzlichen Manipulierung des Stabs. Die Stabschieber- oder Stellschraubenführung kann verwendet werden, um den direkten axialen Zugangsweg zum Schraubenkopf zum Zwecke der Stellschraubenpositionierung festzulegen. Die Stellschraubenführung weist ein leicht größeres distales Ende auf, das über den Schraubenkopf und den Stab gelegt wird. Den Stab mittels Abwärtsdruck in die richtige Position des Schraubenkopfes drücken und die Stellschraube in den kanülierten Schaft einführen. Der Stab kann mithilfe des Stab-Rockers und unter Anwendung der Hebelwirkung in den Schraubenkopf eingesetzt werden. Der Stab-Persuader ist ein leistungsstarkes Gerät, das erhebliche Kraft zur Angleichung des Schraubenkopfes mit dem Stab ausübt. Vergewissern Sie sich, dass das Instrument vollständig entsperrt ist und setzen Sie die Haltezungen in die Nuten an beiden Seiten des Schraubenkopfes ein. Den Pistolengriff allmählich anziehen, bis die Ratsche stoppt. Die Stellschraube in den kanülierten Schaft einsetzen und provisorisch festziehen. Um das Instrument von der Schraube abzunehmen, Ratschenverschluss lösen und das Instrument um 90 Grad drehen. Nachdem der Stab vollständig platziert wurde, können die restlichen Stellschrauben zur Sicherung des Stabes angebracht werden. Die Ausführung der Stellschraube mit gegenläufigem Sägezahngewinde erfordert, dass sie vor der Einbringung korrekt ausgerichtet wird. Wenn sie kopfstehend auf den Stellschraubenstarter aufgesetzt wird, wird der Schraubenkopf nicht festgehalten. Es ist sicherzustellen, dass die goldene Oberseite vor der Einbringung sichtbar ist. Der Stellschraubenstarter ist ein selbstrastendes doppelseitiges Instrument, das zum Ansetzen der Stellschrauben in das Gewinde dient und sie provisorisch anzieht. Es ist sorgfältig darauf zu achten, hohe Drehmomente zu vermeiden, da diese Schäden an der Instrumentenspitze zur Folge haben können. Während des Einsatzes der starren und formbaren Stäbe des Silverton-D-Systems dient der Derotationsschlüssel am Sechskantende des Stabes in Verbindung mit dem Derotationstubus am Pedikelschraubenkopf zur Kontrolle der Winkelung des Stabes und des Pedikelschraubenkopfes. Sobald der Stab vollständig in alle Polyaxialschraubenköpfe eingesetzt wurde und die Stellschrauben positioniert wurden, kann eine Distraktion oder Kompression mithilfe des Distraktors oder Kompressors entsprechend erzielt werden. Der Endanzug erfolgt unter Verwendung der folgenden drei Instrumente: Gegenmomentgriff, Drehmomentgriff und Stellschrauben-Festzieher. Den Drehmomentgriff am Stellschrauben-Festzieher anbringen und in das Gegenmomentinstrument einsetzen. Während der Gegenmomentgriff für den visuellen Nachweis des Eingriffs der Stellschraube zurückgezogen wird, die Spitze des StellschraubenFestziehers für den Endanzug in die Stellschraube einsetzen. Den Gegenmomentgriff über dem Schraubenkopf absenken, sodass er den Stab überspannt, und den Drehmomentgriff im Uhrzeigersinn drehen, bis ein Klicken zu hören ist. Der Endanzug erfolgt bei (9,0 Nm/80 in-lbs) (-4/+6%). Erhältlich sind feste oder verstellbare Querverbinder. Die feste Version ist in bestimmten Längen für den Einsatz in Situationen verfügbar, in denen die Stäbe parallel verlaufen, wohingegen die verstellbaren Querverbinder Stäbe in Abständen von 40 mm bis 80 mm aufnehmen können. Zur anfänglichen Platzierung oder manuellen Befestigung des Querverbinders an den Stäben den Stellschraubendreher benutzen, um die Stellschrauben so weit zurückzuziehen, dass genügend Platz für die Aufnahme der Stäbe in den Backen vorliegt. Die Stellschrauben nach erfolgter Aufnahme der Stäbe in den Backen festziehen. Der manuelle Anzug des verstellbaren Querverbinders kann über die Hauptmutter unter Verwendung des entsprechenden Drehers erzielt werden. Für den Endanzug des Querverbinders dient der Drehmomentgriff (4,5 Nm/40 in-lbs) (±5%) in Verbindung mit dem Stellschraubendreher für den Anschluss an die Stäbe, und der Mutterdreher für den Anzug der Hauptmutter auf dem verstellbaren Querverbinder. Bei Bedarf können Querverbinderbiegezangen verwendet werden. Die Monoaxialschrauben sind je nach Schraubendurchmesser farblich gekennzeichnet. Die Schrauben sind in verschiedenen Gewindedurchmesser- und Längenkonfigurationen erhältlich: Gewindedurchmesser von 4,5 mm bis 8,5 mm in Schraubenlängen von 25 mm bis 100 mm. Nachdem die Pedikel, wie bereits erläutert, präpariert wurden, wird die Monoaxialschraube mithilfe des Mono-Knochenschraubendrehers platziert. Bei Bedarf sind Silverton-D-Reduzierschrauben zum Zwecke der Stabreduktion auf den Schraubenkörper bzw. der Reduktion einer Spondylolisthese erhältlich. Silverton-D-Reduzierschrauben sind mit einem Gewindedurchmesser von 5,5 mm, 6,5 mm und 7,5 mm in Schraubenlängen von 35 mm, 40 mm, 45 mm und 50 mm verfügbar. Nachdem die Pedikel, wie bereits erläutert, präpariert wurden, werden die Reduzierschrauben mithilfe des Reduzierschraubendrehers in Verbindung mit der am geraden oder T-Ratschengriff angebrachten Außenhülse (Halm) des Reduzierschraubendrehers platziert. Nach erfolgter Stabreduktion können die Stellschrauben gesichert werden. Um die Stellschrauben leichter auf die Schraubenkopfgewinde der Reduzierschrauben ausrichten zu können, kann der Laschenstützring angebracht und die Schrauben provisorisch angezogen werden. Der erweiterte Abschnitt der Reduzierschraube kann nun mithilfe der Zange für Reduzierschraubenlaschen entfernt werden. Dies wird durch Schieben der Zange für Reduzierschraubenlaschen über die herausragende Lasche des Schraubenkopfes und Hebeln zuerst in medialer und dann in lateraler Richtung zur Vermeidung möglicher Abkantungen des Schraubenkopfes erzielt. Um die einzelnen Laschen zu entfernen, muss die mediale-laterale-Hebelbewegung gegebenenfalls mehrfach wiederholt werden. Der abschließende Stellschraubenanzug kann mithilfe des Gegenmomentreduzierers und des Drehmomentgriffs, dessen Drehmoment auf (9,0 Nm/80 in-lbs) (-4/+6%) eingestellt ist, durchgeführt werden. Die Offset-Verbinder ermöglichen die laterale und mediale Verstellbarkeit während der Verbindung der Schrauben mit einem Stab. Diese Verstellbarkeit ist bei der Angleichung von Schrauben und Hakenverbindung nützlich. Die geschlossenen Offset-Verbinder müssen auf der Stange vor der Platzierung im Schrauben- oder Hakenkopf vorinstalliert werden. Für diese Verbindung werden die kleinen Stellschrauben verwendet. Die regulären Stellschrauben werden verwendet, um die geöffneten Offset-Verbinder am Stab zu befestigen. Offset-Verbinder sind in drei offenen Längen erhältlich: 15 mm, 25 mm und 40 mm. Erhältlich ist auch ein geschlossener Offset-Verbinder mit einer Länge von 40 mm. Nach erfolgter Wahl und Positionierung des Offset-Verbinders werden die Stellschrauben abschließend angezogen. Offene und geschlossene Offset-Verbinder werden mithilfe des Stellschrauben-Festziehers und des Drehmomentgriffs (9,0 Nm/80 in-lbs) (-4/+6%) gehandhabt. Parallel- und Axialverbinder dienen zur Verlängerung oder Angleichung zweier separater Stäbe, indem sie verbunden werden. Es stehen vier verschiedene Konfigurationen von Parallelverbindern und ein Axialverbinder zur Verfügung. Nach erfolgter Auswahl und Positionierung des Stab-zu-Stab-Verbinders wird der Endanzug der Stellschrauben mithilfe des Stellschrauben-Festziehers und des Drehmomentgriffs (4,5 Nm/40 in-lbs) (±5%) durchgeführt. Hinweis: Zur Befestigung von Sonderteilen, offener Parallelverbinder und offener Parallelverbinder mit erweitertem Körper werden die Stellschrauben mithilfe des Stellschrauben-Festziehers angezogen. Die Wunde in der üblichen Weise schließen und verbinden. Verpackung Packungen nach Erhalt überprüfen, um sicherzustellen, dass sämtliche Komponenten fehlerfrei sind. Alle Sets sorgfältig auf Vollständigkeit und alle Bestandteile vor Gebrauch auf ihre Funktionsfähigkeit überprüfen, um sicherzustellen, dass sie unbeschädigt sind. Beschädigte Packungen oder Produkte sofort an den Hersteller zurücksenden, ohne sie zu gebrauchen. Postoperative Versorgung Die Befolgung einer adäquaten Verordnung von Schmerzmitteln, Antibiotika, Immobilisierung und ambulanter Pflege muss sichergestellt werden. Die Patienten müssen auf die Vorsichtsmaßnahmen, die sie im Alltag befolgen müssen, hingewiesen werden, um eine maximale Lebensdauer des Implantats zu garantieren. Es wird empfohlen, sich nach der Operation regelmäßigen Nachuntersuchungen zu unterziehen, um frühe Anzeichen eines Implantatversagens zu erkennen und geeignete Maßnahmen in Betracht zu ziehen. Eine Funktionsbeeinträchtigung des Systems nach Knochenkonsolidierung kann nicht als Fehlfunktion oder Verschlechterung der Implantateigenschaften gewertet werden. Das Implantat kann nach der Konsolidierung des Knochentransplantats entfernt werden. Es muss ein geeignetes Rehabilitationsprogramm erstellt und umgesetzt werden. Die dem Patienten vom Arzt erläuterten postoperativen Anweisungen und Warnhinweise sowie deren Einhaltung durch den Patienten sind von größter Bedeutung. Dem Patienten die geeignete postoperative Versorgung auf angemessene Art und Weise erläutern. Fähigkeit und Bereitschaft des Patienten zur Befolgung der Anweisungen sind zwei der wichtigsten Aspekte für eine erfolgreiche Heilung. Die empfohlenen Anweisungen umfassen u.a. Folgende: • Der Patient ist vor den Gefahren von Stürzen oder ruckartigen Stößen zu warnen. • Der Patient muss ausführlich über die Verwendung und die Einschränkungen des Implantats informiert werden. • Falls eine Teilbelastung vor Festigung der Knochenfusion empfohlen oder erforderlich ist, muss der Patient auf die Komplikationen durch Verbiegen, Ablösung oder Bruch der Komponenten aufgrund von übermäßiger oder frühzeitiger Belastung bzw. übermäßigen Muskelaktivitäten hingewiesen werden. Ein erhöhtes Verbiege, Ablösungs- und Bruchrisiko einer internen Fixation während der postoperativen Rehabilitation besteht vor allem bei aktiven Patienten, bei geschwächten, dementen oder anderweitig eingeschränkten Patienten und Patienten, die keine sonstigen Hilfsmittel zur Gewichtsabstützung verwenden. • Um die Aussichten auf ein erfolgreiches Ergebnis der Operation zu maximieren, sollte der Patient sich keinen mechanischen Vibrationen aussetzen, die ein Ablösen der Systemkonstruktion bewirken könnten. Der Patient muss vor den möglichen Konsequenzen gewarnt und angewiesen werden, körperliche Aktivitäten einzuschränken. Dies gilt insbesondere für das Heben von Gegenständen, das Verdrehen des Körpers und jegliche sportliche Betätigung. • Der Patient sollte angewiesen werden, während des Heilungsprozesses für das Knochentransplantat nicht zu rauchen, keine Nikotinprodukte zu verwenden, keinen Alkohol zu trinken und keine nicht-steroidalen oder entzündungshemmenden Medikamente (z.B. Aspirin) einzunehmen. • Der Patient muss darauf hingewiesen werden, dass die Bewegungsmöglichkeit im Bereich der Wirbelsäulenfusion unterbunden ist. Außerdem muss der Patient über Verhaltensweisen unterrichtet werden, mit denen diese permanente Einschränkung der Bewegungsfreiheit kompensiert werden kann. Falls keine Fusion erzielt wird oder die Komponenten sich lösen, verbiegen und/oder brechen, muss das Gerät bzw. müssen die Geräte korrigiert und/oder sofort entfernt werden, bevor ernsthafte Verletzungen entstehen. Wird bei einer verzögerten Nichteinbindung in den Knochen keine Immobilisierung bewirkt, wird das Implantat übermäßigen und wiederholten Belastungen ausgesetzt. Infolge von Ermüdung können diese Belastungen zu einem Verbiegen, Ablösen oder zum Bruch des Systems bzw. der Systeme führen. Das Implantat kann nach dem Ausheilen des Knochens entfernt werden. Besonders bei jungen aktiven Patienten können sich Implantate selbst nach normaler Heilung lösen, brechen, korrodieren, migrieren sowie zu einem erhöhten Infektionsrisiko, Schmerzen und Spannungsabschirmung des Knochens führen. Vom Chirurgen sind die Risiken und Vorteile bei der Entscheidung zur Entfernung oder Nicht-Entfernung abzuwägen. Der Implantatentfernung muss ein Handhabung und Lagerung Bei der Lagerung der Implantate und Instrumente der Silverton- und Silverton-D-Systeme ist größte Sorgfalt anzuwenden. Die ordnungsgemäße Funktion der für die Silverton- und Silverton-D-Systeme benötigten chirurgischen Spezialinstrumente ist vor jedem Operationsverfahren zu überprüfen. Reinigung und Dekontamination Die Silverton- und Silverton-D-Implantate und -Instrumente werden nicht-steril geliefert. Vor den nächsten Schritten müssen alle Verpackungen und Aufkleber entfernt werden. Die Reinigung muss vor der Vorbereitung der Implantate und Instrumente für die Sterilisierung erfolgen. Vorsicht: Bestimmte Reinigungslösungen, wie beispielsweise Reinigungsmittel, die Formalin, Glutaraldehyd, Bleichmittel und/oder andere alkalische Reinigungsstoffe enthalten, können manche Geräte und besonders die Instrumente beschädigen. Reinigungslösungen dieser Art sollten nicht verwendet werden. Hinweis: Einige Instrumente müssen vor dem Reinigen ggf. auseinandergenommen werden. Reinigungsanweisungen – Waschmaschine (empfohlen) 1. Reinigungslösung zubereiten a. Eine Enzymreinigungslösung gemäß Herstelleranweisung bezüglich Zubereitung und Verwendung vorbereiten. b. KEINE Salzlösung verwenden, da Salz bei rostfreiem Edelstahl zu Korrosion führen kann. c. Der pH-Wert der Reinigungslösung sollte nahezu neutral sein, sodass Lochfraß und Anlaufen vermieden werden. 2. Instrumente für das Tauchbad vorbereiten a. Um Verletzungen zu vermeiden, scharfe und spitze Instrumente aussortieren und mit besonderer Sorgfalt handhaben. b. Instrumente mit abnehmbaren Teilen auseinandernehmen. c. Scharnier-, Zahn- oder Gewindegelenke öffnen. d. Schwere oder großflächige Verunreinigungen mit in der Reinigungslösung getränkten, fusselfreien Einweg-Reinigungstüchern entfernen. 3. Im Tauchbad reinigen a. Die Instrumente in das vorbereitete Tauchbad einlegen. b. Während die Instrumente im Tauchbad liegen, alle Oberflächen mit einer Bürste reinigen (keine Stahlbürste verwenden), dabei darauf achten, dass alle sichtbaren Verschmutzungen entfernt werden. c. Sofern zutreffend: i. Alle Kanülen, Lumen, Spalten, Rillen und schwer erreichbaren Bereiche mit einem Pfeifenreiniger und einer Spritze reinigen. ii. Alle Kanülen, Lumen, Spalten, Rillen und schwer erreichbaren Bereiche wiederholt spülen, für die Spüllösung eine Spritze verwenden. iii. Bewegliche Gelenke während der Reinigung wiederholt betätigen bzw. drehen bzw. aufund zuklappen. iv. Hohlrauminnenflächen in ihrer gesamten Länge ausbürsten. d. Die Instrumente für die vom Hersteller empfohlene Einweichzeit im Tauchbad liegen lassen. 4. Instrumente in die Waschmaschine legen a. Die Instrumente so in die Maschine legen, dass sie während des Waschvorgangs nicht aufeinander prallen. b. Schwere Gegenstände unten in die Maschine legen, hohle Gegenstände in die Waschmaschinenkörbe legen. c. Sicherstellen, dass die einzelnen Bestandteile der Instrumente nicht durch große Gegenstände blockiert werden. d. Gelenkinstrumente offen in die Maschine legen, kanülierte Instrumente horizontal in die Maschine legen. e. Auseinandergenommene Instrumente in die Waschmaschinenkörbe legen. 5. Wasch- und Trockenzyklen a. 2 Minuten: Vorwäsche mit kaltem Wasser; Wasser abtropfen lassen. b. 5 Minuten: Wäsche mit Waschmittel und heißem Wasser; Wasser abtropfen lassen. c. 2 Minuten: Mit einem Waschmittel mit neutralem pH-Wert neutralisieren; Wasser abtropfen lassen. d. 2 Minuten: Mit heißem Wasser spülen; abtropfen lassen. e. Mit Heißluft (max. 115 °C) trocknen. 6. Sichtprüfen a. Die Instrumente bei normaler Beleuchtung mit bloßem Auge sichtprüfen, um festzustellen, ob evtl. haftengebliebene sichtbare Verschmutzungen (z.B. Blut, eiweißhaltige Substanzen oder andere Verunreinigungen) von allen Oberflächen, Lumina, Kanülen, Spalten, gezackten Rändern, Gewinden usw.) entfernt worden sind. b. Wenn sichtbare Verschmutzungen zurückgeblieben sind, die Reinigung wiederholen. Reinigungsanweisungen – Handwäsche 1. Reinigungslösung zubereiten a. Eine Enzymreinigungslösung gemäß Herstelleranweisung bezüglich Zubereitung und Verwendung vorbereiten. b. KEINE Salzlösung verwenden, da Salz bei rostfreiem Edelstahl zu Korrosion führen kann. c. Der pH-Wert der Reinigungslösung sollte nahezu neutral sein, sodass Lochfraß und Anlaufen vermieden werden. 2. Instrumente für das Tauchbad vorbereiten a. Um Verletzungen zu vermeiden, scharfe und spitze Instrumente aussortieren und mit besonderer Sorgfalt handhaben. b. Instrumente mit abnehmbaren Teilen auseinandernehmen. c. Scharnier-, Zahn- oder Gewindegelenke öffnen. d. Schwere oder großflächige Verunreinigungen mit in der Reinigungslösung getränkten, fusselfreien Einweg-Reinigungstüchern entfernen. 3. Im Tauchbad reinigen a. Die Instrumente in das vorbereitete Tauchbad einlegen. b. Während die Instrumente im Tauchbad liegen, alle Oberflächen mit einer Bürste reinigen (keine Stahlbürste verwenden), dabei darauf achten, dass alle sichtbaren Verschmutzungen entfernt werden. c. Sofern zutreffend: i. Alle Kanülen, Lumen, Spalten, Rillen und schwer erreichbaren Bereiche mit einem Pfeifenreiniger und einer Spritze reinigen. ii. Alle Kanülen, Lumen, Spalten, Rillen und schwer erreichbaren Bereiche wiederholt spülen, für die Spüllösung eine Spritze verwenden. iii. Bewegliche Gelenke während der Reinigung wiederholt betätigen bzw. drehen bzw. aufund zuklappen. iv. Hohlrauminnenflächen in ihrer gesamten Länge ausbürsten. d. Die Instrumente für die vom Hersteller empfohlene Einweichzeit im Tauchbad liegen lassen. 4. Spülen a. Die Instrumente aus dem Tauchbad nehmen. b. Die Instrumente mindestens eine Minute lang unter fließendem Wasser abspülen. c. Kanülen, Lumen und Löcher gründlich ausspülen. 5. Ultraschallbad a. Ein Ultraschallbad mit einer blutlösenden Reinigungslösung vorbereiten, dabei Herstelleranweisung bezüglich Zubereitung und Verwendung beachten. b. Die Instrumente während des Transports vom Spülvorgang zum Ultraschallbad abdecken/versiegeln, um eine Kontaminierung zu vermeiden. c. Die Instrumente in das Ultraschallbad einlegen. d. Dafür sorgen, dass die Instrumente vollständig in das Ultraschallbad eingetaucht sind und nicht übereinander liegen. e. Fünfzehn Minuten lang im Ultraschallbad behandeln. Um Korrosion zu vermeiden, darf die angegebene Dauer von 15 Minuten nicht überschritten werden. 6. Mit sterilem Wasser spülen a. Die Instrumente mindestens drei Minuten lang mit gereinigtem, sterilem Wasser (d.h. RO- oder DIWasser) abspülen. 7. Trocknen a. Die Instrumente mit fusselfreien Einwegtüchern und/oder medizinischer Druckluft (z.B. Kanüleninnenräume) trocknen. b. Zur Vermeidung von Korrosion darauf achten, dass die Instrumente sofort nach dem Spülen vollständig getrocknet werden. 8. Sichtprüfen a. Die Instrumente bei normaler Beleuchtung mit bloßem Auge sichtprüfen, um festzustellen, ob evtl. haftengebliebene sichtbare Verschmutzungen (z.B. Blut, eiweißhaltige Substanzen oder andere Verunreinigungen) von allen Oberflächen, Lumina, Kanülen, Spalten, gezackten Rändern, Gewinden usw. entfernt worden sind. b. Wenn sichtbare Verschmutzungen zurückgeblieben sind, die Reinigung wiederholen. Sterilisierung Die Silverton- und Silverton-D-Implantate und -Instrumente werden nicht-steril geliefert und müssen vor dem Gebrauch gereinigt und sterilisiert werden. Die Sterilisation sollte in einem Dampfautoklaven mit den in den nachstehenden Tabellen aufgeführten Parametern durchgeführt werden. Zur Erhaltung der Sterilität vor dem Gebrauch empfiehlt sich die Verwendung einer Sterilisationsverpackung (Nur USA: Sterilisationsverpackung mit FDAZulassung). Sterilisationsparameter für die Silverton und Silverton-D-System-Implantate, -Instrumente und Sets Methode Zyklus Temperatur Anwendungsdauer Mindesttrocknungsdauer Dampf Vorvakuum 132 °C (270 °F) 10 Minuten 55 Minuten Dampf Schwerkraft 132 °C (270 °F) 15 Minuten 55 Minuten Handbuch zur Operationstechnik Der Leitfaden zur Operationstechnik ist auf Anfrage vom Biomet Spine-Kundendienst erhältlich (unter der nachstehend angegebenen Kontaktanschrift). • m P m m m m m m m m Materiales Los sistemas Silverton y Silverton-D están hechos de una aleación de titanio descrita por las especificaciones ISO 5832-3 y ASTM F136, de titanio comercialmente puro descrito por las especificaciones ASTM F67 y de una aleación de cobalto-cromo descrita por las especificaciones ASTM F1537. Los componentes de implante de titanio y cobaltocromo pueden utilizarse conjuntamente dentro del mismo sistema. Los implantes de titanio y cobalto-cromo no deben utilizarse nunca con implantes de acero inoxidable. D D Contraindicaciones Las contraindicaciones pueden ser relativas o absolutas. La elección de un dispositivo particular debe sopesarse cuidadosamente con la evaluación general del paciente. Las circunstancias enumeradas a continuación pueden reducir las posibilidades de obtener un resultado satisfactorio. Las contraindicaciones incluyen, entre otras: • Una alergia a las aleaciones de titanio o cobalto-cromo, o sensibilidad a cuerpos extraños. Cuando se sospeche de sensibilidad a los materiales, deben realizarse las pruebas adecuadas antes de la implantación. • Incompetencia del sistema inmunitario/infección conocida o sospechada. Enfermedades infecciosas agudas o crónicas de cualquier etiología o ubicación. • Cualquier anomalía presente que afecte al proceso normal de remodelación ósea incluidas, entre otras, osteoporosis intensa que afecte a la columna, absorción ósea, osteopenia, infección activa en el sitio o determinados trastornos metabólicos que afectan a la osteogénesis. • Obesidad mórbida. Un paciente obeso o con sobrepeso puede generar cargas en el sistema espinal, que pueden provocar el fallo de la fijación del dispositivo o la rotura del propio dispositivo. • Cualquier deficiencia neuromuscular que someta a una carga inusualmente pesada al dispositivo durante el periodo de consolidación. • Heridas abiertas. • Embarazo. • Cualquier otra afección médica o quirúrgica que impediría el beneficio potencial de la cirugía de la columna vertebral, como la presencia de anomalías congénitas, elevación de la tasa de sedimentación no explicada por otras enfermedades, elevación del recuento de glóbulos blancos, o un marcado giro a la izquierda en el recuento diferencial de glóbulos blancos. • Cualquier caso que requiera mezclar componentes de dos sistemas diferentes. • Cualquier caso que requiera la mezcla de implantes de acero inoxidable con otros de titanio o de acero inoxidable con otros de cobalto-cromo. • Fiebre o leucocitosis. • Signos de infección o inflamación local. • Antecedentes previos de infección. • Alcoholismo o tabaquismo intenso. • Senilidad, enfermedad mental o abuso de sustancias, de tal gravedad que el paciente puede hacer caso omiso de determinadas limitaciones y precauciones necesarias en el uso del implante, dando lugar al fallo del dispositivo u otras complicaciones. • Cualquier paciente que no tenga intención de seguir las instrucciones postoperatorias. • Cobertura tisular inadecuada sobre el sitio quirúrgico. Posibles complicaciones Entre las posibles complicaciones específicas del dispositivo se incluyen: • Doblamiento, rotura, fallo, aflojamiento o desplazamiento/migración del implante tempranos o tardíos • Fractura ósea • Reacción alérgica al material del implante Entre las complicaciones generales asociadas con los procedimientos quirúrgicos de la columna vertebral cabe mencionar: unión retardada o falta de unión, pseudoartrosis, dolor, una segunda intervención, hemorragia, infección temprana y tardía, daño tisular o nervioso, incluidos los desgarros de la duramadre u otros problemas neurológicos, complicaciones en la incisión, formación de tejido cicatrizal, daño a los vasos sanguíneos y deterioro del sistema cardiovascular, cambios en el estado mental, daño a los órganos internos y al tejido conjuntivo, complicaciones debidas al uso de injertos óseos, incluidas las del sitio donante del injerto, problemas respiratorios, reacciones a la anestesia y muerte. m m m m m m m Cm N m m m m m m m m m M m D m m m m m m m m m P D m D m m m m m C m m m m m m m m N m m m m N m m m mm m NO H B m m B m P mm m m m m D m m C m m m m m m C m m m m m M m m m m m m m m C m P m m m m m m m D m m m m D m m m D m m m C D m m m m m m m m m m m R U m m m m m m C m m m m C U N N m m m mm mm m m mm m mm m M C m m m m U U m m m m D m m m C m C m m U m m C m m m m m H m m m m m U m m C m m m m m m m m m m m m P m m m m NO C m m D H m U P m m m m m D m m m m m m m m m m m m m m C m m m m C m m m m m m m m m M m m m m B m Nm m m m R m m m m + % C m m mm m U m m U m m m m M C Nm ± % m m m m m m m m m m m mm mm U m m m m m m m m m m B D m m U m m mm mm m mm mm mm D mm U mm C m m m m C m m m m m m m m m Nm m N m m m m m m m + % m m m m m m m m m m m m m mm mm H m mm m m m m m m m m m H Nm m D m m m U m m m + % m m m mm U m m Nm m m m m ± % m UU m D m N P C m m m m m M m m C m m m G m m m m m C m m m U m m m m m m P D m M U m m C m m m m Q m m D m m m m m m m m m m U D m m m mm m C m C m m m m m m m m m Cm m m m m m m m m D m m m m m R m m m m m C m m m m m m m m m m m m m m m m m m m m m m m m m m m • • • m m m m D m m Die empfohlenen Sterilisationszyklen wurden geprüft und gewährleisten einen SAL-Wert (Sterility Assurance Level [SAL]) von mindestens 10-6. m m m m m m N m m m m m m m m m Precauciones • Los implantes Silverton y Silverton-D son para un único uso solamente. Nunca reutilice un implante aunque no presente marcas ni daños aparentes. La reutilización de los componentes de implante puede generar un rendimiento mecánico reducido, mal funcionamiento o fallo del dispositivo. Cualquier implante que se haya implantado y después extraído se debe desechar. Sólo use implantes nuevos para cada caso. • La implantación del sistema de fijación de procesos espinosos sólo deben realizarla cirujanos de la columna vertebral con experiencia que cuenten con formación específica en la utilización de este sistema, debido a la elevada exigencia técnica que plantea el procedimiento, que genera un riesgo de lesión grave para el paciente. • En base a los resultados de las pruebas de fatiga, el médico/cirujano debe considerar los niveles de implantación, el peso del paciente, el nivel de actividad del paciente, otras posibles afecciones, etc. que pueden afectar al rendimiento del sistema. • Antes de la cirugía: El cirujano debe estar totalmente familiarizado con todos los aspectos de la técnica quirúrgica, y conocer las indicaciones y las contraindicaciones de este tipo de implante. El cirujano debe haberse familiarizado antes de la cirugía con la técnica de introducción del producto específica, que se puede obtener del fabricante. Como parte del examen preoperatorio, el cirujano debe comprobar que no exista ningún factor biomecánico, biológico o de otro tipo que pueda afectar a la correcta realización de la cirugía y al periodo postoperatorio. Se debe contar con un amplio abanico de tamaños de implante en el momento de la cirugía. • Durante la cirugía: La correcta selección del tamaño y el tipo de implante adecuados para el paciente y la colocación del implante son de extrema importancia. • Se requiere el aterrajado para medir los tornillos de torreta de Biomet con diámetro de 8,5 mm o más. De no hacerlo, podría causarles daños al destornillador de tornillos óseos lo cual podría ser causa de lesión en el paciente. • Si el tornillo de fijación no se coloca tal como se indica (con la superficie superior dorada visible antes de su inserción), el instrumental podría fallar y no quedar bloqueado en su lugar tal como se pretende, lo cual podría ser causa de lesión en el paciente. • Después de la cirugía: Se debe informar a los pacientes de las precauciones que deben adoptar en su vida diaria para garantizar una vida útil máxima del implante. Se recomienda realizar un segu m m m m m m m m mm m R m m Advertencias La seguridad y eficacia de los sistemas espinales de tornillos pediculares se ha establecido sólo para afecciones de columna con significativa inestabilidad mecánica o deformidad, que requieren fusión con instrumentación. Estas afecciones son: inestabilidad mecánica o deformidad importante de la columna torácica, lumbar y sacra como consecuencia de espondilolistesis grave (grados 3 y 4) de las vértebras L5-S1, espondilolistesis degenerativa con indicios objetivos de deterioro neurológico, fractura, dislocación, escoliosis, cifosis, tumor espinal y fusión anterior fracasada (pseudoartrosis). Se desconoce la seguridad y eficacia de estos dispositivos para otras afecciones. Los pacientes con cirugía espinal anterior en los niveles que van a tratarse podrían tener resultados clínicos diferentes a los obtenidos anteriormente. m m m m Indicaciones de uso Los sistemas Silverton y Silverton-D están diseñados para ayudar a proporcionar inmovilización y estabilización de los segmentos espinales en pacientes esqueléticamente maduros, como auxiliar de la fusión de la columna torácica, lumbar o sacra. El sistema está diseñado para utilizarse junto con autoinjerto o aloinjerto. Los sistemas Silverton y Silverton-D están diseñados para la fijación pedicular y no pedicular de la columna no cervical (T1-S2/ilion) posterior, para proporcionar inmovilización y estabilización de los segmentos espinales en pacientes esqueléticamente maduros, como auxiliar de la fusión en el tratamiento de las siguientes inestabilidades o deformidades: discopatía degenerativa (DD, definida como dolor de espalda de origen discogénico con degeneración del disco confirmada por los antecedentes y los estudios radiográficos); espondilolistesis; traumatismo (p. ej., fractura o dislocación); estenosis espinal; deformidades o curvaturas (p. ej., escoliosis, cifosis o lordosis); tumor; pseudoartrosis; y fusión previa fallida. m m m P m NO m m m m m Descripción del dispositivo Los sistemas Silverton y Silverton-D son un sistema de fijación espinal de conexión posterior compuesto por una serie de tornillos pediculares, ganchos, barras longitudinales, tornillos de fijación, tuercas, conectores varios, instrumentos quirúrgicos dedicados y estuches de esterilización a escala anatómica. Los componentes se utilizan para crear un constructo que proporcione estabilización a los segmentos espinales de la columna torácica, lumbar y sacra para reforzar la fusión. Los dispositivos Silverton y Silverton-D forman parte del sistema de fijación espinal Biomet, que ofrece al cirujano una amplia variedad de componentes de implante con los que crear un constructo adecuado, que se adapte a las necesidades y requisitos individuales del paciente. Tras producirse una fusión sólida, el sistema deberá retirarse al no cumplir ya ninguna función. La retirada está indicada porque los implantes no están diseñados para transferir o resistir las fuerzas que se desarrollan durante las actividades normales. Sin embargo, la decisión de retirar el dispositivo corresponde al médico y al paciente, quienes deberán tener en cuenta el estado médico general del paciente y el posible riesgo para el paciente de tener que someterse a un segundo procedimiento quirúrgico. • m m m Parameter für die Dampfsterilisation eines einzelnen Instruments zum sofortigen Einsatz für die Systeme Silverton und Silverton-D Methode Zyklus Temperatur Anwendungsdauer Dampf Vorvakuum 132 °C (270 °F) 3 Minuten m m m Propósito El sistema de fijación espinal Biomet (conocido también como dispositivo Silverton y Silverton-D) representa un amplio y completo sistema de tornillos pediculares, que está compuesto por implantes e instrumentos, y diseñado para proporcionar estabilización de los segmentos espinales en pacientes esqueléticamente maduros en la columna torácica, lumbar y sacra. Como ocurre con todos los procedimientos quirúrgicos ortopédicos, es esencial una planificación preoperatoria detallada. Resulta necesaria una evaluación diagnóstica preoperatoria seguida de una técnica quirúrgica ejecutada con precaución. La atención postoperatoria, individualizada para adaptarse a las necesidades particulares de la lesión/enfermedad, resulta esencial para obtener un resultado óptimo. El cirujano debe comprender en toda su magnitud los riesgos y complicaciones inherentes a este tipo de cirugía. Sólo deben intentar utilizar los implantes aquellas personas que cuenten con formación especializada y experiencia en cirugía de la columna vertebral. m m m m m m m m m N INSTRUCCIONES DE USO LOS SISTEMAS DE FIJACIÓN DE LA COLUMNA VERTEBRAL SILVERTON Y PARA DEFORMIDADES SILVERTON-D RM N RM D m m m m D m m mm m m m m m • N m m m m Alle eingetragenen oder andere Marken sind das Eigentum von Biomet, Inc. oder einer deren Tochtergesellschaften, sofern nicht anders angegeben. m m m m m m m m Cm m ©2014 Biomet Spine, LLC. Alle Rechte vorbehalten. m m m Weitere Informationen Falls weitere Gebrauchsanweisungen für dieses System benötigt werden, wenden Sie sich per E-Mail an den Biomet Spine-Kundendienst: spinecustomerservice@biomet.com, Tel. +1.303.443.7500, Fax: +1.303.443.7501. Wenn eine Dampfsterilisation zum sofortigen Einsatz erforderlich ist, kann jedes Silverton und Silverton-D chirurgische Handinstrument unter Einhaltung der nachstehenden Sterilisationsparameter einzeln sterilisiert werden. Reklamationen bezüglich des Produkts Wenden Sie sich bei Verdacht auf Mängel in der Qualität, Identität, Haltbarkeit, Zuverlässigkeit, Sicherheit, Wirksamkeit und/oder Leistung des Produkts direkt per E-Mail an Biomet Spine: spinecomplaints@biomet.com, +1.866.956.7579. Geben Sie bei Reklamationen bitte die folgenden Informationen an: die Namen der betroffenen Komponenten, alle Teilenummern, Chargennummern, Ihren Namen und Ihre Adresse, die Art der Beschwerde, den Namen des Chirurgen, sowie das Datum, an dem sie von der Reklamation erfahren haben. Sterilisieren Sie alle Komponenten und senden Sie sie an Ihren zuständigen Biomet Spine-Vertreter oder -Vertriebspartner zurück. Benachrichtigen Sie Biomet Spine umgehend über Vorfälle, die zum Tod oder einer schwerwiegenden Verletzung eines Patienten führen. P m B m C m m m m @ m m + m m m • m m m m B m m m m m m m m m m N m m m M m • B m m B m m FU7721 0310CE 05 S ve on qxp 10 16 14 2 26 PM Page 3 S ve on Sp na F xa on and S ve on D De o m y Sys ems 2 MPORTANT NFORMAT ON ON THE S VERTON SP NA F XAT ON AND S VERTON D DEFORM TY SYSTEMS Información adicional Si necesita más indicaciones para la utilización de este sistema, comuníquese con el Servicio de atención al cliente de Biomet Spine por correo electrónico: spinecustomerservice@biomet.com, Tel: +1.303.443.7500, Fax: +1.303.443.7501. ©2014 Biomet Spine, LLC. Todos los derechos están reservados. Todas las marcas comerciales son propiedad de Biomet, Inc. o de una de sus filiales, a menos que se indique lo contrario. Français MODE D’EMPLOI SYSTÈME DE FIXATION RACHIDIENNE SILVERTON ET POUR DÉFORMATIONS RACHIDIENNE SILVERTON-D Objectif Le système de fixation rachidienne Biomet (appelé également Silverton et Silverton-D) constitue un système à vis pédiculaires complet composé d’implants et d’instruments destinés à permettre la stabilisation vertébrale de segments rachidiens chez des patients de maturité squelettique au niveau du rachis dorsal, lombaire et sacré. Comme pour toutes les interventions chirurgicales orthopédiques, il est essentiel d’établir un planning préopératoire détaillé. Il est nécessaire d’effectuer une évaluation diagnostique préopératoire suivie d’une technique chirurgicale minutieuse. Des soins postopératoires adaptés aux exigences de la lésion ou de l’atteinte particulière sont essentiels pour assurer des résultats optimaux. Le chirurgien doit avoir pleinement conscience des risques et des complications inhérents à ce type de chirurgie. Seules les personnes ayant une formation et une expérience spécialisées en chirurgie rachidienne peuvent envisager d’utiliser les implants. Description du dispositif Les systèmes Silverton et Silverton-D sont des systèmes de fixation postérieure du rachis composé d’une gamme d’instruments de diverses tailles anatomiques, y compris des vis pédiculaires, de crochets, des tiges longitudinales, des verrous de vis, des écrous, des raccords divers, des instruments chirurgicaux spécifiques et des boîtes de stérilisation. Les composants sont utilisés pour construire un assemblage destiné à assurer une stabilisation des segments rachidiens du rachis dorsal, lombaire et sacré afin de permettre la fusion osseuse. Les dispositifs Silverton et Silverton-D font partie du système de fixation rachidienne Biomet, qui offre aux chirurgiens une gamme variée de composants (implants) pour la construction d’assemblages adaptés aux exigences et aux besoins particuliers de chaque patient. Après obtention d’une fusion osseuse robuste, le système n’a plus de rôle fonctionnel et doit être retiré. Le retrait de l’implant est indiqué car ce dernier n’est pas destiné à supporter ou transférer les charges subies lors d’activités physiques normales. Toutefois, la décision de retirer le dispositif est du ressort du médecin et du patient, et doit prendre en compte l’état médical général du patient et le risque potentiel inhérent à une deuxième intervention chirurgicale. Matériaux Les systèmes Silverton et Silverton-D sont composés d’un alliage de titane tel que décrit dans les spécifications des normes ISO 5832-3 et ASTM F136, combinant du titane pur disponible dans le commerce tel que décrit dans les spécifications de la norme ASTM F67 et un alliage cobalt chrome tel que décrit dans les spécifications de la norme ASTM F1537. Les implants en titane et en cobalt chrome peuvent être utilisés ensemble dans un même montage. Les implants en titane et en cobalt chrome ne doivent jamais être utilisés avec des implants en acier inoxydable. Indications thérapeutiques Les systèmes Silverton et Silverton-D sont destinés à être utilisés pour faciliter l’immobilisation et la stabilisation de segments rachidiens chez des patients de maturité squelettique, en tant qu’accessoire d’arthrodèse du rachis dorsal, lombaire et/ou sacré. Ce système est destiné pour une utilisation avec une autogreffe ou une allogreffe. Les systèmes Silverton et Silverton-D sont destinés à être utilisés pour la fixation rachidienne postérieure, non cervicale (T1 à S2/ilion), pédiculaire et non pédiculaire, afin de permettre l’immobilisation et la stabilisation de segments rachidiens chez des patients de maturité squelettique, en tant qu’accessoire d’arthrodèse, pour le traitement des instabilités ou déformations suivantes : discopathie dégénérative (DD, douleur au dos d’origine discale associée à une dégénérescence du disque confirmée par les antécédents du patient et des examens radiographiques), spondylolisthésis, traumatisme (c.-à-d. fracture ou luxation), sténose rachidienne, déformations ou courbures (c.-à-d. scoliose, cyphose et/ou lordose), tumeur, pseudo-arthrose et fusion antérieure non réussie. Contre-indications Les contre-indications peuvent être relatives ou absolues. Le choix d’un dispositif particulier doit être soigneusement considéré en tenant compte de l’évaluation globale du patient. Les circonstances ci-dessous peuvent réduire les chances d’un résultat positif. Les contre-indications incluent, entre autres : • Une allergie aux alliages de titane ou cobalt chrome, ou une sensibilité aux corps étrangers. Lorsqu’une sensibilité au matériau est suspectée, réaliser les tests appropriés avant l’implantation. • Une infection ou une incompétence du système immunitaire documentée ou suspectée. Une maladie infectieuse aiguë ou chronique, quels que soient l’étiologie et le site. • La présence d’anomalies affectant le processus du remodelage osseux naturel, dont : ostéoporose grave avec atteinte du rachis, résorption osseuse, ostéopénie, infection évolutive du site et certains troubles métaboliques affectant l’ostéogénèse, entre autres. • Obésité morbide. Un patient en surpoids ou obèse peut produire des charges au niveau du système vertébral qui sont susceptibles d’entraîner un échec de fixation du dispositif ou un échec du dispositif en question. • Des déficits neuromusculaires imposant une charge exceptionnellement lourde au dispositif pendant la période de cicatrisation. • Plaies ouvertes. • Grossesse. • Tout autre état médical ou chirurgical susceptible de prévenir les bénéfices potentiels d’une chirurgie rachidienne, notamment la présence d’anomalies congénitales, une élévation du taux de sédimentation inexpliquée par d’autres maladies, une élévation de la numération leucocytaire ou une déviation vers la gauche prononcée de la différentielle leucocytaire. • Les cas exigeant une combinaison de composants provenant de deux systèmes différents. • Les cas exigeant une combinaison de composants en acier inoxydable et en titane, ou en acier inoxydable et en cobalt chrome. • Fièvre ou leucocytose. • Des signes d’infection ou d’inflammation locale. • Des antécédents d’infection. • Alcoolisme ou tabagisme poussé. • Sénilité, maladie mentale ou toxicomanie dont la sévérité risque de mener le patient à ignorer les limites et précautions nécessaires à l’utilisation de l’implant, et conduisant à l’échec ainsi qu’à d’autres complications. • Les patients refusant d’observer les instructions postopératoires. • Une couverture tissulaire inadéquate au niveau du site opératoire. Complications possibles Les complications possibles spécifiques avec ce dispositif peuvent inclure : • Flexion, rupture, échec, desserrage ou mouvement/migration de l’implant, précoces ou tardifs • Fracture osseuse • Réaction allergique au matériau de l’implant Les autres complications d’ordre général pouvant être associées à toute procédure chirurgicale rachidienne sont : retard ou absence de consolidation, pseudo-arthrose, douleurs, deuxième intervention chirurgicale, hémorragie, infections précoces ou tardives, lésions tissulaires ou nerveuses (y compris les déchirures durales ou d’autres troubles neurologiques), complications de l’incision (dont la formation de la cicatrice), lésions vasculaires et atteinte du système cardio-vasculaire, altération de l’état psychologique, lésions des organes internes et du tissu conjonctif, complications associées à l’utilisation de greffes osseuses (y compris les complications des sites de prélèvement de la greffe), troubles respiratoires, réactions à l’anesthésie et/ou décès. Avertissements La sécurité et l’efficacité des systèmes rachidiens à vis pédiculaires ont été déterminées uniquement pour les pathologies rachidiennes présentant une instabilité mécanique significative ou une déformation nécessitant une fusion à l’aide d’instruments. Ces conditions sont une instabilité mécanique significative ou une déformation du rachis dorsal, lombaire ou sacré à la suite d’un spondylolisthésis sévère (grade 3 ou 4) des vertèbres L5-S1, un spondylolisthésis dégénératif avec des preuves objectives d’atteinte neurologique, fracture, luxation, scoliose, cyphose, tumeur rachidienne ou une fusion antérieure non réussie (pseudo-arthrose). Pour toute autre condition, la sécurité et l’efficacité de ces dispositifs restent inconnues. Les résultats cliniques de patients ayant déjà subi une intervention chirurgicale aux niveaux à traiter peuvent différer des résultats chirurgicaux précédents. Précautions • Les implants Silverton et Silverton-D sont à usage unique. Ne réutilisez jamais un implant, même s’il semble intact ou non endommagé. Une réutilisation des implants peut entraîner une réduction des performances mécaniques, une défaillance ou l’échec du dispositif. Les implants mis en place puis retirés doivent être jetés. Utilisez des implants neufs uniquement pour chaque cas. • L’implantation de systèmes rachidiens à vis pédicularies. Aspen pour l’apophyse épineuse doit uniquement être réalisée par des chirurgiens du rachis expérimentés ayant une formation spécifique à l’utilisation de ce système, car les difficultés techniques de l’intervention présentent un risque de lésion grave pour les patients. • D’après les résultats des essais de résistance à la fatigue, le médecin/chirurgien doit considérer les niveaux de l’implantation, le poids du patient, son niveau d’activité, les affections concomitantes, etc. susceptibles d’avoir un impact sur les performances du système. • Phase préopératoire : Le chirurgien doit connaître parfaitement tous les aspects de la technique chirurgicale ainsi que les indications et les contre-indications de ce type d’implant. Avant l’intervention, le chirurgien doit s’être familiarisé avec la technique d’insertion spécifique du produit, qui est disponible auprès du fabricant. Dans le cadre de l’examen préopératoire, le chirurgien doit s’assurer qu’aucun facteur biologique, biomécanique ou autre n’affectera le déroulement correct de l’intervention et de la période postopératoire. Une gamme appropriée de tailles d’implants doit être disponible au moment de l’intervention. • Phase peropératoire : Une sélection correcte du type et de la taille d’implant adaptés au patient, ainsi que le positionnement de l’implant, sont extrêmement importants. • Un taraudage à la taille est nécessaire pour un diamètre de tourelle Biomet de 8,5 mm et plus. Le nonrespect de cette instruction pourrait avoir pour conséquence d’endommager le tournevis pour vis à os. Cela pourrait entraîner une blessure du patient. • Un défaut d’installation du verrou de vis selon les consignes (surface supérieure dorée visible avant l’insertion) peut nuire au verrouillage en place correct de l’instrument comme prévu. Cela peut occasionner des lésions chez le patient. • Phase postopératoire : Informez les patients quant aux précautions qu’ils devront prendre dans la vie quotidienne pour assurer à l’implant une durée de vie utile maximum. Il est recommandé d’entreprendre un suivi postopératoire régulier pour détecter des signes précoces d’échec implantaire et envisager les mesures à prendre le cas échéant. Une détérioration du dispositif après la consolidation osseuse ne peut pas être interprétée comme une défaillance ou une détérioration des caractéristiques de l’implant. L’implant peut être retiré après la cicatrisation osseuse. • La sécurité et la compatibilité des systèmes Silverton et Silverton-D n’ont pas été testées en milieu d’imagerie par résonance magnétique (IRM). L’échauffement et la migration des systèmes Silverton et Silverton-D n’ont pas fait l’objet de tests en milieu IRM. • L’association de métaux dissemblables peut accélérer ou initier le processus de corrosion. Les composants en titane ne doivent PAS être associés à d’autres matériaux d’implant lors de la mise en place d’un assemblage. Les implants en titane et en cobalt chrome peuvent être utilisés ensemble dans un même montage. Mode d’emploi Les informations contenues dans la présente notice sont nécessaires mais non suffisantes pour l’utilisation de ce dispositif. Ces informations ne sont pas destinées à remplacer le jugement, les compétences et l’expérience professionnels du chirurgien pour ce qui est de la sélection judicieuse des patients, de la planification préopératoire, de la sélection du dispositif, de la connaissance de l’anatomie et de la biomécanique du rachis, de la connaissance des matériaux et des caractéristiques mécaniques des implants utilisés, de la formation et des compétences aussi bien en chirurgie rachidienne qu’en l’utilisation des instruments pour l’implantation, de l’obtention de l’accord du patient pour respecter un programme de soins postopératoires approprié et de la réalisation des examens de suivi postopératoires. Notez les numéros de lot des implants posés chez le patient pendant l’intervention chirurgicale dans le dossier patient. Directives chirurgicales Procédure préopératoire Le chirurgien doit connaître parfaitement tous les aspects de la technique chirurgicale ainsi que les indications et les contre-indications de ce type d’implant. Avant l’intervention, le chirurgien doit s’être familiarisé avec la technique d’insertion spécifique du produit, qui est disponible auprès du fabricant. Dans le cadre de l’examen préopératoire, le chirurgien doit s’assurer qu’aucun facteur biologique, biomécanique ou autre n’affectera le déroulement correct de l’intervention et de la période postopératoire. Une gamme appropriée de tailles d’implants doit être disponible au moment de l’intervention. Sélectionnez uniquement des patients qui répondent aux critères définis dans les indications thérapeutiques. Des patients présentant des affections et/ou prédispositions comme celles décrites dans les contre-indications susmentionnées ne doivent pas être sélectionnés. Les composants Silverton et Silverton-D doivent être manipulés et entreposés avec soin. Les implants et les instruments doivent être protégés pendant l’entreposage, en particulier dans les environnements corrosifs. Le type de montage à réaliser pour le cas spécifique doit être déterminé avant de commencer l’intervention chirurgicale. Le chirurgien responsable doit avoir une expérience approfondie des techniques de chirurgie rachidienne requises. D’après les résultats des essais de résistance à la fatigue, le chirurgien doit considérer les niveaux de l’implantation, le poids du patient, son niveau d’activité, les affections concomitantes, etc. susceptibles d’avoir un impact sur les performances des composants Silverton et Silverton-D. Un stock adéquat d’implants de diverses tailles doit être disponible au moment de la chirurgie, avec notamment un nombre important d’implants de tailles susceptibles d’être utilisées ainsi que des implants de tailles supérieures et inférieures à celles prévues pour s’adapter au patient. Révisez et examinez tous les instruments et les implants avant la stérilisation. Selon les besoins, remplacez ou ajoutez les composants nécessaires pour l’intervention prévue. Des pièces mécaniques entrant en jeu, le chirurgien doit avoir une bonne connaissance des différents composants avant d’utiliser le matériel, et doit monter personnellement chaque dispositif à utiliser pour vérifier la présence de toutes les pièces et des instruments nécessaires avant le début de l’intervention. Notez qu’il faut vérifier que la date de l’intervention chirurgicale est compatible avec la date d’expiration de l’étalonnage du manche à limitation de serrage. N’utilisez aucun instrument endommagé ou défectueux. Contactez le fabricant pour obtenir des instructions concernant la réparation ou l’échange. Tous les composants doivent être nettoyés et stérilisés avant l’utilisation. Des composants stériles supplémentaires doivent être disponibles en cas de besoin imprévu. Préparez et positionnez le patient, et mettez en place le champ stérile de manière habituelle. Procédures opératoires Une sélection correcte du type et de la taille d’implant adaptés au patient, ainsi que le positionnement de l’implant, sont extrêmement importants. Positionnez le patient en décubitus ventral sur une table radiotransparente et mettez en place le champ stérile de la manière habituelle. L’implantation chirurgicale des implants Silverton et Silverton-D est effectuée par exposition postérieure des vertèbres concernées. Une sélection correcte de la taille du ou des implants adaptés au patient, ainsi que le positionnement des implants, sont extrêmement importants. Exposez les niveaux de la région concernée par incision standard le long de la ligne médiane et dissection tissulaire. Identifiez les repères postérieurs, y compris les pédicules. Utilisez la pointe carrée pour pénétrer la corticale externe du pédicule. Localisez le pédicule et ouvrez un trajet en utilisant soit la spatule pédiculaire droite soit la spatule pédiculaire courbée. Des repères sont gravés au laser tous les 10 mm sur les spatules pédiculaires pour indiquer la profondeur et faciliter la sélection de vis de longueur appropriée. Une insertion correcte de l’instrument par un mouvement de rotation permet à la sonde de progresser selon la ligne de moindre résistance sans endommager les parois du pédicule. Utilisez la jauge droite et/ou la jauge courbée pour vérifier l’intégrité des parois du pédicule et de la corticale antérieure. Vous pouvez utiliser des tarauds, bien que les vis pédiculaires de Biomet soient munies d’une extrémité auto-taraudeuse. Un taraudage à la taille est nécessaire pour un diamètre de tourelle Biomet de 8,5 mm et plus. Insérez les vis pédiculaires à l’aide du tournevis pour vis à os installé sur le manche droit, en T ou à cliquet. Le tournevis pour vis à os comprend un axe central, une gaine interne et une gaine externe (paille). Chargez la vis sur le tournevis en rétractant les gaines interne et externe (paille) vers le haut vers le manche. Alignez et insérez les broches de l’axe du tournevis dans les encoches sur la tête de vis. Lorsque les broches sont bien en place, faites tourner la gaine interne dans le sens des aiguilles d’une montre pour la visser sur la tête de vis. Prenez soin de ne pas déformer le filetage ou trop serrer. Le manche à cliquet doit être réglé dans le sens de rotation adéquat (sens des aiguilles d’une montre ou neutre pour l’insertion). Le réglage s’effectue en faisant pivoter le collier métallique sur le manche. Une fois la profondeur d’insertion souhaitée atteinte, la vis peut être dégagée du tournevis. Tout en maintenant la position de l’ensemble tournevis/manche à cliquet, dévissez la gaine interne de la tête de vis puis retirez l’ensemble. Sous contrôle radiographique, confirmez que le positionnement de l’implant est approprié. Remarque : Pour tout retrait de vis ou ajustement de la hauteur ultérieur, il convient d’utiliser la séquence de chargement de la vis. N’essayez pas de visser ou dévisser sans avoir préalablement vissé la gaine sur la tête de vis car cela peut endommager les extrémités du tournevis. La tête de vis polyaxiale peut être positionnée et alignée à l’aide du dispositif de réglage de tête de vis. Lorsque toutes les vis sont en place, une tige de taille appropriée peut être sélectionnée. Un gabarit de tige est disponible et permet de déterminer la longueur et la courbure d’une tige. Les systèmes Silverton et Silverton-D comprennent des tiges pré-cintrées par incréments de 10 mm et une tige droite de 400 mm. Le système Silverton-D comprend des tiges rigides et malléables de 400 mm munies d’une extrémité hexagonale permettant la rotation de la tige, si nécessaire. Des tiges rigides en cobalt chrome de 500 mm sont également disponibles. Si un cintrage/contourage de la tige s‘avère nécessaire, utilisez une cintreuse ou une cintreuse in situ. À l’aide de l’introducteur pour tige, mettez en place la tige sélectionnée dans les têtes de vis. En cas de besoin d’insertion supplémentaire, le porte-tige peut être utilisé. Il peut être nécessaire d’utiliser des verrous de vis provisoires pour stabiliser la tige. La mise en place des verrous de vis peut nécessiter des manœuvres supplémentaires de la tige. Pour la mise en place des verrous de vis, le pousse-tige ou le guide-verrou peut être utilisé pour établir le trajet axial direct jusqu’à la tête de vis. L’extrémité distale du guide-verrou est légèrement plus grande et est positionnée par-dessus la tête de vis et de la tige. En appliquant une pression vers le bas, poussez la tige vers la position appropriée dans la tête de vis et introduisez le verrou de vis le long de l’axe cannelé. Vous pouvez utiliser la pince levier pour tige pour introduire la tige dans la tête de vis en effectuant un mouvement de levier. Le persuadeur pour tige est un dispositif puissant qui permet de créer la force nécessaire pour rapprocher la tête de vis et la tige. Vérifiez que l’instrument est entièrement débrayé puis introduisez les bras dans les rainures sur les deux côtés de la tête de vis. Serrez progressivement la poignée pistolet jusqu’à la butée du cliquet. Introduisez un verrou de vis le long de l’axe cannelé et serrez temporairement. Pour dégager l’instrument de la vis, relâchez le verrouillage à cliquet et faites pivoter l’instrument de 90 degrés. Une fois la tige entièrement installée, les verrous de vis restants peuvent être mis en place pour immobiliser la tige. En raison du système de filetage inverse à butée des verrous de vis, ceux-ci doivent être orientés correctement préalablement à leur insertion. S’ils sont installés à l’envers sur l’amorce pour verrou de vis, ils ne s’enclencheront pas dans la tête de vis. Vérifiez que la surface supérieure dorée soit bien visible avant l’insertion. L’amorce pour verrou de vis est un instrument à double extrémité autorétentive conçue pour amorcer le vissage des verrous de vis dans le filetage et permettre leur serrage provisoire. Il faut veiller à éviter les couples importants car cela peut endommager l’extrémité de l’instrument. Lors de l’insertion des tiges rigides ou malléables du système Silverton-D, les angles des tiges et des têtes de vis pédiculaire peuvent être orientés en plaçant la clé de dérotation sur l’extrémité hexagonale de la tige et le tube de dérotation sur la tête de la vis pédiculaire. Une fois que la tige est entièrement installée dans toutes les têtes de vis polyaxiales et que les verrous de vis sont en place, la pince de distraction ou la pince de compression peut être utilisée pour procéder à une distraction ou une compression, respectivement. Le serrage final est réalisé à l’aide des trois instruments suivants : contre-couple, manche à limitation de serrage et serre-verrou. Installez le manche à limitation de serrage sur le serre-verrou et insérez l’ensemble dans l’instrument contre-couple. Tout en rétractant le contre-couple pour observer l’engagement final du verrou de vis, placez l’extrémité du serre-verrou dans le verrou de vis afin de procéder au serrage final. Descendez le contre-couple par-dessus la tête de vis qui retient la tige, puis faites pivoter le manche à limitation de serrage dans le sens des aiguilles d’une montre jusqu’à entendre un clic. Le serrage final est atteint à 9,0 Nm (80 in-lb) (-4/+6 %). Des raccords croisés fixes ou variables sont disponibles. Les raccords croisés fixes sont disponibles en plusieurs longueurs spécifiques et sont utilisés lorsque les tiges sont parallèles. Les raccords croisés variables conviennent à des tiges espacées de 40 à 80 mm. Pour le positionnement initial ou le serrage manuel du raccord croisé sur la tige, utilisez le tournevis pour verrou de vis et dévissez suffisamment les verrous de vis de manière à ce que les tiges soient bien prises dans les mâchoires. Lorsque les tiges sont bien prises dans les mâchoires, serrez les verrous de vis. Le serrage manuel du raccord croisé variable peut s’effectuer par l’intermédiaire de l’écrou central en utilisant le tournevis pour écrou central. Le serrage final du raccord croisé peut s’effectuer en utilisant le tournevis à limitation de serrage (4,5 Nm/40 in-lb) (±5 %) conjointement avec le tournevis pour verrou de vis pour le raccordement aux tiges, et le tournevis pour écrou central sur le raccord croisé variable. Si nécessaire, les cintreuses pour raccord croisé peuvent être utilisées. Les vis monoaxiales sont de couleurs différentes en fonction du diamètre des vis. Différentes combinaisons de diamètres et de longueurs de vis sont disponibles : les diamètres de vis sont compris entre 4,5 mm et 8,5 mm, et les longueurs de vis entre 25 mm et 100 mm. Après la préparation des pédicules, comme décrit ci-dessus, la vis monoaxiale est mise en place à l’aide du tournevis pour vis à os monoaxiale. En cas de besoin, les vis de réduction Silverton-D sont disponibles pour réduire la tige sur le corps de vis ou pour réduire un spondylolisthésis. Les vis de réduction Silverton-D sont disponibles avec des diamètres de vis de 5,5 mm, 6,5 mm et 7,5 mm et des longueurs de vis de 35 mm, 40 mm, 45 mm et 50 mm. Après la préparation des pédicules, comme décrit ci-dessus, les vis de réduction sont mises en place à l’aide du tournevis pour vis de réduction avec la gaine externe (paille) du tournevis pour vis de réduction raccordée au manche à cliquet ou au manche en T. Après la réduction de la tige, les verrous de vis peuvent être serrés. Pour faciliter l’alignement des verrous de vis avec le filetage de la tête de la vis de réduction, l’anneau de soutien des languettes peut être utilisé et le serrage provisoire réalisé. La partie saillante de la vis de réduction peut maintenant être enlevée à l’aide de la pince pour languettes de la vis de réduction. Ceci est réalisé en glissant la pince pour languettes de la vis de réduction par-dessus chaque languette saillante de la tête de vis et en exerçant un effet de levier d’abord en direction médiale puis en direction latérale pour éviter tout écart éventuel de la tête de vis. Il peut être nécessaire de répéter les mouvements médiaux et latéraux à plusieurs reprises pour que chaque languette se détache. Le serrage final des verrous de vis peut être effectué en utilisant le contre-couple de réduction et le manche à limitation de serrage, avec ce dernier étalonné sur un couple de 9,0 Nm (80 in-lbs) (-4/+6 %). Les raccords décalés permettent une certaine variabilité du positionnement latéral et médial lors du raccordement des vis à une tige. Cela peut être utile lors de l’alignement des vis avec un raccord par crochet. Les raccords décalés fermés doivent être pré-chargés sur la tige avant d’être positionnés dans la vis ou la tête de crochet. Les petits verrous de vis sont employés avec ce type de raccord. Les verrous de vis standard sont utilisés pour fixer les raccords décalés ouverts sur la tige. Les raccords décalés sont disponibles en trois longueurs ouvertes : 15 mm, 25 mm et 40 mm. Un raccord décalé fermé d’une longueur de 40 mm est également disponible. Une fois que le raccord décalé a été sélectionné et mis en place, le serrage final des verrous de vis est réalisé. Pour les raccords décalés ouverts et fermés, utilisez le serre-verrou et le manche à limitation de serrage réglé sur 9,0 Nm (80 in-lb) (-4/+6 %). Les raccords axiaux et parallèles sont utilisés pour accroître la longueur ou rapprocher deux tiges distinctes en les réunissant. Il existe quatre configurations différentes pour les raccords parallèles et un seul raccord axial. Une fois que le raccord tige-à-tige a été sélectionné et mis en place, les verrous de vis sont serrés à l’aide du serre-verrou et du manche à limitation de serrage étalonné sur 4,5 Nm (40 in-lb) (±5 %). Remarque : Le serrage des verrous de vis des éléments commandés spécifiquement (raccord parallèle ouvert, raccord parallèle, corps allongé ouvert) est réalisé à l’aide du serre-verrou. Fermez la plaie et pansez de la manière habituelle. Soins postopératoires Assurez-vous qu’un schéma de traitement par analgésiques, antibiotiques et immobilisation ainsi que des soins à domicile seront respectés. Informez les patients quant aux précautions qu’ils devront prendre dans la vie quotidienne pour assurer à l’implant une durée de vie utile maximum. Il est recommandé d’assurer un suivi postopératoire régulier afin de détecter précocement tout signe de défaillance de l’implant et d’envisager les mesures appropriées. Une détérioration du dispositif après la consolidation osseuse ne peut pas être interprétée comme une défaillance ou une détérioration des caractéristiques de l’implant. L’implant peut être retiré après la consolidation de la greffe osseuse. Un programme de réadaptation approprié doit être conçu et mis en œuvre. Il est extrêmement important que le patient comprenne et respecte les instructions et les avertissements postopératoires donnés par le chirurgien. Assurez-vous que le patient reçoit des instructions adéquates sur les soins postopératoires appropriés. La capacité et la volonté du patient à respecter les consignes sont parmi les facteurs les plus importants pour une cicatrisation efficace. Il convient d’apporter les conseils suivants : • Le patient doit être informé de l’importance d’éviter les chutes et les secousses subites du rachis. • Des consignes précises doivent être données au patient concernant l’utilisation et les limites du dispositif. • Lorsqu’une mise en charge partielle est recommandée ou nécessaire pour assurer une consolidation osseuse solide, le patient doit être averti que toute mise en charge excessive ou précoce, ou toute activité musculaire excessive risque d’entraîner des complications telles que la flexion, le desserrage ou la rupture des composants. Le risque de flexion, de desserrage ou de rupture d’un dispositif de fixation interne pendant la réadaptation postopératoire peut être accru si le patient est actif, affaibli, atteint de démence ou s’il utilise des appareils reliés à des poids. • Pour augmenter les chances de réussite de l’intervention chirurgicale, le patient ou le dispositif ne doivent pas être exposés à des vibrations mécaniques susceptibles de desserrer le montage du dispositif. Le patient doit être averti de ce risque et doit recevoir pour consigne de limiter ses activités physiques, notamment toute activité de soulèvement ou de torsion et tout type d’activité sportive physiquement exigeante. • Il convient de conseiller au patient de ne pas fumer ni utiliser des produits à base de nicotine ou consommer de l’alcool ou des anti-inflammatoires non stéroïdiens comme l’aspirine pendant le processus de régénération de la greffe osseuse. • Le patient doit être informé de son incapacité à fléchir au niveau du point de fusion de la colonne, et éduqué quant aux méthodes permettant de compenser cette limitation physique permanente du mouvement de son corps. En cas de non consolidation ou de desserrage, flexion et/ou rupture des composants, il convient de réviser et/ou retirer le ou les dispositifs immédiatement avant la survenue de toute lésion grave. Si l’os présentant une non consolidation retardée n’est pas immobilisé, des contraintes excessives et répétées se produiront au niveau de l’implant. Ces contraintes peuvent, par fatigue, finir par provoquer une flexion, un desserrage ou une rupture du ou des dispositifs). L’implant peut être retiré après la cicatrisation osseuse. Les implants sont plus susceptibles de se desserrer, se rompre, se corroder ou migrer chez les patients jeunes et actifs ; cela peut accroître le risque d’infection, entraîner des douleurs ou dévier les contraintes osseuses (« stress shielding »), et ce même après une cicatrisation normale. Le chirurgien doit prendre en compte les risques et avantages lors de sa décision de retirer ou laisser l’implant. Tout retrait d’implant doit être suivi d’une période de soins postopératoires appropriés pour éviter une nouvelle fracture. Chez les patients plus âgés ayant un faible niveau d’activité physique, le chirurgien peut choisir de ne pas retirer l’implant afin d’éviter les risques associés à une deuxième intervention chirurgicale. Les implants chirurgicaux explantés ne doivent jamais être réutilisés. Conseillez aux patients porteurs d’implants d’envisager l’utilisation d’antibiotiques prophylactiques avant qu’ils ne subissent une chirurgie ultérieure (comme des soins dentaires), notamment les patients présentant un risque accru d’infection. Seuls les chirurgiens orthopédistes spécialisés dans la chirurgie du rachis et ayant reçu une formation spécifique sur l’utilisation de ces systèmes de fixation rachidienne doivent procéder à leur implantation. La procédure chirurgicale est exigeante d’un point de vue technique et est associée à un risque de lésions graves chez le patient. Emballage Vérifiez tous les emballages sur réception pour vous assurer qu’aucun des composants n’est endommagé. Vérifier avec soin que tous les jeux sont complets et les composants pour s’assurer de l’absence d’endommagement avant l’utilisation. Retourner immédiatement au fabricant tout emballage endommagé sans en utiliser le contenu. Manipulation et stockage Entreposez les implants et les instruments des systèmes Silverton et Silverton-D avec soin. Avant chaque procédure chirurgicale, vérifiez le bon fonctionnement des instruments chirurgicaux spécifiques nécessaires pour les systèmes Silverton and Silverton-D. Nettoyage et décontamination Les implants et les instruments Silverton et Silverton-D ne sont pas fournis stériles. Les emballages et étiquettes doivent être complètement retirés avant de procéder aux étapes suivantes. Le nettoyage doit être effectué avant le traitement des implants et des instruments pour la stérilisation. Attention : Certaines solutions de nettoyage, comme celles contenant du formol, du glutaraldéhyde, de l’eau de Javel et/ou d’autres agents nettoyants alcalins peuvent endommager certains dispositifs, en particulier les instruments. Il convient d’éviter l’emploi de telles solutions. Remarque : Certains instruments doivent être démontés avant le nettoyage. Instructions pour le nettoyage en machine (recommandé) 1. Préparation du détergent a. Préparez du détergent enzymatique, en suivant le mode d’emploi et de préparation fourni par le fabricant. b. N’utilisez PAS des sérums physiologiques car ils ont un effet corrosif sur l’acier inoxydable. c. Le détergent doit avoir un pH presque neutre pour éviter une corrosion par piqûre ou un ternissement. 2. Préparation pour le trempage des dispositifs a. Pour éviter toute blessure, séparez les dispositifs pointus et tranchants des autres et manipulezles prudemment. b. Démontez les dispositifs comportant des pièces amovibles. c. Ouvrez les joints articulés, dentés ou filetés. d. Éliminez les débris importants ou de grande taille au moyen de lingettes non pelucheuses à usage unique imprégnées d’un agent nettoyant adapté. 3. Nettoyage et trempage a. Immergez les dispositifs dans le bain préparé. b. Brossez toutes les surfaces des les dispositifs immergés avec une brosse de nettoyage (n’utilisez pas de brosse métallique), en veillant à bien éliminer toute saleté visible. c. Selon les cas : i. Utilisez un écouvillon et une seringue pour nettoyer toutes les parties difficiles d’accès comme les canules, lumières, fentes et rainures. ii. Injectez plusieurs fois de la solution de rinçage sous pression au moyen d’une seringue pour rincer toutes les parties difficiles d’accès comme les canules, lumières, fentes et rainures. iii. Actionnez, pliez ou articulez les joints mobiles pendant le nettoyage. iv. Brossez l’intérieur des espaces creux sur toute leur longueur. d. Laissez tremper les dispositifs dans le bain de détergent pendant la durée recommandée par le fabricant. 4. Chargement des dispositifs dans la machine à laver a. Placez les dispositifs de sorte à éviter les entrechocs pendant le fonctionnement. b. Placez les articles lourds au fond et les pièces creuses dans les paniers de la machine. c. Veillez à ce qu’aucune pièce ne soit cachée par un objet de grande taille. d. Placez les instruments articulés en position totalement ouverte et les instruments cannelés horizontalement. e. Placez les instruments démontés dans les paniers de la machine. 5. Cycles de lavage et de séchage a. 2 minutes : Prélavage à l’eau froide ; évacuez l’eau. b. 5 minutes : Lavage à l’eau chaude avec détergent ; évacuez l’eau. c. 2 minutes : Neutralisation avec un détergent de pH neutre ; évacuez l’eau. d. 2 minutes : Rincez avec de l’eau chaude ; égouttez. e. Séchage à l’air chaud à 115 °C maximum. 6. Inspection a. Inspectez les dispositifs à l’œil nu, sous un éclairage normal, pour vérifier l’élimination de toute saleté visible adhérente (par exemple sang, substance protéique et autres débris) des surfaces, lumières, canules, fentes, dentelures, filetages, etc. b. En présence de saleté visible, répétez la procédure de nettoyage. Instructions pour le nettoyage manuel 1. Préparation du détergent a. Préparez du détergent enzymatique, en suivant le mode d’emploi et de préparation fourni par le fabricant. b. N’utilisez PAS des sérums physiologiques car ils ont un effet corrosif sur l’acier inoxydable. c. Le détergent doit avoir un pH presque neutre pour éviter une corrosion par piqûre ou un ternissement. 2. Préparation pour le trempage des dispositifs a. Pour éviter toute blessure, séparez les dispositifs pointus et tranchants des autres et manipulezles prudemment. b. Démontez les dispositifs comportant des pièces amovibles. c. Ouvrez les joints articulés, dentés ou filetés. d. Éliminez les débris importants ou de grande taille au moyen de lingettes non pelucheuses à usage unique imprégnées d’un agent nettoyant adapté. 3. Nettoyage et trempage a. Immergez les dispositifs dans le bain préparé. b. Brossez toutes les surfaces des les dispositifs immergés avec une brosse de nettoyage (n’utilisez pas de brosse métallique), en veillant à bien éliminer toute saleté visible. c. Selon les cas : i. Utilisez un écouvillon et une seringue pour nettoyer toutes les parties difficiles d’accès comme les canules, lumières, fentes et rainures. ii. Injectez plusieurs fois de la solution de rinçage sous pression au moyen d’une seringue pour rincer toutes les parties difficiles d’accès comme les canules, lumières, fentes et rainures. iii. Actionnez, pliez ou articulez les joints mobiles pendant le nettoyage. iv. Brossez l’intérieur des espaces creux sur toute leur longueur. d. Laissez tremper les dispositifs dans le bain de détergent pendant la durée recommandée par le fabricant. 4. Rinçage a. Sortez tous les dispositifs du bain de trempage. b. Rincez soigneusement les dispositifs à l’eau courante pendant au moins 1 minute. c. Nettoyez soigneusement les canules, les lumières et les cavités. 5. Bain à ultrasons a. Préparez un bain à ultrasons contenant un détergent capable d’éliminer le sang, en suivant le mode d’emploi et de préparation fourni par le fabricant. b. Couvrez ou fermez les dispositifs pendant le transport entre le rinçage et le bain à ultrasons pour éviter toute contamination. c. Placez les dispositifs dans le bain à ultrasons. d. Veillez à immerger complètement les dispositifs et évitez leur chevauchement. e. Traitez par ultrasons pendant 15 minutes. Pour éviter la corrosion, ne dépassez pas 15 minutes. 6. Rinçage à l’eau stérile a. Rincez soigneusement les dispositifs à l’eau purifiée stérile (c’est-à-dire obtenue par OI ou distillation) pendant au moins 3 minutes. 7. Séchage a. Séchez les dispositifs au moyen de lingettes absorbantes non pelucheuses jetables et/ou à l’air comprimé médical (l’intérieur des canules par exemple). b. Veillez à sécher totalement les dispositifs immédiatement après rinçage pour empêcher la corrosion. 8. Inspection a. Inspectez les dispositifs à l’œil nu, sous un éclairage normal, pour vérifier l’élimination de toute saleté visible adhérente (par exemple sang, substance protéique et autres débris) des surfaces, lumières, canules, fentes, dentelures, filetages, etc. b. En présence de saleté visible, répétez la procédure de nettoyage. représentant Biomet Spine local. Prévenez Biomet Spine immédiatement en cas d’incident ayant causé le décès d’un patient ou une blessure grave. Température Temps d’exposition Vide partiel 132 °C (270 °F) 10 minutes 55 minutes Vapeur Gravité 132 °C (270 °F) 15 minutes 55 minutes m m m m m w m m m m D m w Doel Het Biomet Spinale fixatiesysteem (SFS) (ook Silverton en Silverton-D genoemd) vertegenwoordigt een volledig en uitgebreid pedikelschroefsysteem dat bestaat uit implantaten en instrumenten die wervelkolomstabilisatie van spinale segmenten verzorgen bij skeletaal volgroeide patiënten in de thoracale, lumbale en sacrale wervelkolom. Net als met alle orthopedische chirurgische procedures is gedetailleerde preoperatieve planning essentieel. Preoperatieve diagnostische evaluatie gevolgd door zorgvuldig uitgevoerde chirurgische techniek is vereist. Postoperatieve verzorging, individueel aangepast aan de vereisten van de bepaalde verwonding/aandoening, is essentieel voor een optimaal resultaat. De chirurg moet volledig op de hoogte zijn van de risico’s en complicaties die inherent zijn aan dit soort operatie. Alleen personen met gespecialiseerde opleiding en ervaring in spinale chirurgie mogen het gebruik van de implantaten proberen. Beschrijving van het hulpmiddel De Silverton en Silverton-D systemen zijn een posterieure bevestiging van het spinale fixatiesysteem samengesteld uit een anatomisch geschaalde reeks pedikelschroeven, haken, longitudinale staven, stelschroeven, moeren, verschillende connectoren, speciale chirurgische instrumenten en sterilisatiedozen. De onderdelen worden gebruikt om een constructie te bouwen om stabilisatie te geven aan spinale segmenten in de thoracale, lumbale en sacrale wervelkolom om fusie te ondersteunen. De Silverton en Silverton-D hulpmiddelen maken deel uit van het Biomet spinale fixatiesysteem, hetgeen de chirurg verschillende implantaatonderdelen geeft waaruit een geschikte constructie kan worden samengesteld in overeenstemming met de behoeften en vereisten van elke individuele patiënt. Nadat een stevige fusie optreedt, heeft het systeem geen functioneel doel meer en dient het te worden verwijderd. Verwijdering is geïndiceerd omdat de implantaten niet bestemd zijn om krachten over te dragen of te ondersteunen die tijdens normale activiteiten ontwikkeld worden. Elke beslissing echter om het hulpmiddel te verwijderen moet worden genomen door de arts en de patiënt. Hierbij dient de algemene medische toestand van de patiënt en het mogelijke risico voor de patiënt van een tweede operatie in overweging te worden genomen. m w m m Waarschuwingen De veiligheid en effectiviteit van pedikelschroef spinale systemen zijn uitsluitend vastgesteld voor spinale aandoeningen met significante mechanische instabiliteit of deformiteit waarvoor fusie met instrumentatie nodig is. Deze condities zijn aanzienlijke mechanische instabiliteit of deformiteit van de thoracale, lumbale en sacrale wervelkolom secundair aan ernstige spondylolisthese (graad 3 en 4) van de L5-S1 wervellichamen, degeneratieve spondylolisthese met objectief bewijs van neurologische gebreken, fractuur, dislocatie, scoliose, kyfose, spinale tumor en gefaalde eerdere fusie (pseudoartrose). De veiligheid en effectiviteit van deze hulpmiddelen voor andere aandoeningen zijn niet bekend. Patiënten met een eerdere spinale operatie op de te behandelen niveaus kunnen andere resultaten hebben dan eerdere chirurgische resultaten. Voorzorgsmaatregelen • De Silverton en Silverton-D-implantaten zijn uitsluitend voor eenmalig gebruik. Een implantaat nooit opnieuw gebruiken zelfs als het niet gekrast of niet beschadigd lijkt. Hergebruik van implantaatonderdelen kan leiden tot verminderde mechanische prestatie, verkeerde werking of falen van het hulpmiddel. Een implantaat dat geïmplanteerd en daarna verwijderd is, moet worden weggeworpen. Gebruik voor elk geval alleen nieuwe implantaten. • De implantatie van het processus spinosus fixatiesysteem mag uitsluitend worden uitgevoerd door een ervaren spinale chirurg met specifieke opleiding in het gebruik van dit systeem wegens de technisch veeleisende procedure die een risico van ernstig letsel aan de patiënt vormt. • Gebaseerd op de moeheidstestresultaten moet de arts/chirurg de niveaus van implantatie, het gewicht van de patiënt, het activiteitsniveau van de patiënt, andere patiëntaandoeningen enz. overwegen die van invloed kunnen zijn op de prestatie van het systeem. • Preoperatief: De chirurg moet volledig op de hoogte zijn m D m w m m m • B m m m m D w G G m w m w w w w m • D MR m MR m • D O m m N H m w NB D w m w m m m w m w D m D m m m mm m mm w w w D w w m D w m m D m m m m m m w m m m H m m m Om N m m w m w w m m m w m H m w m m m m m D G m M m H m w G mm B m m m m mm m mm Nm w D mm H m m m G m G m mm mm m m m m m w D m mm m w N m mm m w w mm N Om w m M B m m m C mw m m mm m mm D m m D w w D m m w O mm mm w mm w w D P w m m D m m m m m m H m mm w w W P m m w m w w m m m m C m m B C D m w m m m m w m w m m mm m B m B m m m w m w m m B m mm + w © m m w m m m @ m w D B m N w m m m m H N w m w w w m m w m m m w m w mm w w w m B m H m m w + m m m m m w m M m m m m m m m m m m m w w w m m m M w w m D m C G w D m D m m M m C w m D w m B m m m w w w w m m mm m m m m m H m C w w m m w m w m m w m M m m m w w w w m w w m m m w m m D m H w Nm m mm D w D w w w m mm + % m w w w m m m RO m m m m m m m mm O Nm w m w mm N w m m D w m m w m O m G w m D + % m m w w m m m m w mm m m H w m m D w m m m m w m U m w m m m m w H w m w m D mm m w N m mm m m B m mm m w m m O m m w m mm N m m m w H m M m w m mm m m m m m m w ± % m m m w m m m w m m Dm B w W w w Hw m w w N m m + % w w G m H Dm O w m mm w w m w mm H m m m m m m N m H N m m m w w m m m m m w • m m B • C m w mm w m w m m mm w m w m m w m mm w D m w m w w W m w m m w m w w w w m m w D m m m w m w w m m m D m w m m w w m m H m W D Nm m m m w m m m w H m m m m mm m m mm mm D m • w m m m m w m w C w N mm H w m m m m m G • W • G • m m m w w w m m m w m B m m m m m G m G m w m m D mm mm m m w D m mm m m w m m D w m m w m m m m D N w m m w w Nm m Hw m Dm B w W m m m w m m m w m w D N D w w w w m m m m D w w w m m m B w G D m m m m w w m w w m m m m m H Dm O w m w D m m G B m m D m m w O m m w w m m m w w m m m w w m D m m m m m w B m mm m m w D m m m M P • N m m w w m mm m H w D • w m w w D mm w m m m w m m m D m m m m B D m m m m D G m mm mm m R m m ± % NB w D m m mw m w NB w m w D m m mm m D m N m m m m w m D m H m m m m B m m D m D m m w m m m m D w m w m m m C O m m m C w m m D w m N m m m w w m w m m m m m m m m m m m m m D w m m m B m m m w m m w m m m m mm m m w m w w m mm Indicaties voor gebruik De Silverton en Silverton-D-systemen zijn bestemd om te worden gebruikt voor het geven van immobilisatie en stabilisatie van spinale segmenten in skeletaal volgroeide patiënten als een hulpmiddel voor fusie van de thoracale, lumbale en/of sacrale wervelkolom. Het systeem is bestemd voor gebruik met autograft of allograft. De Silverton en Silverton-D-systemen zijn bestemd voor posterieure, niet-cervicale (T1-S2/ilium) pedikel en niet-pedikel spinale fixatie om te zorgen voor immobilisatie en stabilisatie van spinale segmenten in skeletaal volgroeide patiënten als een hulpmiddel voor de behandeling van de volgende instabiliteiten of deformiteiten: degeneratief discuslijden (DDD, gedefinieerd als rugpijn van discogene oorsprong met degeneratie van de discus bevestigd door geschiedenis en radiografische onderzoeken); spondylolisthese; trauma (d.w.z. fractuur of dislocatie); spinale stenose; deformiteiten of curvaturen (d.w.z. scoliose, kyfose en/of lordose); tumor; pseudoartrose; en gefaalde eerdere fusie. Mogelijke complicaties Mogelijke complicaties die specifiek zijn voor het hulpmiddel zijn onder andere: • Vroeg of laat verbuigen, breken, falen, losraken of bewegen/migreren van het implantaat • Botfractuur • Allergische reactie op het implantaatmateriaal Andere algemene complicaties in verband met elke spinale chirurgische ingreep kunnen onder meer zijn: nietfusie of vertraagde fusie; pseudoartrose; pijn; tweede operatie; bloeden; infectie, vroeg en laat; weefsel- of zenuwbeschadiging, waaronder scheuren in de dura of andere neurologische problemen; complicaties bij de incisie; littekenvorming; schade aan bloedvaten en aantasten van het cardiovasculaire stelsel; veranderingen in mentale staat; schade aan inwendige organen en bindweefsel; complicaties wegens het gebruik van bottransplantaten, waaronder complicaties bij de transplantaatdonorplaats; ademhalingsklachten; reacties op anesthesie en/of overlijden. m D Materialen De Silverton en Silverton-D systemen zijn vervaardigd uit titaanlegering beschreven door de ISO 5832-3 en ASTM F136 specificaties, commercieel zuiver titaan beschreven door ASTM F67 specificaties en kobaltchroomlegering beschreven door ASTM F1537 specificaties. Implantaatonderdelen van titaan en kobaltchroom kunnen samen in dezelfde constructie gebruikt worden. Implantaten van titaan en kobaltchroom mogen nooit worden gebruikt met roestvrij stalen implantaten. Contra-indicaties Contra-indicaties kunnen relatief of absoluut zijn. De keuze van een bepaald hulpmiddel dient zorgvuldig te worden afgewogen tegen de algehele evaluatie van de patiënt. De hieronder vermelde omstandigheden kunnen de kans op een succesvol resultaat verminderen. Contra-indicaties zijn onder andere: • Een allergie voor titaan- of kobaltchroomlegeringen, of gevoeligheid voor vreemde voorwerpen. Wanneer er materiaalgevoeligheid wordt vermoed, moeten vóór de implantatie de gepaste tests worden gedaan. • Bekende of vermoede infectie of incompetentie van het immune stelsel. Acute of chronische besmettelijke ziekten van welke etiologie of lokalisatie dan ook. • Enige aanwezige afwijking die van invloed is op het normale proces van bothermodelleren waaronder zonder beperking ernstige osteoporose van de wervelkolom, botabsorptie, osteopenie, actieve infectie bij de plaats of bepaalde metabolische stoornissen die osteogenese beïnvloeden. • Morbide obesitas. Een teveel wegende of zwaarlijvige patiënt kan belastingen op het spinale systeem produceren die tot falen van de fixatie van het hulpmiddel of van het hulpmiddel zelf kunnen leiden. • Elk neuromusculaire deficiet dat een ongewoon zware belasting op het hulpmiddel plaatst tijdens de genezingsperiode. • Open wonden. • Zwangerschap. • Elke andere medische of chirurgische toestand die het mogelijke voordeel van spinale chirurgie zou uitsluiten, zoals de aanwezigheid van aangeboren afwijkingen, verhoging van het bezinkselcijfer die niet verklaard wordt door andere aandoeningen, verhoging van de witte bloedplaatjestelling (WBC) of een duidelijke linkse verschuiving in de WBC-differentieeltelling. • Elk geval waarvoor het door elkaar gebruiken van onderdelen van systemen van andere fabrikanten nodig is. • Elk geval waar het mengen van implantaatonderdelen van roestvrij staal met titaan, of van roestvrij staal met kobaltchroom nodig is. • Koorts of leukocytose. • Tekenen van plaatselijke infectie of ontsteking. • Eerdere geschiedenis van infectie. • Alcoholisme of veel roken. • Seniliteit, mentale aandoening of drugsmisbruik van een dergelijke ernst dat de patiënt bepaalde nodige beperkingen en voorzorgsmaatregelen zou negeren bij het gebruik van het implantaat, wat tot falen of andere complicaties kan leiden. • Een patiënt die niet bereid is om de postoperatieve aanwijzingen te volgen. • Onvoldoende weefseldekking over de operatieplek. w m m m w D m Om m m m B m w D m w m w D m w D m w m m w m m G w m D m m m m m N • H m m m D SILVERTON SPINALE FIXATIESYSTEEM EN SILVERTON-D DEFORMITEITSYSTEEM GEBRUIKSAANWIJZING Les cycles de stérilisation recommandés ont été validés de façon à assurer un niveau garanti de stérilité (Sterility Assurance Level, SAL) d’au moins 10-6. Réclamations concernant le produit En cas de doutes concernant la qualité, l’identité, la durabilité, la fiabilité, la sûreté, l’efficacité et/ou les performances d’un produit, veuillez contacter directement Biomet Spine par e-mail (spinecomplaints@biomet.com) ou par téléphone au +1.866.956.7579. Pour le dépôt d’une réclamation, fournissez le ou les noms des composants, numéros de référence, numéros de lot, vos nom et adresse, l’objet de la réclamation, le nom du chirurgien et la date à laquelle vous avez pris connaissance de la réclamation. Stérilisez et renvoyez le ou les composants à votre m m m w G Lorsqu’une stérilisation à la vapeur pour usage immédiat (SVUI) est nécessaire, chacun des instruments de chirurgie manuels Silverton et Silverton-D peut être stérilisé individuellement en utilisant les paramètres de stérilisation suivants. Paramètres SVUI pour instrument individuel des systèmes Silverton et Silverton-D Méthode Cycle Température Temps d’exposition Vapeur Vide partiel 132 °C (270 °F) 3 minutes D m w Durée de séchage minimum Vapeur m Sauf indication contraire, toutes les marques de commerce sont la propriété de Biomet, Inc. ou de l’une de ses filiales. m w mm w ©Biomet Spine, LLC 2014. Tous droits réservés. m w m Pour tout complément d’information Si vous souhaitez des instructions supplémentaires sur l’utilisation de ce système, veuillez contacter le service clients de Biomet Spine par courriel : spinecustomerservice@biomet.com, Tél. : +1.303.443.7500, Fax : +1.303.443.7501. Paramètres de stérilisation des implants, instruments et jeux de composants des systèmes Silverton et Silverton-D Cycle m P D Manuel de technique chirurgicale Le manuel de technique chirurgicale peut être obtenu en contactant le service clients de Biomet Spine (coordonnées ci-dessous). Stérilisation Les implants et les instruments des systèmes Silverton et Silverton-D sont fournis non stériles. Il faut les nettoyer et les stériliser avant utilisation. Le processus de stérilisation recommandé est une stérilisation en autoclave à la vapeur, en utilisant les paramètres des tableaux ci-dessous. L’utilisation d’un emballage est recommandée pour maintenir la stérilité avant l’utilisation (aux États-Unis, l’emballage doit être conforme aux exigences de la FDA). Méthode O B m m m m m @ m m m m + C m B m m m O O SHEET 2 o 2 B ome Sp ne LLC 310 n e ocken Pa kway Su e 120 B oom e d CO 80021 USA 800 447 3625 303 443 7500 www b ome sp ne com FU7721 0310CE 05 B ome U K L d Wa e on ndus a Es a e B dgend Sou h Wa es CF31 3XA Un ed K ngdom 441 65 66 55 221 MPORTANT NFORMAT ON ON THE S VERTON SP NA F XAT ON AND S VERTON D DEFORM TY SYSTEMS S ve on Sp na F xa on and S ve on D De o m y Sys ems 2