Química general II - Departamento Estrella Campos
Anuncio

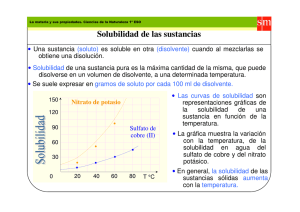
Química General II Curso de laboratorio Práctico 2 Página: 1/6 DEPARTAMENTO “ESTRELLA CAMPOS” PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD Bibliografía: “Química, La Ciencia Central”, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall, Hispanoamérica, México, 7a Edición, 1998, págs. 6-7 y 17-18. 1- OBJETIVOS 1.1 Determinar la solubilidad del KNO3 a distintas temperaturas. 1.2 Medir la densidad de sólidos y líquidos. 2- CONCEPTOS PREVIOS 2.1 Solubilidad Las soluciones son mezclas homogéneas, de composición variable, de dos o más sustancias, dispersas a escala molecular. Por convención, se denomina disolvente (o solvente) al constituyente en mayor cantidad y soluto al (los) constituyente(s) minoritario(s). Las soluciones no implican necesariamente un disolvente líquido y un soluto sólido, sino que se pueden dar todas las combinaciones posibles de los tres estados de agregación de la materia. Se denomina solubilidad a la cantidad máxima de soluto que se disuelve en una cantidad dada de disolvente para formar una solución estable en determinadas condiciones de presión y temperatura. Existen varias formas de expresar la solubilidad de una sustancia en un disolvente dado. Las más usadas son: gramos de soluto disueltos en un litro de solución (g/L) y gramos de soluto disuelto en 100 g de disolvente (g/100g). La presión y temperatura influyen sobre la solubilidad en mayor o menor grado, dependiendo de la naturaleza del soluto y del disolvente. El aumento de la presión aumenta la solubilidad de los gases en líquidos, y tiene, en general, muy poco efecto sobre la solubilidad de sólidos y líquidos en disolventes líquidos. El aumento de la temperatura disminuye la solubilidad de gases en líquidos, mientras que la de líquidos y sólidos generalmente aumenta. La representación gráfica de la solubilidad versus la temperatura para un soluto y disolvente dados, se denomina curva de solubilidad. Química General II Curso de laboratorio Práctico: 2 Página: 2/6 2.2 Densidad La densidad es la masa (por ejemplo, expresada en gramos) por unidad de volumen (por ejemplo 1 mL) de una muestra: d = m/V. Puede ser expresada en g/mL u otro múltiplo o submúltiplo de estas unidades. La densidad de los líquidos y sólidos varía muy poco con la temperatura y la presión. En cambio, la densidad de los gases es muy dependiente de ambas m variables. Al respecto, recuerde la ley de los gases ideales: pV = nRT = RT , por lo que PM m p PM , donde PM es el peso molecular del gas. d= = V RT 3- PROCEDIMIENTO EXPERIMENTAL 3.1 Determinación de la solubilidad del KNO3 en agua a distintas temperaturas y construcción de la curva de solubilidad correspondiente Verificar que dispone de 6 tubos de ensayo, cada uno con una tapa y una varilla de vidrio. Los tubos están rotulados del 1 al 6 y contienen 10,0 g, 8,5 g, 7,5 g, 6,5 g, 6,0 g y 5,0 g de nitrato de potasio en 5 mL de agua destilada, respectivamente. Colocar los tubos en un vaso de Bohemia que contiene agua suficiente para cubrir el nivel de los tubos de ensayo (baño de agua). Colocar un termómetro dentro del baño de agua. Calentar y agitar suavemente el contenido de los tubos hasta que la disolución sea completa en todos ellos. Retirar el mechero y dejar enfriar, agitando vigorosamente cada tubo, comenzando por el más concentrado (tubo 1). Cuando comience la cristalización, leer y anotar inmediatamente la temperatura del baño. Repetir el procedimiento anterior para los tubos 2 al 6. Determinar las restantes temperaturas de cristalización y anotarlas. Graficar la solubilidad en g KNO3 /100g H2O versus la temperatura de cristalización. Dejar los tubos con su contenido en la gradilla. 3.2 Determinación de la densidad de un líquido Pesar una probeta de 100 mL limpia y seca. Anotar su masa en el cuadro correspondiente (Masa1). Medir en la misma probeta 40 mL del líquido cuya densidad se desea determinar (líquido 1). Pesar el sistema (probeta + líquido) y anotar la masa (Masa2). Medir la temperatura de trabajo. Calcular la densidad del líquido. Medir la densidad del líquido con un densímetro y anotar ese valor. Repetir el mismo procedimiento para el líquido 2. Química General II Curso de laboratorio Práctico: 2 Página: 3/6 3.3 Determinación de la densidad de un sólido Medir 30 mL de agua en una probeta (volumen inicial). Pesar el sólido cuya densidad se desea determinar (sólido de forma irregular), anotar su masa e introducirlo en la probeta con cuidado de no derramar líquido y de que no se formen burbujas. Leer el volumen de la probeta (volumen final). A partir del cambio de volumen leído en la probeta determinar el volumen del sólido. Calcular su densidad. Repetir el mismo procedimiento para un sólido de forma regular. Luego, medir sus dimensiones y calcular su volumen en forma algebraica. Calcular la densidad del sólido. 3.4 Disposición de residuos Líquido 1: descartar en recipiente rotulado como “Líquido 1 para reutilizar”. Líquido 2 : descartar en recipiente rotulado como “Líquido 2 para reutilizar”. Química General II Curso de laboratorio Práctico: 2 Página: 4/6 INFORME PRÁCTICO 2: ALGUNAS PROPIEDADES DE LA MATERIA: SOLUBILIDAD Y DENSIDAD FECHA: GRUPO: INTEGRANTES: DATOS, CÁLCULOS Y RESULTADOS Determinación de la curva de solubilidad del KNO3 Tubo Masa de KNO3 (g) Volumen Solubilidad Temperatura de agua (g KNO3 /100 g H2O) (ºC) (mL) 1 2 3 4 5 6 Ud. ha verificado que la solubilidad del KNO3 en agua aumenta con la temperatura. ¿Es éste el comportamiento que presentan todas las sustancias? ___________________________________________________________________________ ___________________________________________________________________________ Química General II Curso de laboratorio Práctico: 2 Página: 5/6 Gráfico: Solubilidad del KNO3 (g/100g H2O) en función de la temperatura (ºC) Determinación de la densidad de un líquido Líquido 1 Líquido 2 Nombre del líquido Masa1 (g) Masa2 (g) Masa líquido (g) Volumen líquido (mL) Temperatura (ºC) Densidad calculada (g/mL) Densidad medida con densímetro (g/mL) Compare la densidad calculada a partir de la masa y el volumen del líquido con la densidad medida con el densímetro. ___________________________________________________________________________ ___________________________________________________________________________ Química General II Curso de laboratorio Práctico: 2 Página: 6/6 Determinación de la densidad de un sólido Sólido irregular Nombre del sólido Masa de muestra (g) Volumen inicial, agua (mL) Volumen final, agua + muestra (mL) Volumen sólido (mL) Densidad (g/mL) Volumen calculado (mL) Densidad calculada (g/mL) ----- Sólido regular