CROMATOGRAFÍA EN FASE VAPOR
Anuncio

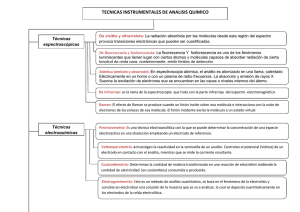
UNIDAD TEMÁTICA 2 TÉCNICAS DE LABORATORIO 2.4 CROMATOGRAFÍA DE GASES CROMATOGRAFÍA EN FASE VAPOR La cromatografía en fase vapor o cromatografía gas-líquido, se usa mucho en la resolución de mezclas de compuestos volátiles (o derivados volátiles preparados si los compuestos iniciales no son lo suficientemente volátiles) que pueden diferir en los puntos de ebullición en sólo una fracción de grado. Se usa, mayoritariamente, como técnica analítica pero, también existe en forma preparativa y es una alternativa excelente a la destilación fraccionada cuando las cantidades de material a separar son elevadas. Es, probablemente, más fácil pensar en la cromatografía en fase vapor como un híbrido entre la cromatografía y la destilación. La muestra que se quiere analizar se volatiliza y se arrastra por una corriente de gas portador a través de una columna calentada que contiene una fase estacionaria, absorbida sobre un soporte o simplemente sobre las paredes internas de la columna. Estas suelen ser de acero o de vidrio y suelen presentarse enrolladas para que se puedan introducir en el horno. Al principio se utilizaron columnas con la fase estacionaria sobre soporte pero, como ofrecían resistencia al paso del gas y esto limitaba su longitud y también su capacidad de separación, actualmente se utilizan columnas capilares en las que la fase estacionaria se enlaza a las paredes de un largo tubo de pequeñísimo diámetro, que ofrece menor resistencia al flujo y permite longitudes por encima de los 50 m, con un aumento fenomenal del poder de resolución. Como en otro tipo de cromatografía, los componentes de la mezcla de partición entre la fase estacionaria y el gas portador se deben a la combinación de la volatilidad y del grado con el que interactúa con la fase estacionaria. Los componentes separados eluyen entonces de la columna y pasan al detector. El tiempo que pasa entre la inyección en la columna y la salida de un componente concreto se denomina tiempo de retención e, igual que como el Rf de un compuesto en cromatografía en capa fina, es útil como diagnóstico para una columna y un conjunto de condiciones dadas. Continuando con la analogía entre la cromatografía de absorción y la cromatografía gas-líquido, el aumento de la velocidad de flujo del gas portador es equivalente al aumento de la velocidad de elución de una cromatografía en columna. La elevación de la temperatura del horno en el que se encuentra la columna aumenta la velocidad de elución en cromatografía gas-líquido de la misma forma que el uso de un disolvente más polar en la cromatografía en columna. El equivalente directo del gradiente de elución es la programación de temperatura en la que se puede ir aumentando la temperatura de la columna durante el análisis para acelerar la velocidad de elución de los componentes menos móviles de la mezcla. Gas portador: ha de ser inerte frente al material de la columna y los componentes de la muestra. Dependiendo del detector pueden usarse nitrógeno, hidrógeno, helio o argón. Cuando se usa detector de ionización de llama, en el que se quema la muestra al salir de la columna, se introduce en él una mezcla de hidrógeno y aire para quemar. El helio es el más usado en columnas capilares debido a su baja viscosidad. Se deben de controlar muy bien las velocidades del flujo si se quiere que las medidas de los tiempos de retención tengan algún valor. Columnas: puesto que las que se van a utilizar son capilares sólo se tratará de ellas. Fueron inicialmente propuestas por M. J. E. Golay y consisten en un fino tubo hueco de diámetro interno menor de 0’5 mm, cuyas paredes seimpregnan de la fase estacionaria. La eficiencia de resolución de estas columnas, a menudo expresada según el número de platos teóricos por analogia con la destilación, alcanza los 500.000 platos teóricos cuando las antiguas empaquetadas alcanzaban, como máximo, los 20.000 platos teóricos. Otros hechos que hacen más conveniente a las columnas capilares son: • • • • • Se necesitan menores cantidades de muestra. Loslímites de detección son los mismos aunque se use menos muestra debido a la agudeza de los picos. Los tiempos de elución, para resoluciones equivalentes, son aproximadamente la décima parte más cortos. Las temperaturas de la columna son, aproximadamente, 20º menores. Casi cualquier muestra puede separarse utilizando una de las cuatro fases estacionarias: OV-101, SE-30 (muestras no polares), OV-17 (muestras de polaridad media) y CarbowaxR-20M (muestras polares). Esas fases estacionarias citadas cumplen las condiciones de ser estables térmicamente, no reactivas y no volátiles en el rango de trabajo de la columna. Todas poseen una temperatura máxima de uso, que no debe alcanzarse nunca, puesto que a partir de ella se produce su degradación. El horno: debe mantener la temperatura de manera muy precisa ya que la temperatura de la columna tiene un efecto directo en los tiempos de retención de los componentes y esto ha de ser así también cuando se usen programas de temperatura. Para que la temperatura sea la misma en todo el horno tienen un ventilador que hace circular el aire. El detector y los factores de respuesta: pueden usarse varios tipos de detectores pero el más común es el detector de ionización de llama. En él se quema el gas que sale de la columna y se detectan los iones producidos en la llama y se convierten en corriente eléctrica. Cuando un compuesto eluye de la columna esto causa un aumento en la producción de iones con el aumento correspondiente en la corriente enviada al registrador lo que da origen al trazo del pico. No se pueden relacionar directamente las áreas de los picos con las cantidades relativas del compuesto en la muestra porque los diferentes compuestos dan lugar a cantidades diferentes de iones, por ello es necesario calcular los factores de respuesta relacionando las áreas de los picos con cantidades conocidas de muestras patrones. Aún así hay que aceptar que compuestos del mismo tipo de estructura tendrán factores de respuesta muy similares y que las áreas relativas de los picos se pueden comparar, ya que se perdería mucho tiempo y, además, a veces no se poseen los patrones necesarios, si hubiera que calcular los factores individuales. El tratamiento de los picos se solía hacer considerando cada pico como un triángulo, siendo su área el producto de la altura por la base, medida a la mitad de la altura (para evitar el error que se cometería si se tomara la base del pico), pero los cromatógrafos modernos están provistos de integradores que, automáticamente, determinan el tiempo de retención y el porcentaje en peso de cada compuesto en la mezcla. Preparación de muestra: se prepara una disolución de la muestra en diclorometano, tolueno o acetona, en una concentración de 1 a 2 mg/ml. La disolución no debe tener partículas en suspensión que podrían atascar la jeringa. Obviamente, la muestra ha de ser lo suficientemente volátil para permitir su análisis por cromatografía gas-líquido pero, si no lo fuera, es posible convertirla en un derivado que sí sea volátil. Introducción de la muestra en la columna: las muestras se introducen en la columna vía el inyector, que consiste en un adaptador al comienzo de la columna que lleva un septum que es perforado usando una jeringa cuyo volumen es de microlitros y que es la que lleva la muestra. Estas jeringas son de alta precisión, diseñadas para inyectar cantidades exactas de líquidos medidas en microlitros; han de ser limpiadas antes y después de cada uso, unas 10 veces con disolvente puro al total de su volumen (unos 10µl). El volumen de muestra a inyectar es de 0,5 a 5 µl y, normalmente, es de 1 µl. Llenado de una jeringa http://www.chemistry.sjsu.edu/straus/visioche.htm La inyección se realiza sujetando la jeringa con las dos manos como indica la figura, pinchando el septum lentamente sin inyectar todavía la muestra, y con un rápido movimiento se aprieta el émbolo hasta que se introduce todo el volumen de muestra. Se pone en marcha el cromatógrafo y se retira la jeringa. ¡Se lava inmediatamente 10 veces con disolvente puro! Registro del cromatograma: la muestra está en la columna y, si todo va bien, aparecerá un registro similar al de la figura. Todos los picos han de entrar en el cromatograma por lo que pueden usarse sensibilidades distintas del detector, esto se aplica normalmente a los picos de los disolventes de la muestra que deben ser los primeros en eluir. La forma ideal de los picos es la gausiana o la más cercana a ella, si aparecen picos con colas puede ser necesario utilizar una columna menos polar y si los picos tienen forma de dientes de sierra es que se ha inyectado demasiada muestra y se ha inundado la columna, esto se resuelve pinchando menos volumen. Si aparecen picos que no corresponden a la muestra puede deberse a que, en análisis anteriores, no se ha hecho completa la elución de todos los componentes de la muestra. Para evitar esto, cada cierto tiempo de uso de la columna se sangra calentándola durante toda una noche a una temperatura cercana a la máxima de trabajo pasando sólo gas portador a su través. Coinyección como muestra de identidad: para comparar si un compuesto desconocido tiene el mismo tiempo de retención que una muestra conocida, se realiza un análisis simultáneo de ambos preparando una disolución que los contenga a los dos y cuidando que ninguno predomine demasiado sobre el otro. Si aparecen dos picos son seguro dos compuestos diferentes, si aparece uno sólo, hay cierta similitud que debe comprobarse con otros métodos. Si no se quiere preparar una disolución mezclando los componentes puede prepararse una disolución de cada uno de ellos con igual concentración y coger con la jeringa un mismo volumen de cada disolución e inyectar el total simultáneamente en la columna. 2.4.1 Separación de una mezcla de alcoholes primarios en condiciones isotermas y de temperatura programada Cuestionario previo a la realización de la práctica 1 ¿Qué condiciones han de cumplir las muestras para poder someterlas a esta técnica? 2 ¿Es válida esta técnica para la determinación de estructuras? 3 ¿Son recuperables los componentes de la muestra tras realizar el análisis? ¿Por qué? 4 ¿Qué factores influyen en la separación de los componentes? ¿Cómo afecta cada uno? 5 ¿Cuál es la relación existente entre el área del pico correspondiente a un compuesto y su concentración en la muestra? 6 ¿Se pueden establecer comparaciones respecto al área dentro de un mismo cromatograma para los diferentes compuestos? ¿Por qué? 7 ¿Cómo se podrían llevar a cabo análisis cualitativos? Sección experimental Reactivos Etanol, propanol, butanol, pentanol, cloroformo. Material Jeringa de 10 ml para cromatografía gas-líquido. Se coloca la temperatura del horno para el análisis isotérmico a 50º C y, mientras alcanza el equilibrio, se prepara la muestra para el análisis. Se prepara una disolución de cada uno de los alcoholes en CHCl3 (por ejemplo, 2 ml de alcohol + 2 ml de CHCl3). Se inyecta 1 µl de cada una de estas disoluciones en el cromatógrafo y se observa el cromatograma resultante. Si los picos se salen de escala o son demasiado pequeños, se realizan los cambios necesarios para corregir el problema y se vuelve a inyectar la muestra. Se mide el tiempo de retención para cada componente. Se prepara el horno para un análisis con temperatura programada, con una etapa isoterma inicial de 3 minutos a 50º C seguida por una rampa de calentamiento de 10º C por minuto hasta alcanzar los 100º C. El análisis se repite en estas condiciones y se compara el cromatograma obtenido con el anterior comentando las diferencias. Se comparan los resultados con los obtenidos en el primer análisis. Por otra parte, se prepara una mezcla formada por 2 ml de cada una de las cuatro disoluciones de los alcoholes y esta mezcla se divide en dos partes iguales (A y B). La parte A se divide a su vez en varios viales a los que se puede añadir una o dos gotas del alcohol que se desee (consultar al profesor). La parte B sirve de control. Se analiza cada una de esas muestras y, viendo qué pico aumenta en cada caso, se asigna la estructura correspondiente en la mezcla. 2.4.2 Reducción de 4-t-butilciclohexanona con borohidruro de sodio La reducción de un grupo carbonilo en cetonas no simétricas a un alcohol secundario crea un nuevo centro asimétrico. El resultado estereoquímico de tal reacción depende de la cara por la que sea atacado el grupo carbonilo por el reactivo, pero los dos posibles alcoholes secundarios producidos sólo son distinguibles si en la cetona inicial existe un “marcador” estereoquímico. Este experimento ilustra la reducción de 4-t-butilciclohexanona con exceso de borohidruro sódico. El voluminoso grupo t-butilo permanece en la posición ecuatorial en la conformación silla del anillo de seis miembros y, por tanto, los dos posibles alcoholes producto tendrán el grupo OH en posición axial o ecuatorial. Se comprobará que estos alcoholes se forman en cantidades diferentes y que sus relaciones se pueden determinar por cromatografía gas-líquido. Sección experimental Reactivos y disolventes 2 Erlenmeyer de 50 ml, agitador magnético, núcleo de agitación, vaso de 250 ml, embudo de decantación de 250 ml, matraz de fondo redondo de 50 ml, embudo de placa de vidrio, pieza de filtración. Material 4-t-Butilciclohexanona, borohidruro de sodio, etanol, éter dietílico, éter de petróleo, ácido clorhídrico. Se disuelven 1’54 g (10 mmol) de 4-t-butilciclohexanona en 20 ml de etanol en un matraz erlenmeyer de 50 ml. Se agita la disolución magnéticamente a temperatura ambiente y se adicionan 0’19 g (5 mmol) de borohidruro de sodio en pequeñas porciones, durante 15 minutos. Si es necesario, los restos de borohidruro de sodio se arrastran con 5 ml de etanol. Se mantiene la mezcla agitando a temperatura ambiente 30 minutos más y después, se vierte en un vaso de 250 ml que contenga 50 ml de hielo/agua. Se añaden lentamente 5 ml de ácido clorhídrico 1 M y se sigue agitando 10 minutos más. Se transfiere la mezcla a un embudo de decantación de 250 ml y se extrae con 2x25 ml de éter etílico. Se secan los extractos combinados de éter con MgSO4. Se filtra y se separa 1 ml de la disolución etérea filtrada en un tubo para el análisis por cromatografía gas-líquido. Se evapora el resto del filtrado en rotavapor y se recristaliza el residuo sólido de éter de petróleo (40-60º C). Se calcula el rendimiento, el punto de fusión y el espectro de IR del producto, tras la recristalización. Se compara con el espectro de IR de la cetona inicial. Análisis por cromatografía gas-líquido: se analiza la solución etérea del producto crudo de reacción usando una columna CarbowaxR. Se determina la relación de los alcoholes isómeros cis y trans por las áreas relativas de los picos. El isómero cis tiene el tiempo de retención menor. Registre el cromatograma de una muestra de 4-t-butilciclohexanona como referencia para comprobar si la reducción ha sido completa. Bibliografía 1 Harwood, L. M., Moody, C. J.; Experimental Organic Chemistry, 1989, Blackwell Scientific Publications. 2.4.3 Análisis de la mezcla de isómeros de la 2,6-dimetilciclohexanona comercial La cetona 2,6-dimetilciclohexanona es accesible comercialmente como una mezcla de isómeros, sin que se especifique la proporción de isómeros ni la identidad del isómero mayoritario. Estos isómeros se separan fácilmente por cromatografía de gases y muestran la presencia de una proporción 81:19, un hecho que, en sí mismo, no identifica al isómero mayoritario. Sin embargo, después de la reducción con borohidruro de sodio el isómero cis puede proporcionar dos alcoholes producto, mientras que el isómero trans puede dar un sólo alcohol. Dado que todos los posibles alcoholes isoméricos se separan y cuantifican mediante cromatografía de gases, esta reacción permitirá determinar qué cetona es el isómero mayoritario en la 2,6-dimetilciclohexanona comercial. Sección experimental Reactivos y disolventes Hexano. 2,6-dimetilciclohexanona comercial Aldrich, diclorometano, metanol, borohidruro de sodio, Material Pipeta, 3 viales. La proporción de isómeros en la cetona se determina, inicialmente, mediante análisis de cromatografía de gases de 2,6-dimetilciclohexanona comercial, con el sistema programado desde 80º C hasta, aproximada–mente, 100º C y a 2º C por minuto. Se emplea una concentración de cetona de alrededor de 2/3 gotas en 2 ml de diclorometano, con una inyección de 1 µl . Después 10 µl de la cetona comercial se disuelve en 15 gotas de metanol en un vial de 10 ml y se añaden dos puntas de espátula pequeña de borohidruro de sodio de 10-40 mesh. El líquido se agita hasta la disolución del borohidruro de sodio. Entonces se añaden alrededor de 0’5 ml de una disolución acuosa saturada de NaHCO3 y 1-2 ml de hexano; el vial se tapa y se agita vigorosamente durante unos segundos. Una vez que las fases se han separado (la fase orgánica debe estar clara) se emplea una jeringuilla de 10 µl para tomar alrededor de 1 µl de la fase de hexano (fase superior) para el análisis mediante cromatografía de gases, usando las mismas condiciones que en la cetona original. Bibliografía 1 Garner, C. M.; J. Chem. Educ., 1993, 70, A310-A311. Cuestionario sobre la práctica realizada 2.4.1. Análisis isotérmico de una mezcla de alcoholes. 1 Indique las diferencias observadas entre los cromatogramas a temperatura constante y programada. 2 Identifique cada uno de los alcoholes a 50º C. 3 Identifique el alcohol desconocido. 4 Indique el tiempo de retención del alcohol desconocido a temperatura programada. 2.4.3. Análisis de la mezcla de isómeros de la 2,6-dimetilciclohexanona comercial. 1 ¿Por qué el isómero trans del material de partida sólo da lugar a un alcohol? 2 Determine cuál es el isómero mayoritario y detalle los cálculos realizados para llegar a esta conclusión. 2.4.4 INSTRUCCIONES DE USO DEL CROMATÓGRAFO DE GASES Al principio de cada sesión de prácticas se realizan las operaciones siguientes : Se enciende la impresora pulsando el botón que tiene en un lateral. Se enciende el ordenador, pulsando el botón correspondiente, y la pantalla en el de la derecha. Se pulsa la tecla INTRO y se siguen las instrucciones que aparecen en la pantalla. Se pulsan las teclas CONTROL+ALT+Suprimir y aparece Usuario : amv, y Contraseña : Toñi. Error de red : aceptar. En la pantalla del ordenador aparece minimizada, abajo, una ventana que es la del programa de trabajo : CAG Boot Server, se abre. Se enciende el cromatógrafo, pulsando la tecla que se encuentra en el lateral izquierdo. Se abren los gases, primero el Helio, gas portador, y luego el Hidrógeno y el aire para el detector. Son los manorreductores colocados en la pared, detrás del cromatógrafo y cada uno lleva la identificación del gas en la conducción. En la pantalla del ordenador se ven dos iconos con las leyendas siguientes Instrument 1 on line e Instrument 1 off line, se abre con doble clic el marcado como Instrument 1 on line. Aparece la pantalla del programa que controla el funcionamiento del cromatógrafo. En el menú Method : Load Method Aparece una lista con todos los métodos existentes. Se marca inicio.m El método cargado aparece en la parte superior de la pantalla. Menú Instrument : Edit Parameters Se abre una ventana con los iconos del inyector, el horno, el detector y se puede ver el estado actual de cada uno. Detector : cuando se calienta, se enciede por lo que se oye una pequeña explosión. Si no se escucha, se comprueba que los flujos de los gases son los correctos y, si lo son, se pulsa Reignite. Debe aparecer en el listado que el detector está On. A partir de aquí son las instrucciones para cada alumno que lleva a cabo la práctica : A continuación se carga el método correspondiente al análisis que se vaya a realizar: ➡ 1ALCOHOL.M si es el de alcoholes isotermo a 50º . ➡ 2ALCOHOL.M si es con rampa de temperatura. ➡ 2CETONA.M si es la 2,6-dimetilciclohexanona. ➡ TCETONA.M si es la t-butilciclohexanona. ➡ Menú Run control : Info Sample Aparece una pantalla para crear la carpeta de cada alumno, guardar los datos de análisis, escribir el operador, el nombre de la muestra, hacer comentarios…se rellena. Subdirectory File Data con extensión .D, si no, no se guardan los datos y no se pueden recuperar si se quiere variar algún parámetro, por ejemplo, los límites de la escala, y el análisis siguiente machaca lo anterior. En esa misma pantalla se le da Run Method. En el ángulo superior izquierdo, aparece el estado del cromatógrafo respecto al método. Se vuelve de color violeta cuando se han alcanzado las condiciones y pone Run progress, waiting injection. En el visor del cromatógrafo también debe poner Ready for manual injection. La inyección se realiza en el inyector, que es la tuerca de color verde que está en la parte superior del cromatógrafo. Después de pinchar, se presiona la tecla Start del cromatógrafo. Menú Wiew: on line signal plot------Signal Window 1. Aparece una ventana, on line plot, que se agrada y, en ella, se ve como corre el cromatograma. Se puede dejar transcurrir todo el tiempo del método y, al terminar éste, automáticamente se abre una pantalla en la que se puede ver el informe y se imprime. Si la muestra es conocida y se sabe cuántos picos tiene y se ve que salen antes de que haya transcurrido todo el tiempo del método y se quiere terminar el análisis, en el menú Run control ------Stop run/inject------ y también imprime automáticamente el informe del análisis. Al final de la sesión de laboratorio, para apagar el sistema : Se carga el programa Apagado.m Se cierran los manorreductores del aire y del hidrógeno, girándolos hacia la izquierda. Cuando la temperatura del inyector, del detector y de la columna es de 50º C se puede cerrar el manorreductor del helio. Para cerrar el programa, en el menú File ---Exit. Así se cierra el Instrument 1 on line. Para apagar el cromatógrafo se pulsa la tecla que está en el lateral izquierdo. En el ordenador, se cierra la ventana del programa CAG Boot Server. Para apagar el ordenador, botón Inicio : apagar sistema cerrar equipo Sí Y se espera hasta que aparezca la pantalla de Windows NT diciendo que se puede apagar el equipo.