Document
Anuncio

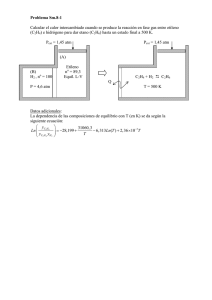
TERMODINÁMICA ¿Por qué necesitamos saber esto? La Termodinámica es esencial para la química. Explica por qué las reacciones tienen lugar y nos permite predecir la cantidad de calor que liberan y el trabajo que pueden realizar. Forma parte de nuestras vidas, ya que el calor emitido por los combustibles al quemar y los recursos energéticos aportados por los alimentos que ingerimos, están gobernados por principios termodinámicos. En este tema se establecen los conceptos básicos que son necesarios para abordar el estudio de la asignatura QuímicaFísica. El objeto de la Termodinámica es el estudio de la energía y sus transformaciones, entendida esta como la capacidad de un sistema para realizar un trabajo o para suministrar calor Sistema y entorno ENTORNO SISTEMA ENERGÍA CONCEPTOS BÁSICOS. SISTEMAS, VARIABLES Y PROCESOS Sistema: Parte del universo que es objeto de estudio. Entorno, alrededores, medio ambiente: Resto del universo Tipos de sistemas Puede intercambiar Abierto Materia Energía Cerrado Materia Aislado Materia Energía ¿Qué separa el sistema de los alrededores? Paredes Rígida Permeable Adiabática Semipermeable Móvil Impermeable Diatérmicas Pared permeable Pared semipermeable Pared impermeable 60ºC 40ºC 50ºC 50ºC Pared diatérmica 60ºC 40ºC Pared adiabática 60ºC 40ºC En termodinámica, la descripción del estado de un sistema se realiza mediante los valores de determinadas propiedades macroscópicas denominadas variables termodinámicas, tales como p, V, T, m, ... No todas estas variables son independientes, basta conocer los valores de un pequeño número de ellas para caracterizar el sistema. Estas variables independientes se denominan variables de estado. Toda función que pueda expresarse con ayuda de las variables de estado se denomina función de estado del sistema. Los sistemas se presentan de diferentes formas ⇒ ESTADOS caracterizados por VARIABLES termodinámicas Variable = Propiedad Termodinámica = Función de Estado No dependen de la historia Tipos de variables Intensivas •No dependen de la cantidad de materia del sistema • Ej: T, P, ρ • No son aditivas Extensivas •Dependen de la cantidad de materia del sistema •Ej: m, V • Son aditivas Si las propiedades macroscópicas intensivas a lo largo de un sistema son idénticas el sistema de denomina homogéneo Si por el contrario estas propiedades no son idénticas el sistema se denomina heterogéneo Un sistema heterogéneo puede constar de varios sistemas homogéneos a estas partes se les llama fases En este caso tenemos tres fases, la sal no disuelta, la solución y el vapor de agua Funciones de estado • Una función de estado es cualquier propiedad que tiene un único valor cuando el estado del sistema está definido. • Una muestra de agua a 293,15 K y a la presión de una atmósfera está en un estado especificado. • d = 0,99820 g/mL. • Esta densidad es una función única del estado. • No importa cómo se haya establecido el sistema. Funciones de estado 1) Al asignar valores a unas cuantas, los valores de todas las demás quedan automáticamente fijados. 2) Cuando cambia el estado de un sistema, los cambios de dichas funciones sólo dependen de los estados inicial y final del sistema, no de cómo se produjo el cambio. ∆X = Xfinal –Xinicial Si X es función de estado se cumple X = f (a, b, c....) ∂X ∂X dX = da + db + ...... ∂a b ,c... ∂b a ,c... Altura = función de estado distancia recorrida no F Variación de la función de estado ∆F F = función de estado Ecuaciones de estado: Relacionan funciones de estado. Se determinan experimentalmente ej: PV = nRT o V=αT+βT2+….- δP+εP4… Ecuación de estado del gas ideal Cuando se especifica la temperatura y la presión de un mol de gas ideal, el volumen sólo puede adquirir un valor, dado por la ecuación de estado Trayectoria = Camino que sigue el sistema cuando su estado , las funciones de estado, cambia con el tiempo Esto constituye un PROCESO termodinámico Tipos de procesos • Isotermo • Isobaro • Isocoro •Isopleto • Adiabático • Cíclico Reversible (T = cte) (P = cte) (V = cte) (C = cte) (Q = 0) (estado final = estado inicial) (sistema siempre infinitesimalmente próximo al equilibrio; un cambio infinitesimal en las condiciones puede invertir el proceso) Irreversible (un cambio infinitesimal en las condiciones no produce un cambio de sentido en la transformación). EQUILIBRIO La termodinámica estudia sistemas en equilibrio no se observan variaciones macroscópicas con el tiempo Equilibrio térmico Temperatura constante en todos los puntos del sistema Equilibrio mecánico Todas las fuerzas están equilibradas Equilibrio material No hay cambios globales en la composición del sistema, ni transferencia de materia VIDA DESARROLLO ECONÓMICO ENERGÍA REACCIONES QUÍMICAS TRABAJO NATURALEZA MATERIA E.CINÉTICA E.POTENCIAL TERMODINÁMICA TERMOQUÍMICA CALOR Energía interna, U: Energía total (cinética y potencial) del sistema. •Energía cinética traslacional. •Rotación molecular. •Energía vibracional. •Atracciones intermoleculares. •Enlaces químicos. •Electrones. MATERIA ENERGÍA INTERNA: U E.CINÉTICAS + E. POTENCIALES COMPONENTES Movimientos moleculares No se conoce el valor numérico absoluto Variación de Energía Interna: (cambio físico o químico) Cambio de energía que acompaña a un cambio en el sistema. Interacciones molec. Rotaciones Vibraciones molec. E.Núcleo y electrones de cada átomo ∆U ∆U = Ufinal − Uinicial El sistema ganó E. de Ufinal ⟩Uinicial ⇒ ∆U(+ ) su entorno. Ufinal ⟨Uinicial ⇒ ∆U(− ) El sistema perdió E. a su entorno TRANSFERENCIA DE ENERGÍA Hay dos formas grales: TRABAJO: w CALOR:q Energía que se usa para hacer que un objeto se mueva contra una fuerza. Es la energía que se transfiere de un objeto más caliente a uno más frío. ENERGÍA “Es la capacidad para realizar trabajo o transferir calor” ANALOGÍA El banco posee un fondo económico en forma de lingotes de oro; que no sabemos de cuántos es y que respalda todos sus movimientos. Del banco salen y/o entran fondos en forma de monedas o de billetes ∆fondos = $monedas + $billetes Entonces: si al banco le ingresan $200 en monedas y el banco presta $ 350 en billetes: ∆fondos = 200 – 350 = -150 Se produce una disminución de capital Otro día ingresan al banco $500 en billetes y $100 en monedas: ∆fondos = 500 +100 = 600 Ese día ha tenido un aumento de fondos. UNIVERSO ENTORNO Calor: q (+) Calor: q (-) SISTEMA: S Trabajo: w (+) Trabajo: w (-) PRIMER PRINCIPIO DE LA TERMODINÁMICA “La energía no se crea ni se destruye; se Conserva”. “La energía se puede convertir de una forma a otra, y se puede tranferir de una parte del Universo a otra; pero se mantiene constante” ∆U = q + w El primer principio de la termodinámica •Un sistema sólo tiene energía interna: –Un sistema no contiene calor o trabajo. –Estos sólo existen durante un cambio del sistema. •Ley de la conservación de energía: –La energía de un sistema aislado permanece constante. ∆U = q + w –Para cambios infinitesimales en la energía interna: – dU=dq+dw Convenciones de signos y la relación entre q, w y ∆U Convención de signos para q: •q>0 (+q): Se transfiere calor del entorno al sistema. Proceso ENDOTÉRMICO •q<0 (-q): Se transfiere calor del sistema al entorno. Proceso EXOTÉRMICO Convención de signos para w: •w>0 (+w): El entorno efectúa trabajo sobre el sistema •w<0 (-w): El sistema efectúa trabajo sobre el entorno. Entorno Sistema Signos de ∆U = q + w •q>0 y w >0 ⇒ ∆U > 0 •q>0 y w<0 ⇒ el signo de ∆U depende de las magnitudes de qyw •q<0 y w >0 ⇒ el signo de ∆U depende de las magnitudes de q y w •q<0 y w<0 ⇒∆U <0 Entorno Entorno q Sistema q q Sistema (Gas) ∆U<0 ∆U>0 w ∆T<0 ∆T>0 w ∆U=0 q=w; ∆U=0 Proceso isotérmico w Calcule ∆U y determine si el proceso es endotérmico o exotérmico en el siguiente caso: “Un sistema libera 113 kJ de calor al entorno y efectúa 39 kJ de trabajo sobre el entorno”. ∆U = q + w El sistema “libera” calor (sale E del sistema en forma de calor) ⇒ −q ⇒ −113kJ ⇒ El proceso es EXOTÉRMICO El sistema “efectúa” trabajo (sale del sistema E en forma de trabajo) ⇒ − w ⇒ −39kJ Reemplazando en la expresión del primer principio: ∆U = −113 + ( −39) ∆U = −113 − 39 = −152kJ El sistema perdió energía a su entorno. FUNCIÓN DE ESTADO Y FUNCIÓN DE LINEA O TRAYECTORIA U1 = u2 La Energía Interna es una función de estado q1 ≠ q2 El calor puesto en juego en cada proceso, tanto en magnitud como en dirección. FUNCIÓN DE ESTADO: SU VALOR NO DEPENDE DE LA HISTORIA ESPECÍFICA DE LA MUESTRA, SÓLO DE SU CONDICIÓN ACTUAL. ES DECIR, DEL ESTADO INICIAL Y DEL ESTADO FINAL. Ej: U; T; V FUNCIÓN DE LINEA: SU VALOR SÍ DEPENDE DE LA HISTORIA DE LA MUESTRA, ES DECIR, CUANDO SE PRODUCE UN CAMBIO DE ESTADO, LOS VALORES DE LA FUNCIÓN SERÁ DISTINTO SEGÚN LA FORMA EN QUE SE EFECTUÓ EL CAMBIO. Ej: calor y trabajo TRABAJO Energía = Capacidad para realizar un trabajo Se realiza un trabajo cuando se realiza un movimiento en contra de una fuerza que se opone a ese movimiento Es imposible realizar un trabajo sin consumir una energía TRABAJO uff, uff . Para un cambio infinitesimal: dx dw= Fdx Distancia que se desplaza el objeto Para obtener el trabajo total: W =∫ Fuerza W=F x d ELTRABAJO NO ES UNA FUNCIÓN DE ESTADO Trabajo realizado por el hombre X2 X1 Fdx [N.m=J] Fuerza aplicada X1 distancia X2 Trabajo=área Trabajo presión-volumen w=Fxd = (P x A) x h = P∆V w = -Pext∆V Para un cambio infinitesimal: dV dw = -Pext dV Trabajo de Expansión – Compresión contra una presión constante dw = -Pext dV Para obtener el trabajo total Vi w = − ∫ Pext dV Vf Vi w = −Pext ∫ dV Vf w = −Pext (Vf − Vi ) Diagrama Indicador: Trabajo de Expansión – Compresión REVERSIBLE Pext Pext Pint Pint Pext < Pint Pext = Pint dw = −Pext dV = −Pgas dV Vi w = − ∫ Pgas dV Vf Para evaluar la integral hay que conocer cómo la presión del gas confinado depende de su volumen Trabajo de Expansión – Compresión REVERSIBLE Vi Diagrama Indicador: w = − ∫ PgasdV Vf Suponiendo comportamiento ideal: nRT P.V = nRT ⇒ P = V Vi 1 nRT w = −∫ dV ⇒ w = −nRT ∫ dV V V V f Vf Vi Vf ⇒ w = −nRT ln Vi “Trabajo Máximo” TRABAJO PROCESOS QUÍMICOS ABSORCIÓN O LIBERACIÓN DE CALOR ELÉCTRICO (ELECTROQUÍMICA) TRABAJO PRESIÓN – VOLUMEN (cdo. se produce o consume un gas a P constante) KClO3(s) → KCl(s) + O2(g) w = −Pext ⋅ ( Vfinal − Vinicial ) w = −Pext ⋅ ∆V Trabajo de EXPANSIÓN:V final > Vinicial ⇒ ∆V (+) y ⇒ w(−) Trabajo de COMPRESIÓN: V final < Vinicial ⇒ ∆V ( −) y ⇒ w(+ ) El sistema hace trabajo sobre el entorno. El sistema recibe trabajo del entorno. CALOR “Cuando la energía de un sistema cambia como resultado de una diferencia de temperatura entre el sistema y entorno se considera que la energía ha sido transferida como calor” Proceso Exotérmico Proceso Endotérmico Función de Línea o Trayectoria CALOR A VOLUMEN CONSTANTE De a cuerdo al primer principio de la Termodinámica: qv dU=dq+dw En un sistema donde el volumen se mantiene constante: dV = 0 ⇒ dw=0 Bajo estas circunstancias: dU=dq ⇒dU=dqV Para un cambio mensurable: ∆U = qV “La medida de la energía proporcionada a un sistema a volumen constante como calor u obtenida a partir de él como calor, cuando el sistema sufre un cambio de estado es, de hecho, la medida del cambio es su energía interna.” CALOR A VOLUMEN CONSTANTE qα∆T q = cons tan te.∆T Capacidad Calorífica qV = C V,m .∆T C V,m = Capacidad calorífica molar a volumen constante -Propiedad extensiva para cada sustancia -Unidades: J/K.mol -Ej para el H2O: 72 J/Kmol ∆U = qV ∆U = C V ∆T Bomba calorimétrica CALOR A PRESIÓN CONSTANTE Pext constante ENTALPÍA H = U + PV Cuando se efectúa un cambio a presión constante: ∆H = ∆(E + PV ) ∆H = ∆E + P ⋅ ∆V qP + w −w ∆H = qP + w − w ⇒ ∆H = qP CALOR A PRESIÓN CONSTANTE La medición de los cambios de entalpía: qα∆T q = cons tan te.∆T Capacidad Calorífica qP = CP,m .∆T CP,m = Capacidad calorífica molar a presión constante ∆H = qP ∆H = CP ∆T RELACIÓN ENTRE CP Y CV CP − C V = nR CP,m − C V ,m = R R= constante universal de los gases R= 0,082 L.atm/K.mol = 8,314 J/K.mol = 2 cal/K.mol CAMBIOS ADIABÁTICOS •Los límites del sistema son paredes adiabáticas •No hay flujo de calor en ningún sentido: q=0 •En un sistema adiabático, la energía interna sólo puede cambiar por transferencia de trabajo con el entorno. ∆U = w 5 atm 1 atm Pared Adiabática Donde TA < TB TA Estado A Vi Tf = Ti . Vf 1 c 9L TB Estado B ∆U = C V ∆T C V,m donde c = R 3L