¿es posible detectar con antelación el agente causal
Anuncio

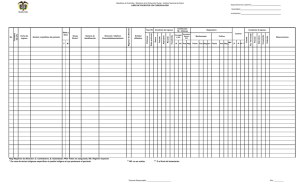
74 Fitosanidad Análisis microbiológico y molecular del "lloro primaveral" del kiwi: ¿ES POSIBLE DETECTAR CON ANTELACIÓN EL AGENTE CAUSAL DEL CANCRO BACTERIANO? En este artículo los autores señalan la necesidad de desarrollar un modelo de prevención de PSA que reduzca la diseminación del cancro bacteriano. Así mismo explica un modelo de detección desarrollado en Italia y experimentado en Chile que se basa en el muestreo y análisis del “lloro primaveral” del kiwi, es decir, del flujo xilemático que se libera por los cortes de poda de las plantas. Stefano Ardizzi*, Enrico Biondi*, Set Pérez*, Carla Lucchese*, Assunta Bertaccini*, Alan Zamorano**, Ximena González**, Jimena Carrasco Figueroa***, Carolina Ureta Olivares***, Carolina Soto Pereira***, Catalina Cerpa***, Juan Alejandro Molina***, Ernesto Vega Berroeta***, Nicola Fiore**. *DipSA, Patología vegetal, Alma Mater Studiorum, Universidad de Bolonia, Italia **Departamento de Sanidad Vegetal, Facultad de Ciencias Agronómicas, Universidad de Chile, Chile *** Servicio Agrícola y Ganadero, Chile E l cancro bacteriano del kiwi, causado por la bacteria Pseudomonas syringae pv. actinidiae (Psa), desde el año 2008 es responsable de importantes epidemias en Europa y en Nueva Zelanda. En Chile, particularmente en la región del Maule, Psa fue detectado en el año 2010 y al 2013 ya se confirmaba su presencia también en las Regiones del Bio Bio y Libertador Bernardo O´Higgins. Los principales síntomas en kiwi atribuibles al patógeno son: manchas foliares necróticas con forma poligonal y usualmente con halo clorótico, exudados rojos en primavera y, ante el empeoramiento de la enfermedad, cancros en las ramas, marchitamientos de flores y hojas (Figuras 1, 2 y 3). La diseminación de Psa ocurre a través de: utensilios y ropa; incorrecta eliminación de material (vegetal y no) contaminado, infectado o sucio; polen; lluvia y viento. Sin embargo, la causa más importante es el movimiento de material viverístico asintomático con fines comerciales. Para reducir la diseminación del cancro bacteriano del kiwi es importante identificar y eliminar tempranamente las nuevas fuentes de inóculo. A tal propósito, es necesario desarrollar un modelo de prevención, apoyado por un protocolo de detección confiable y rápido en la identificación de las nuevas fuentes de inoculo asintomáticas, antes del término del reposo vegetativo de la actinidia. Con esta finalidad, recientemente en Italia se ha trabajado en una metodología diagnóstica basada en la recolección y análisis del fluido xilemático, llamado también “lloro primaveral”. Este fenómeno natural y común en algunas especies vegetales, se debe al aumento de la presión osmótica a nivel del aparato radical, en concomitancia con el gradual aumento de temperatura, condición que se traduce en abundan- Julio 2015 te flujo de linfa por los vasos xilemáticos que posteriormente es liberado a través de cortes de poda (Davison, 1990; Clearwater y col., 2007; Biondi y col., 2013; Biondi y col., 2014). Entre las especies cultivadas, el lloro es muy abundante en actinidia y en la vid, a causa de las grandes dimensiones de los vasos xilemáticos, los que ofrecen poca resistencia hidráulica y permiten el fácil tránsito de la linfa. En la vid, el análisis microbiológico del fluido xilemático ha sido utilizado con fines diagnósticos para detectar la presencia de Agrobacterium vitis en plantas asintomáticas (Szegedi y Bottka, 2002; Flamini y col., 2006). El método utilizado en este estudio, se basa en el análisis microbiológico y molecular del lloro primaveral de la actinidia, para detectar la presencia de infecciones latentes causadas por Psa en perjuicio de plantas adultas cultivadas en pleno campo (Biondi y col., 2013). Este método, ya desarrollado en Italia (Biondi y col., 2014), ha sido experimentado también en Chile, en territorios afectados por Psa en las regiones del Maule y Bíobío, a través de un trabajo realizado en conjunto entre la Universidad de Chile, el Servicio Agrícola y Ganadero (SAG) y la Universidad de Bologna (Italia). SE SELECCIONARON PLANTAS HAYWARD ASINTOMÁTICAS DE PREDIOS POSITIVOS Las plantas analizadas, provenientes de los distintos predios, pertenecían al cultivar Hayward; para la recolección de muestras, fueron seleccionados predios positivos a Psa. Se eligieron solo plantas asintomáticas, conservando como único criterio el de analizar un número de muestras representativo del área de investigación. Fue realizado un muestreo de lloro de cada predio, en primavera (inicios de octubre 2013). Desde cada planta asintomática, después de haber esterilizado la superficie con etanol al 70%, fueron cortadas las porciones distales (2 - 3 cm) de tres sarmientos de un año. Una probeta Falcón de 15 mL fue fijada en cada punto de corte para colectar el lloro (tres probetas Falcón por cada planta) (Figuras 4 y 5). Alrededor de 1 hora después - el tiempo de recolección puede llegar también incluso a 2 horas (Biondi y col., 2014) - las probetas fueron retiradas y conservadas en un contenedor refrigerado portátil (15°C). Una vez en laboratorio, el líquido contenido en las tres probetas Falcón de 15 mL, fue agitado en vórtex por algunos segundos y posteriormente vertido en una única probeta con capacidad total de 50 mL. El total del contenido fue centrifugado a 10.000 g por 20 minutos a 4°C. El sobrenadante fue eliminado y el pellet resuspendido en 1 mL de agua destilada estéril. Una alícuota del precipitado resuspendido fue conservada a -80°C incor- porando 20% de glicerol, mientras que la otra alícuota fue mantenida a -20°C para realizar análisis microbiológico y PCR anidada (Biondi y col., 2013). La detección e identificación microbiológica de Psa, ha sido realizada a través de aislamientos en substrato nutritivo (NSA), y purificación en medio King B, de manera de establecer las características morfológicas de las colonias, evaluación de fluorescencia, pruebas bioquímicas (LOPAT: producción de LEVANA, citocromo OXIDASA, pudrición de PAPA, dihidrolasa de la ARGININA e hipersensibilidad en TABACO). Las pruebas moleculares han sido efectuadas desde los lloros y en las colonias purificadas obtenidas a través del análisis microbiológico (PCR anidada; Biondi y col., 2013). Tabla 1. En la tabla se indica fecha, zona y relativos volúmenes de los lloros de plantas de actinidia muestreados. FECHA Y ZONA DE MUESTREO 03 octubre 2013 "Curicó” región del Maule 11 octubre 2013 "Chillán – San Carlos” región del Bíobío Predio 1 11 octubre 2013 "Chillán – San Carlos” región del Bíobío Predio 2 Nº MUESTRA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 VOLUMEN DE LLORO OBTENIDO POR MUESTREO (ML) 10,5 11 29,5 8 1 29,8 9,5 31 32,5 2 0 24 38,5 2 0 35,5 3,5 30 35,5 6,5 32 17 39 25 6 4,5 42,5 Fitosanidad 1 En el transcurso de la estación vegetativa, luego del análisis de los lloros, se efectuaron observaciones fitopatométricas en las plantas usadas en cada muestreo; con este fin, se recogieron sarmientos sintomáticos (en las plantas donde empezaban a aparecer los síntomas) y asintomáticos, los cuales fueron analizados en laboratorio. Pequeñas porciones subcorticales de sarmiento fueron esterilizadas por inmersión en hipoclorito de sodio (1%) y, luego de haberlas enjuagado con agua destilada estéril, inmediatamente puestas en bolsa de Stomacher. Las muestras fueron sumergidas en aproximadamente 25 mL de tampón fosfato sódico (AFT) y mantenidas en agitación lenta por 20 minutos. Desde el extracto obtenido, 1 mL fue retirado y conservado a temperatura de -20°C, incorporando previamente 20% de gli- 2 cerol. El protocolo descrito por Biondi y col. (2013) ha sido usado para la detección y la identificación del patógeno. VOLÚMENES RECOLECTADOS Y PORCENTAJES POR TIPO DE ANÁLISIS Los volúmenes de lloro total, se indican en Tabla 1. En el predio de la región del Maule, el volumen promedio de lloro recolectado fue alrededor de 14 mL, muy cercano al obtenido en muestreos realizados en el predio 1 en la región del Bíobío (aprox. 17 mL). En el predio 2, de la región del Bíobío, el volumen promedio de lloro recolectado fue mayor a 23 mL. El porcentaje de lloro obtenido en cada predio y utilizable para un análisis, hasta un mínimo de 1 mL - fue del 100% en el predio de la región del Maule y en el predio 2 de la del Bíobío; en el predio 1 de la región del Bíobío el porcentaje fue del 80%. 75 3 El 57% de los lloros recolectados en el predio de la región del Maule resultó positivo al análisis PCR anidada, mientras que aquellos obtenidos desde los predios 1 y 2 de la región del Bíobío, el porcentaje de muestras positivas fue respectivamente 87% y 77%. El aislamiento y la identificación microbiológica de Psa desde lloro fueron posibles en el 14% de las muestras provenientes del predio de la región del Maule, mientras que en aquellas provenientes de los dos predios de la región del Bíobío, resultaron positivos el 25% y 20% de los casos. En los predios 1 y 2 de la región del Bíobío, las observaciones fitopatométricas realizadas en las mismas plantas utilizadas para los análisis del lloro, evidenciaron la presencia de síntomas de Psa en el 0% y 30% de los casos, respectivamente. El aislamiento e identificación del patógeno desde los sarmientos sintomáticos y asintomáticos, provenientes desde los predios 1 y 2 de la región del Bíobío, fueron posibles en el 20% y 50% de las muestras respectivamente. En el predio de la región del Maule no se realizaron las observaciones fitopatométricas y tampoco se colectó material vegetal. EN CHILE AÚN FALTA ESTABLECER CON EXACTITUD EL MEJOR PERIODO DE MUESTREO En los tres predios en los que fue realizado el muestreo, más del 90% de las plantas de kiwi proporcionó volúmenes de lloro adecuados para completar los análisis microbiológicos y moleculares; solo en dos casos hubo ausencia 76 Fitosanidad 4 de lloro. En tres casos se obtuvieron muestras de volumen exiguo (1 - 2 mL; Tabla 1), aunque suficiente para completar los análisis. En particular, el predio 1 de la región del Bíobío, no obstante los volúmenes promedio recogidos en los tres predios hayan sido significativamente similares entre sí, la recolección no fue homogénea y los volúmenes fueron muy variables; de hecho, en este predio dos plantas (11 y 15) no produjeron lloro, y en dos casos el volumen recogido fue de 2 mL. Esta variabilidad se puede atribuir a daños cuantiosos del sistema de conducción xilemático causados por la presencia de Psa (especialmente en el caso de las muestras 11 y 15, positivas a la bacteria según resultados obtenidos en material vegetal) o a probables daños en las raíces debidos a la acción de otros agentes bióticos y/o abióticos. En Italia ha sido posible identificar un período ideal de recolección de lloro, correspondiente a aproximadamente un mes, durante el cual se obtienen volúmenes abundantes y con alta carga bacteriana (Biondi y col., 2014). En Chile, si bien se han generados más informaciones durante la temporada 2014, aún falta investigar para establecer con exactitud el mejor periodo de muestreo de lloro en relación a variables como nivel de precipitaciones, humedad relativa, especie, cultivar y volúmenes de riego de cada zona agroclimática interesada por el muestreo. El porcentaje de muestras positivas al análisis de PCR anidada, realizado directamente en el extracto crudo de lloro, fue mayor respecto del obtenido en los análisis microbiológicos (aislamientos), al igual de lo observado utilizando como base para los análisis en el material vegetal. Los análisis microbiológicos y moleculares realizados en Chile evidenciaron la misma discrepancia de resultados notada también en los experimentos llevados a cabo en Italia. Las dificultades 4 DÍAS / 3 Tabla 2. Resultados de los análisis moleculares y microbiológicos en lloro y material vegetal. Las muestras están numeradas y divididas en la tabla por cada región de recolección. PCR ANIDADA DIRECTA EN LLORO Neg. Pos. Pos. Neg. Pos. Pos. Neg. Neg. Pos. Pos. / Pos. Pos. Pos. / Pos. Pos. Pos. Pos. Pos. Pos. Pos. Pos. Pos. Neg. Neg. Neg. Nº MUESTRA 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 AISLAMIENTOS DESDE LLORO Neg. Neg. Neg. Neg. Neg. Neg. Pos. Neg. Pos. Pos. / Neg. Neg. Neg. / Neg. Neg. Neg. Pos. Neg. Neg. Pos. Neg. Neg. Neg. Neg. Neg. AISLAMIENTOS DESDE SARMIENTOS n/m n/m n/m n/m n/m n/m n/m Neg. Neg. Neg. Pos. Neg. Neg. Neg. Pos. Neg. Neg. Pos. Neg. Pos. Pos. Pos. Neg. Pos. Neg. Neg. Neg. n/m: no muestreado; /: ausencia de lloro; Pos.: positivo; Neg.: negativo encontradas en el aislamiento de Psa, han sido sindicadas muy a menudo a la presencia de otras especies endófitas o EVENTOS DE VANGUARDIA epifita, más numerosas y veloces en el crecimiento, y que han inhibido a Psa, o bien han hecho imposible el reconoci- 14 AL 17 DE JULIO DE 2015 SAN LUIS POTOSI, SLP, MÉXICO GIRA A LA Innovación en INVERNADERO 14 AL 16 DE JULIO DE 2015 14 DE JULIO: Cóctel de Bienvenida 15 Y 16 DE JULIO: Conferencias y Exposición Comercial • Relaciónate con más de 900 colegas de la industria • Actualízate en 12 sesiones educativas de expertos ponentes • Observa las últimas novedades de más de 80 expositores AN IVERSAR IO Celebrando 10 años al servicio de la industria de producción y comercialización del tomate. 17 DE JULIO DE 2015 17 DE JULIO DE 2015 • Capacitación intensiva con 4 talleres exclusivos y una conferencia magistral • Producción y comercialización de cultivos protegidos de alto valor • Almuerzo de trabajo con colegas, proveedores e instructores • Un dia completo dedicado a visitar exitosas operaciones de invernadero • Desayuno y almuerzo incluidos • Viaje redondo del hotel sede a los invernaderos Organizado por Patrocinado por UASLP REGÍSTRESE AHORA! Julio 2015 www.congresodeltomate.com | tomate@meistermedia.com | Tel: (477) 790-2062 Fitosanidad Para la detección de Psa, la prueba molecular PCR anidada resultó ser más sensible que el aislamiento en medio de cultivo. Trabajos anteriores (Biondi y col., 2013), dejan también en conocimiento que el análisis molecular del lloro primaveral de actinidia, es eficaz también si se utilizan otros protocolos moleculares (Gallelli y col., 2011; ReesGeorge y col., 2010). 5 miento de las colonias. En Italia, el periodo óptimo de muestreo del lloro se ha obtenido no sólo en base a la numerosidad y el volumen de lloro promedio recolectado, sino que también en base a la mayor facilidad de aislamiento de Psa (Biondi y col., 2014). Como se ha indicado anteriormente, en Chile aún no se establece con exactitud el periodo óptimo de muestreo de lloro. Pero, a través de este trabajo, a pesar del limitado número de muestras, aparecen importantes indicaciones. En específico, desde los lloros obtenidos en la última recolección (11/10/2013), fue posible aislar el patógeno en un porcentaje del 6% al 11% superior respecto a lo obtenido en las muestras recogidas una semana antes. Es necesario también no olvidar que en el caso de análisis de plantas asintomáticas, debido a la insuficiente información científica disponible actualmente, es preferible utilizar la prueba molecular solo para complementar y confirmar la detección realizada a través del aislamiento del patógeno en medio de cultivo. El estudio de nuevos sustratos semiselectivos más específicos, podría ayudar a mejorar la eficiencia en el aislamiento de Psa; pese a que en este trabajo se ha usado sólo el substrato NSA para los aislamientos, se sabe por trabajos anteriores, que utilizando NSA con incorporación de ácido bórico, cefalexina y cycloheximide (Gallelli y col., 2011) para limitar el crecimiento de especies contaminantes, ha sido posible aumentar la eficacia del aislamiento, aunque en pequeña medida (Biondi y col., 2014). Por otro lado, de todas las plantas cuyo lloro haya resultado negativo con PCR anidada, solo en una muestra (la 7) ha sido posible aislar la bacteria en medio de cultivo. Estos resultados indican que el análisis de lloro es un método suficientemente confiable para ser utilizado en el monitoreo del territorio, permitiendo señalar como libre de enfermedad aquellos cuarteles en los cuales todas las plantas analizadas a través de muestras de lloro hayan resultado negativas a Psa por el método molecular. EL MÉTODO PROPUESTO DEMOSTRÓ SER EFICAZ Y CONFIABLE El método de análisis propuesto demostró ser eficaz y confiable para detectar la presencia de Psa también en plantas asintomáticas, por eso es que se propone como instrumento para identificar precozmente nuevas fuentes de inoculo. Permite, además simplificar el monitoreo de Psa en el territorio, con evidente disminución de los costos. El análisis del lloro en primavera, unido a otras tipologías de intervención, como el control biológico y químico, la elección de cultivares menos susceptibles, y otros medios agronómicos, contribuiría a disminuir la diseminación de la bacteria, no solo en los cuarteles en producción, sino que sobre todo si se aplicara en vivero para la selección sanitaria de las plantas destinadas a la propagación vegetativa. 77 BIBLIOGRAFÍA Biondi E., Galeone A., Kuzmanovic N., Ardizzi S., Lucchese C. & Bertaccini A. (2013) Pseudomonas syringae pv. actinidiae detection in kiwifruit plant tissue and bleeding sap. Annals of Applied Biology, 162 (1), 60-70. Biondi E., Sitta D., de Salvador R., Ardizzi S., Perez Fuentealba S., Lucchese C., Bertaccini A. (2014). Kiwi: rilevare il cancro batterico in modo veloce ed efficace. L’Informatore agrario, 4: 67-69. Clearwater M.J., Blattmann P., Luo Z., Lowe R.G. (2007) Control of scion vigour by kiwifruit rootstocks is correlated with spring root pressure phenology. Journal of Experimental Botany, 58 (7), 1741–1751. Davison R.M. (1990) The physiology of the kiwifruit vine. En Kiwifruit: Science and Management, pp. 127–154. Eds I.J. Warrington and G.C. Weston. Auckland, New Zealand: NZ Society for Horticultural Science and Ray Richards Publisher. Flamini L., Rossini E., Tonti S., Biondi E., Sandalo S., Bini F., Nipoti P., Bazzi C. (2006) Detection of endophytic microorganisms within rootstock mother vines grown in the Marche. Journal of Plant Pathology, 88(Suppl. 3), S31–S63. Gallelli A., L'Aurora A., Loreti S. (2011) Gene sequence analysis for the molecular detection of Pseudomonas syringae pv. actinidiae: developing diagnostic protocols. Journal of Plant Pathology, 93, 425–435. Rees-George J., Vanneste J., Cornish D.A., Pushparajah I.P.S., Yu J., Templeton M.D., Everett K.R. (2010) Detection of Pseudomonas syringae pv. actinidiae using polymerase chain reaction (PCR) primers based on the 16S-23S r DNA intertranscribed spacer región and comparison with PCR primers based on other gene regions. Plant Pathology, 59, 453–464. Szegedi E., Bottka S. (2002) Detection of Agrobacterium vitis by polymerase chain reaction in grapevine bleeding sap after isolation on a semiselective medium. Vitis, 41, 37–42.