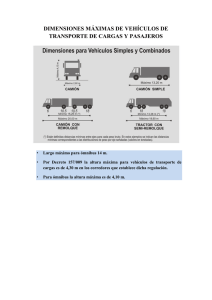
MATERIALES Y METODOS Cepa de Mycobacterium tuberculosis
Anuncio

MATERIALES Y METODOS Cepa de Mycobacterium tuberculosis Se utilizó una cepa de referencia de Mycobacterium tuberculosis H37Rv tipificada en el Instituto Nacional de Diagnóstico y Referencia Epidemiológica (INDRE), y proporcionada para este trabajo por el Laboratorio Estatal de Salud Pública (LESP) de Hermosillo, Sonora. Cultivo de Mycobacterium tuberculosis H37Rv Los procedimientos que involucraron la manipulación de cepas fueron llevados a cabo en el Departamento de Micobacterias del LESP, utilizando una campana de bioseguridad tipo 2. La reactivación de la cepa, se realizó en tubos para cultivo con el medio de Löwenstein-Jensen en plano inclinado; la cepa fue sembrada en el medio e incubada a 37°C hasta observar el desarrollo del microorganismo. La pureza del cultivo se verificó mediante pruebas bioquímicas para micobacterias y tinción de Ziehl-Neelsen. Una vez verificada la pureza del cultivo, se procedió a la inoculación en sistemas de cultivo conteniendo 400 mL del medio líquido Sauton. Los medios fueron incubados a 37°C en reposo durante 4 semanas. Filtrado de Cultivo Para la obtención del filtrado proteico con la mayor representatividad de componentes proteicos, se utilizó un sistema de filtración acoplado a una bomba de vacío, utilizando una membrana de nylon con punto de corte de 0.2 µm (Millipore). Los filtrados fueron sometidos a un proceso de concentración utilizando centricones con membranas de nitrocelulosa de 10,000 Da de punto de corte, en una centrífuga refrigerada a 4ºC y 2,500 rpm (Sigma Chemical Co, St Louis Mo, USA). Después de la concentración se dializó el filtrado exhaustivamente contra agua tridestilada. Por último, 21 las fracciones proteicas fueron liofilizadas (Labconco Corporation, Kansas City, Mo, USA) y se almacenaron en refrigeración a 4ºC hasta su procesamiento. Estimación Proteica del Filtrado de Cultivo La concentración proteica del filtrado de cultivo fue estimada por el método de Bradford (Bradford, 1976) en microplaca, utilizando albúmina de suero bovino (BSA, por sus siglas en inglés) como proteína estándar para la curva de calibración. El rango de concentración de la curva fue de 3.125 µg/mL a 100 µg/mL. Identificación de Perfil Electroforético en una Dimensión del Filtrado de Cultivo La masa de los componentes proteicos del filtrado de cultivo de Mycobacterium tuberculosis, se estimó por medio de electroforesis en condiciones desnaturalizantes y reductoras (Laemmli, 1970) en geles de poliacrilamida en gradiente al 15%, en una cámara vertical, a 80 volts constantes. Se cargaron 10 µg de proteína por pozo en el gel de poliacrilamida y el gel fue teñido con AgNO3 (Blum y col., 1987). Estandarización de Métodos Inmunoquímicos Para la Identificación de Antígenos con Proteínas del Filtrado de de Cultivo Electrotransferencia e Inmunodetección (Western blot) Una vez realizada la electroforesis en geles de poliacrilamida de proteínas de filtrado de cultivo se llevó a cabo la estandarización de la electrotransferencia en cámara semi-húmeda (Towbin, 1979) a hojas de papel de nitrocelulosa (Bio-Rad, Richmond, CA). Se ensayaron dos diferentes tiempos de electrotransferencia, de 1 hora y 1 hora con 10 minutos a 120 mA y 20 V constantes. Posteriormente, la estandarización de la inmunodetección se realizó, seguida de dos esquemas de bloqueo en solución amortiguadora de fosfato de potasio 20 mM, pH 7.2 (PB) con Tween 20 (PBT) al 0.02% (Towbin, 1979), en el primero con 5% de leche descremada en solución PBT y en el 22 segundo esquema con leche al 5% y BSA al 0.5% en solución PBT, ambos con incubación de 14-16 horas a 4ºC. Para la estandarización del proceso de identificación de antígenos inmunodominantes se utilizó el suero de una persona sin tuberculosis con reacción positiva al PPD y un suero de una persona con tuberculosis activa. El antisuero secundario anti-human IgG (Fc specific) (Sigma Chemical Co, St Louis Mo, USA) utilizado en este proceso, estaba conjugado con peroxidasa. La reacción fue revelada por quimioluminiscencia (PIERCE Super Signal West Pico Chemiluminiscent Substrate). Se ensayaron dos esquemas; en el primero, el bloqueo a 4º C sin agitación durante 12 horas, con BSA al 0.5% y leche descremada al 5% en PBT; el antisuero primario fue incubado a temperatura ambiente durante 2 horas en agitación (en dilución 1:50, 1:100, 1:200 y 1:400), y el antisuero secundario (en dilución 1:2000, 1:4000, 1:6000 y 1:8000) durante 2 horas a temperatura ambiente en agitación. En el segundo esquema, el bloqueo se realizó con leche descremada al 5% en solución PBT; el antisuero primario fue incubado a temperatura ambiente durante 2 horas en agitación (en dilución 1:50, 1:100, 1:200 y 1:400), y el antisuero secundario (en dilución 1:2000, 1:4000, 1:6000 y 1:8000) durante 2 horas a temperatura ambiente en agitación. En ambos esquemas la membrana de nitrocelulosa fue lavada 8 veces durante 5 minutos con PBT, los lavados se realizaron después de cada incubación. Ensayo de Manchas (Dot blot) Para la estandarización del ensayo de manchas (Towbin, 1989), se realizó la inmovilización directa del antígeno sobre la membrana de nitrocelulosa, colocando tres concentraciones diferentes: 0.7, 0.35 y 0.175 µg/µl del filtrado de cultivo de Mycobacterium tuberculosis H37Rv, en PB 20 mM, pH 7.2, luego se realizó el bloqueo de la membrana con leche descremada al 5% por 14-16 horas en PBT, se realizaron 5 lavados con PBT por 5 minutos después de cada incubación; el antisuero primario fue incubado a temperatura ambiente (en dilución 1:20 y 1:50) por 1 hora; la interacción 23 entre las proteínas y los anticuerpos del suero fue revelada incubando la membrana con un antisuero secundario (anti-human IgG, Sigma, St. Louis MO) conjugado con peroxidasa (en dilución 1:1000 y 1:2000) por 1 hora, a temperatura ambiente. La reacción fue revelada con diaminobencidina (DAB) y peróxido de hidrógeno como sustrato (Sigma Chemical Co, St Louis Mo, USA). 24