Actualización de las interacciones medicamentosas con
Anuncio

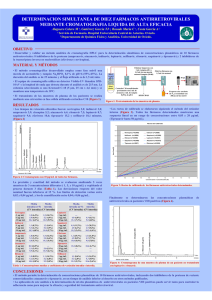
[ 5 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] Actualización de las interacciones medicamentosas con antirretrovirales Dra. Inmaculada Jiménez-Nácher Farmacéutica adjunta Servicio Farmacia Hospital Carlos III Madrid 35 [ 5 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] INTRODUCCIÓN Desde la introducción de la terapia HAART, todo el personal sanitario encargado del cuidado del paciente VIH se ha acostumbrado al reto que supone el manejo de las interacciones medicamentosas en este grupo de pacientes. Si bien el esquema general del tratamiento farmacológico de estos pacientes no se ha modificado, han ido apareciendo nuevos fármacos y se han realizado estudios que revelan interacciones de interés en la práctica clínica. Las interacciones farmacológicas se clasifican en farmacocinéticas, cuando se produce modificación de niveles de los fármacos implicados y farmacodinámicas en las que los niveles de los fármacos implicados permanecen inalterados, pero existe compromiso de la eficacia o seguridad del tratamiento. Generalmente, la mayoría de las interacciones tienen un mecanismo farmacocinético produciéndose de forma frecuente con los inhibidores de proteasa (IP) y con los no análogos de nucleósidos ya que ambos grupos de fármacos son metabolizados por el complejo enzimático CYP3A4. Una interacción que se verá es la del atazanavir con los neutralizantes gástricos cuyo mecanismo se produce a nivel de la absorción. Tiene especial interés los avances que se han realizado con el ritonavir (RTV) a dosis bajas que, como se sabe, tiene un efecto potenciador (“boosting effect”) sobre otros IP y serán objeto de discusión más adelante. En cuanto a los mecanismos farmacodinámicos, se le ha prestado especial interés a las combinaciones de los análogos de nucleósidos que forman la denominada “columna vertebral” (backbone) del tratamiento antirretroviral. Algunas de estas combinaciones tienen problemas de eficacia y/o de toxicidad y serán abordadas en su momento. INTERACCIONES POR DEFICIENCIAS EN LA ABSORCIÓN 36 Dentro de las interacciones farmacocinéticas, los mecanismos de las interacciones de algunos de ellas se explican por fenómenos de déficit de absorción. Como se sabe, el fármaco antes de absorberse, tiene que disgregarse de la forma farmacéutica en la que viene integrado y posteriormente disolverse. Algunos fármacos requieren condiciones especiales para su disolución como es, por ejemplo, la necesidad de pH Actualización de las interacciones medicamentosas con antirretrovirales ácido. Así, cualquier modificación en el mismo por la adición de algún otro fármaco puede dar lugar a que el fármaco se absorba mal y como consecuencia, se produzca un déficit de absorción accediendo menor cantidad de fármaco al torrente circulatorio. El atazanavir (ATV) es un IP que se ha introducido recientemente en nuestro país y que para su disolución, paso previo a su absorción, se requiere un pH ácido. La administración concomitante con fármacos que aumenten este pH va a dar lugar a una disolución defectuosa del principio activo y como consecuencia, se producirán pérdidas de absorción. En un estudio, se observó una disminución del 76% en el AUC y del 78% en la Cmin del atazanavir cuando éste se administraba en regímenes de 300 mg/día (potenciados con ritonavir 100 mg/día) junto con 40 mg de omeprazol1. Ni la administración de bebidas de cola para reducir el pH gástrico, ni el aumento a 400 mg de atazanavir pudo conseguir concentraciones terapéuticas del fármaco (Tabla 1). [TABLA 1] Influencia del omeprazol en la absorción de atazanavir ATV/RTV 300/ ATV/RTV 400/100 mg 100 mg + 40 mg + 40 mg omeprazol omeprazol + bebida (n=14) de cola (n=15) Parámetro ATV/RTV 300/ 100 mg + 40 mg omeprazol (n=15) Cmáx (ng/ml) (% reducción) 0,279 (72%) 0,337 (66%) 0,437 (56%) Cmin (ng/ml) (% reducción) 0,223 (78%) 0,271 (73%) 0,345 (66%) AUC (ng/ml) (% reducción) 0,240 (76%) 0,301 (70%) 0,394 (61%) Esta interacción es importante ya que el 30% de los pacientes VIH+ sufren trastornos gastrointestinales, la disminución de niveles es relevante y puede llevar a fracaso terapéutico y aparición de resistencias, por lo que la administración de omeprazol u otros inhibidores de la bomba de protones (IBP), no se recomienda. Se están realizando estudios con los anti-H2 y es probable que se obtengan pronto resultados. Dado que estos fármacos 37 [ 5 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] tienen períodos más cortos de supresión ácida que los IBP, podrían teóricamente sustituirse siempre que se respeten un intervalo de 12 horas entre ambas administraciones2. La interacción también puede producirse con otros IP. Con el primero que se describió fue con el indinavir, cuyas concentraciones plasmáticas se reducían con omeprazol, efecto que mejoraba de forma modesta cuando se administra ritonavir como potenciador. Con Fosamprenavir se ha descrito una disminución del 30% en el AUC en presencia de anti-H2. INTERACCIONES A NIVEL DE ESQUELETOS “(BACKBONES)” DE ANÁLOGOS DE NÚCLEOSIDOS / NUCLÉOTIDOS INHIBIDORES DE LA TRANSCRIPTASA INVERSA Las combinaciones de dos inhibidores de la transcriptasa inversa análogos de nucleósidos/nucleótidos (ITIAN/Nt) para formar los diferentes esqueletos (“backbones”) de tratamiento antirretroviral han suscitado, recientemente, cierto interés. Algunos “backbones” proporcionan eficacia cuando se combinan con un tercer agente, aunque otras combinaciones proporcionan un resultado subóptimo, bien por una disminución de la potencia, aumento de la toxicidad o selección de mutaciones que confieren resistencia. Una de las interacciones que se produce a este nivel es el aumento de reacciones adversas por utilizar backbones con toxicidades superponibles3. Así, la incidencia de neuropatía periférica varía entre diferentes backbones de ITIAN/Nt, siendo más alta con los regímenes que contienen D4T y, en particular, con la combinación DDI + D4T (Figura 1). 38 Actualización de las interacciones medicamentosas con antirretrovirales [Figura 1] Incidencia de neuropatía periférica con diferentes backbones de ITIAN Un análisis del estudio ACTG 384 encontró que la mediana del tiempo hasta la aparición de toxicidad grave fue de 104 semanas para AZT + 3TC y de sólo 52 semanas para la combinación D4T + DDI4. A la luz de estos datos, este esqueleto de tratamiento no se recomienda por su alta tasa de disfunción mitocondrial y el mayor riesgo de toxicidad. Algo similar se ha mostrado cuando se comparan tenofovir (TDF) con estavudina (D4T), ambos combinados con 3TC + EFV en pacientes naive. En la rama del D4T se observó mayor incidencia de neuritis periférica / neuropatía y lipodistrofia que en la rama del TDF5. Una interacción ampliamente estudiada, y no exenta de complejidad, ha sido la que se produce con el esqueleto DDI + TDF. En un principio, se demostró que el nucleótido aumentaba la absorción de la didanosina en un 46% cuando se tomaba en ayunas y en un 60% cuando se tomaba con alimentos. Por el contrario, el DDI no tenía influencia sobre el TDF. Esta interacción se producía independientemente de que el DDI se administrara en forma de comprimidos tamponados o en forma de cápsulas entéricas. En pacientes > 60 kg, la reducción de la dosis de didanosina es de 400 a 250 mg 39 [ 5 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] día cuando se administra conjuntamente con TDF, proporciona concentraciones de didanosina comparables a las que se obtienen con 400 mg/día en ausencia de TDF6. Además, se ha demostrado que la coadministración de tenofovir sin reducción de dosis de didanosina se asocia a una disminución de los CD4+7. Un análisis retrospectivo de 400 pacientes que recibieron tenofovir y DDI como parte de regímenes ahorradores de IPs mostró que, a pesar de la reducción virológica, los recuentos de CD4 eran más bajos que los basales en pacientes tratados, después de un año de recibir el tratamiento (disminución de 27 células/mm3). Se postula que el mecanismo subyacente de la interacción se basa en que ambos fármacos son análogos de la adenosina, compitiendo sus metabolitos y limitando la reproducción celular. Otros estudios han demostrado que cuando se combina DDI + efavirenz con tenofovir o 3TC se produce mayor tasa de fracaso virológico con la rama de tenofovir (5/29) que con 3TC (0/23) a las 12 semanas. Todos los pacientes que fracasaron tuvieron cargas virales por encima de las 100.000 copias/ml8. Por último, la combinación DDI + TDF se ha asociado a un aumento del riesgo de pancreatitis habiéndose comunicado varios casos en los últimos años9,10. Recientemente, Martínez el al11 revisaron los casos de pancreatitis en pacientes que habían recibido DDI + TDF, DDI solo y TDF solo con objeto de valorar la incidencia de este efecto adverso. Cinco pacientes de 185 que recibieron DDI + TDF, uno de 182 que recibió DDI sin TDF y ninguno de los que recibió TDF sin DDI desarrollaron pancreatitis (Tabla 2). La coadministración de ambos fármacos frente a la administración de cada uno de ellos individualmente, fue un factor de riesgo de pancreatitis (HR=10.6). La incidencia fue superior en pacientes con dosis de 250 mg de DDI, en menores de 60 kg y en mujeres. [TABLA 2] Incidencia de pancreatitis en pacientes con DDI + TDF Régimen 40 Pancreatitis DDI + TDF 5/185 (2,7%) DDI 1/182 (0,5%) TDF 0/208 (0%) Actualización de las interacciones medicamentosas con antirretrovirales Por todos estos problemas, la combinación de didanosina con tenofovir ya no se recomienda. INTERACCIONES DE LOS INHIBIDORES DE PROTEASA Se han descrito interacciones entre el tenofovir y varios inhibidores de proteasa12. Con el atazanavir no se produce una respuesta virológica adecuada en pacientes intensamente pretratados. Se desconoce si es debido a la disminución de concentraciones de atazanavir por tenofovir o a la falta de potencia intrínseca frente a cepas de virus VIH altamente resistentes. Con respecto al nelfinavir, único IP que se utiliza sin RTV como potenciador, es de esperar que se presenten menor número de interacciones que los regímenes que contienen IP con RTV como potenciador. La adición de TDF a nelfinavir no afecta a la farmacocinética del nelfinavir, con lo que pueden ser utilizados conjuntamente sin riesgo de interacciones. La adición de TDF a los regímenes con saquinavir potenciado con RTV produce un aumento estadísticamente significativo de las concentraciones de SQV (AUC = 29%, Cmin = 47%, Cmáx = 22%). El aumento de la Cmin puede tener implicaciones clínicas y ser útil como terapia de rescate para la mayoría de cepas resistentes. Por último, la adición de TDF a regímenes con lopinavir – ritonavir, aunque produce una reducción de un 34% y un 44% de lopinavir y ritonavir, respectivamente, no se espera que sea clínicamente significativo. Por otro lado, se ha descrito interacción con atazanavir y efavirenz, encontrándose una disminución del AUC de atazanavir de un 74% cuando se administra con efavirenz. Sin embargo, esta interacción se compensa con la adición de 200 mg de ritonavir a la dosis habitual de atazanavir de 400 mg, ya que la adición de este potenciador produce un aumento de tres veces en el AUC de atazanavir. Ciertas interacciones pueden ocasionar una mayor toxicidad. Este es el caso de la adición de rifampicina a regímenes con ritonavir + saquinavir. En este estudio de 28 días de duración, se trataron 28 voluntarios sanos distribuidos en dos grupos de tratamiento. El primero de ellos recibió durante 14 días saquinavir 1.000 mg dos veces al día asociado a 100 mg de ritonavir dos veces al día. El segundo grupo de voluntarios recibió durante estos 14 41 [ 5 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] días 600 mg/día de rifampicina sin terapia antirretroviral. Posteriormente ambos grupos recibieron terapia antirretroviral y rifampicina a las mismas dosis antes indicadas durante otros 14 días (días 15 a 28 del estudio). Este estudio tuvo que suspenderse de forma prematura debido a las reacciones de hepatotoxicidad observadas. En total 11 pacientes sufrieron un aumento de los niveles de transaminasas13. En la tabla adjunta se resumen los datos disponibles del estudio. [TABLA 3] Hepatotoxicidad de rifampicina cuando se asocia a saquinavir más ritonavir. Grupo 1 (n=14) Tratamiento Nº total casos daño hepático agudo Casos con ALT entre 5-10XLSN Casos con ALT>10xLSN Grupo 2 (n=14) 1ª fase (días 1-14) 2ª fase (días 14-28) 1ª fase (días 1-14) 2ª fase (días 14-28) SQV + RTV SQV + RTV + RFP RFP SQV + RTV + RFP -- 2 (14%) 3 (21%) 6 (43%) -- 2 (14%) -- -- -- 3 (21%) 6 (43%) La frecuencia y severidad del daño hepático agudo fue superior en el Grupo 2, donde todos los pacientes estuvieron tratados durante todo el estudio con rifampicina Una vez suspendido el tratamiento, los niveles de transaminasas evolucionaron hacia su normalización. Los resultados de este estudio se están analizando con detalle con objeto de esclarecer el posible mecanismo de la interacción clínica entre rifampicina y saquinavir/ritonavir. DOBLE POTENCIACIÓN El ritonavir potencia las concentraciones de otros fármacos por dos mecanismos diferentes: inhibe el citocromo P450 y la glicoproteína-P en el intestino aumentando la absorción de fármacos metabolizados por este enzima, e inhibe también el citocromo P450 en el hígado14. 42 Recientemente, se ha propugnado la existencia de una actividad sinérgica frente al VIH cuando se utilizan regímenes que combinan dos IP con bajas Actualización de las interacciones medicamentosas con antirretrovirales dosis de ritonavir. Hay una cierta evidencia obtenida de los ensayos clínicos que estos regímenes tienen mayor eficacia y resultado que los regímenes simples en pacientes intensamente tratados. Estos regímenes de doble potenciación se han mostrado también eficaces en pacientes que no tienen opción de tratamiento con los inhibidores de la transcriptasa inversa, bien por el desarrollo de altos niveles de resistencia o bien por toxicidad15. Sin embargo, las interacciones entre tres inhibidores de proteasa son difíciles de predecir y son necesarios estudios farmacocinéticos que aseguren la consecución de concentraciones plasmáticas terapéuticas. De todos los IP, el ritonavir es el único agente potenciador capaz de aumentar la concentración de otros IP de forma apropiada. Así por ejemplo, se han estudiado diferentes combinaciones que se describen a continuación. Saquinavir/Lopinavir/Ritonavir La administración de estos tres IP no modifica la farmacocinética del saquinavir y lopinavir, pero sí la del ritonavir que disminuye sus concentraciones pero sin llegar a perder la eficacia como potenciador. Se recomienda esta combinación para pacientes con opciones limitadas de tratamiento con inhibidores de la transcriptasa inversa16. Saquinavir/atazanavir/ritonavir La administración de estos tres fármacos es prometedora por varios motivos. En primer lugar, se ha observado una interacción farmacocinética positiva produciéndose un incremento en los niveles de saquinavir (aumento AUC en 60%). En segundo lugar, ATV y SQV presentan patrones de resistencia distintos, perfil lipídico favorable y permiten la administración de una vez al día17. Esta combinación sería una alternativa de tratamiento para aquellos pacientes muy pretratados. Saquinavir/fosamprenavir/ritonavir El fosamprenavir, profármaco del amprenavir, se hidroliza rápidamente por las fosfatasas celulares del epitelio gastrointestinal al fármaco activo amprenavir. Presenta, in vitro, sinergismo y un perfil complementario de resistencias con el saquinavir, que justificaría su posible combinación. En un estudio farmacocinético, se produjo una disminución en las concentraciones 43 [ 5 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] de saquinavir que se compensó aumentado la dosis de RTV a 200 mg bid18. La dosis óptima de combinación de estos tres fármacos es 1.000/700/200 mg bid de saquinavir/fosamprenavir/ritonavir. Lopinavir/ritonavir/fosamprenavir Se desaconseja esta combinación, ya que el estudio farmacocinético realizado con los tres fármacos revela una interacción bidireccional, observándose una disminución en los niveles de LPV de 60% tras la adición de fosamprenavir y de un 70% en los niveles de APV tras añadirle lopinavir19. Nelfinavir/lopinavir/ritonavir Los parámetros farmacocinéticos del lopinavir disminuyen también tras la adición de nelfinavir. Por lo tanto, si se utiliza la combinación nelfinavir/lopinavir/ritonavir se debe aumentar la dosis de RIT/LPV a 133/533 mg dos veces al día para asegurar niveles plasmáticos eficaces. Tipranavir/ritonavir/Otros IP Por último el Tipranavir, IP todavía no comercializado en España, ha mostrado ser eficaz frente a cepas multirresistentes a otros IPs, debe ser siempre administrado con ritonavir 200 mg bid. Los estudios de combinación con otros IPs han mostrado reducciones importantes en el AUC de: 70% SQV, 45% APV y 49% LPV. A la vista de estos resultados no se debe administrar TPV con ninguno de los otros IPs. CONCLUSIONES Han aparecido nuevas interacciones farmacológicas con aquellos fármacos de introducción reciente como el tenofovir y atazanavir y cuya importancia clínica es significativa. Se están realizando estudios con tres IPs en pacientes intensamente tratados y existen algunas combinaciones que pueden administrarse aunque hay otras con perfil farmacocinética desfavorable. 44 Actualización de las interacciones medicamentosas con antirretrovirales BIBLIOGRAFÍA 1. Bristol Meyers Squibb Company. Reyataz (Atazanavir sufate) with or without Norvir (ritonavir) and proton pump inhibitors should not be coadministrated: important new pharmacokinetic data. (Letter to health care providers). 2004. 2. Anonimous. Avoid PPIs with Atazanavir. AIDS Clinical Care 3, 1. 2005. 3. Young BM. The Role of Nucleoside and Nucleotide Reverse Transcriptase Inhibitor Backbones in Antiretroviral Therapy. [Article]. JAIDS Journal of Acquired Immune Deficiency Syndromes 2004; 37 Supplement 1:S13-S20. 4. Shafer RW, Smeaton LM, Robbins GK, De G, V, Snyder SW, D'Aquila RT et al. Comparison of four-drug regimens and pairs of sequential three-drug regimens as initial therapy for HIV-1 infection. N Engl J Med 2003; 349(24):2304-2315. 5. Staszewski S, Gallant J, Ozniak A. Efficacy and safety of tenofovir DF (TDF) versus stavudine (d4T) when used in combination with lamivudine and efavirenz in antiretroviral naive patients: 96-week preliminary interim results. Program and abstracts of the 10th Conference on Retroviruses and Opportunistic Infections; February 10–14,2003; Boston, MA Abstract 564B 2003. 6. Kearney B, Isaacson E, Sayre J. Didanosine and tenofovir DF drug-drug interaction: assessment of didanosine dose reduction. In: Program and Abstracts of 10th Conference on Retroviruses and Opportunistic Infections, Boston, MA February 2003 [abstract 533] 2003. 7. Negredo E, Molto J, Burger D, Viciana P, Ribera E, Paredes R et al. Unexpected CD4 cell count decline in patients receiving didanosine and tenofovir-based regimens despite undetectable viral load. [Article]. AIDS 2004; 18(3):459-463. 8. Moyle G. Early virological failure in persons with viral loads >100,000 cps/ml and CD4 counts < 200/mm3 receiving ddI/tenofovir/efavirenz as initial therapy: Results from a randomised comparative trial. Interscience Conference on Antimicrobial Agents and Chemotherapy, Washington, DC, October 2004 Abstract H-566 2004. 9. Kirian MA, Higginson RT, Fulco PP. Acute onset of pancreatitis with concomitant use of tenofovir and didanosine. Ann Pharmacother 2004; 38(10):1660-1663. 10. Blanchard JN, Wohlfeiler M, Canas A, King K, Lonergan JT. Pancreatitis with didanosine and tenofovir disoproxil fumarate [corrected]. Clin Infect Dis 2003; 37(5):e57-e62. 11. Martínez E, Milinkovic A, de Lazzari E, Ravasi G, Blanco JL, Larrousse M et al. Pancreatic toxic effects associated with co-administration of didanosine and tenofovir in HIV-infected adults. Lancet 2004; 364(9428):65-67. 12. Shafran SD. Antiretroviral Drug Interactions - emerging data on the newest agents: A canadian thought - leader perspective. Mescape HIV/AIDS 2005; 11(1):1-4. 13. Agencia Española de Medicamentos y Productos Sanitarios. Hepatitis inducida por el tratamiento combinado de rifampicina con saquinavir/ritonavir: Datos procedentes de un ensayo clínico. 04/2005. 2005. 11-2-2005. Ref Type: Report 14. Zeldin RK, Petruschke RA. Pharmacological and therapeutic properties of ritonavirboosted protease inhibitor therapy in HIV-infected patients. [Article]. Journal of Antimicrobial Chemotherapy 2004; 53(1):4-9. 45 [ 5 46 º S e m i n a r i o d e A t e n c i ó n F a r m a c é u t i c a ] 15. Boffito M, Maitland D, Samarasinghe Y, Pozniak A. The pharmacokinetics of HIV protease inhibitor combinations. [Miscellaneous]. Current Opinion in Infectious Diseases 2005; 18(1):1-7. 16. Stephan C, Hentig N, Kourbeti I, Dauer B, Mosch M, Lutz T et al. Saquinavir drug exposure is not impaired by the boosted double protease inhibitor combination of lopinavir/ritonavir. [Article]. AIDS 2004; 18(3):503-508. 17. Boffito M, Kurowski M, Kruse G, Hill A, Benzie AA, Nelson MR et al. Atazanavir enhances saquinavir hard-gel concentrations in a ritonavir-boosted once-daily regimen. [Article]. AIDS 2004; 18(9):1291-1297. 18. Boffito MM, Dickinson LB, Hill AP, Back DP, Moyle GM, Nelson MM et al. Steady-State Pharmacokinetics of Saquinavir Hard-Gel/Ritonavir/Fosamprenavir in HIV-1-Infected Patients. [Article]. JAIDS Journal of Acquired Immune Deficiency Syndromes 2004; 37(3):1376-1384. 19. Kashuba AD, Tierney C, Downey GF, Acosta EP, Vergis EN, Klingman K et al. Combining fosamprenavir with lopinavir/ritonavir substantially reduces amprenavir and lopinavir exposure: ACTG protocol A5143 results. [Article]. AIDS 2005; 19(2):145-152.