pH. La escala de pH
Anuncio

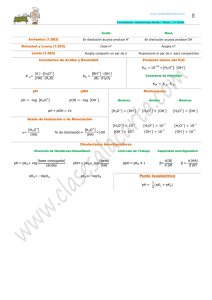
pH. La escala de pH • El pH: es la medida de forma cuantitativa de la acidez o basicidad de una disolución • Es decir, indica la concentración de iones hidronio, (H3O)+ de la disolución. • El pH H se calcula l l mediante di t ell llogaritmo it d decimal i l con signo negativo de la concentración de iones hidrogeno o hidronio pH = - log ( H+) = - log (H3O+) • La concentración de iones hidrogeno o hidronio viene expresada en moles /litro. • La escala de p pH expresa p el g grado de acidez o basicidad de una disolución de formas numérica con valores comprendidos p entre 1 y 14 • Disolución neutra.Æ neutra Æ pH= 7 (H3O+) = (OH-) = 10-7 moles/LÆ ÆpH = -log(H log(H30+) = – log(10-77) = 7 • Disolución Di l ió ácidaÆ á id Æ pH H<7 (H30+) > (OH-) ; (H3O+)>10-7 moles/L (0H-) < 10-7 moles/litro pH < 7 • Disolución básicaÆ pH > 7 (H3O+)< (OH-); H3O+< 10-7 moles / litro OH- > 10-7 moles / litro pH > 7 Escala de pH .0, 1, 2 , 3 , 4 , 5, 6 , y acidez mayor 7 , neutro 8, 9, 10, 11, 12, 13, 14 mayor y basicidad pOH • El pOH expresa el grado de basicidad de una disolución acuosa. • Viene dado por el logaritmo decimal de la concentración de iones hidroxilo (OH-) que hay en una disolución con signo negativo. •p pOH = - log g (OH ( -) • La concentración de (OH-) se expresa en moles / litro • 0, 1, 2, 3, 4, 5, 6, 7 ,8, 9, 10, 11, 12,13, 14 Más básico más ácido (menos basico) • La constante ionica del agua g es: K H2O = (H3O+) (OH-) = 10-14 Al tomar logaritmos decimales y operar y multiplicar por -1 1 ttenemos: log 10 -14 = log(H3O+) + log(OH-) 14= -log (H3O+) + (- log(OH-) ) 14= pH + pOH Es decir la suma del pH y del pOH de una disolución es igual a 14. Más básico pH 14 13 12 11 10 9 8 pOH 0 1 2 3 4 5 6 Neutro 7 7 Más ácido 6 5 4 3 2 1 0 8 9 10 11 12 13 14








![[editar]Definición](http://s2.studylib.es/store/data/008533524_1-f53108428f2c43501e4a8807a3697a86-300x300.png)

