pH y pOH
Anuncio

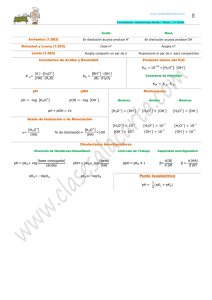
APCE - COLEGIO LAMATEPEC QUÍMICA – GUIA DE ACTIVIDADES DE CLASE – ÁCIDOS, BASES Y COMPUESTOS IÓNICOS 2 Responsable: Ing. Nelson Velásquez Alumno: ___________________________________ fecha: ___________ 10º grado _______ pH y pOH En química, concretamente en el estudio de la química ácido-base, el pH (potencial de hidrógeno) es una medida de la acidez o alcalinidad de una disolución. El pH indica la concentración de iones hidronio [H3O+] presentes en determinadas sustancias. La sigla significa "potencial de hidrógeno". Este término fue acuñado por el químico danés Sørensen, quien lo definió como el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. Esto es: Desde entonces, el término "pH" se ha utilizado universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas en concentraciones. En disoluciones diluidas, en lugar de utilizar la actividad del ion hidrógeno, se le puede aproximar empleando la concentración molar del ion hidrógeno. Por ejemplo, una concentración de [H3O+] = 1 × 10–7 M (0,0000001) es simplemente un pH de 7 ya que: pH = –log [10–7] = 7 El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, porque hay más iones en la disolución), y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (cuando el disolvente es agua). Se define el pOH como el logaritmo negativo en base 10 de la actividad de los aniones hidroxilo, o también en términos de concentración de éstos, expresado como En soluciones acuosas, los iones H3O+ y OH- provienen de la disociación del agua: H2O ↔ H+ + OHO también, 2H2O ↔ H3O+ + OHPor ejemplo, si en una disolución se tiene una concentración [OH-] = 1×10-7 M (0,0000001 M), ésta tiene un pOH de 7 ya que: pOH = -log10 [10-7] = 7 Dado que pOH tiene la misma definición que pH, pero aplicado a la concentración de aniones hidroxilo, cumple las mismas propiedades que éste; típicamente tiene un valor entre 0 y 14 en disolución acuosa, pero en este caso son ácidas las disoluciones con pOH mayores a 7, y básicas las que tienen pOH menores a 7, puesto que en términos de concentración de reactivos, si el pH tiene un valor pequeño, significa que tiene una alta concentración de iones hidronio con respecto a la disolución neutra, y en esa misma proporción, pero al contrario, se produce por desequilibrio químico que tenga poca concentración de aniones hidroxilo, luego un pOH con un valor alto. Así, considerando que el agua pura (disolución neutra) tiene un pH = pOH = 7 se cumple que: pH + pOH = 14 Ecuación que se mantiene constante ante las variaciones del pH (o pOH). Es preciso aclarar que pH y pOH “están de acuerdo”. Una solución que es ácida según el pH, lo es también según el pOH. Y si es alcalina o básica según el pH, también lo es según el pOH. EJERCICIOS Con base en lo anterior resuelva los siguientes ejercicios: Calcule el pH y el pOH de las soluciones cuyas concentraciones se le proporcionan en M o mol/L. Indique si la solución es ácida o básica: 1) [H3O+] = 1.2 x 10-3 M 2) [OH-] = 7.8 x 10-4 M 3) [H3O+] = 2.3 x 10-2 M 4) [OH-] = 8.9 x 10-3 M 5) [H3O+] = 3.4 x 10-12 M 6) [OH-] = 9.0 x 10-2 M 7) [H3O+] = 4.5 x 10-7 M 8) [OH-] = 2.1 x 10-1 M 9) [H3O+] = 5.6 x 10-8 M 10) [OH-] = 3.2 x 10-14 M 11) [H3O+] = 6.7 x 10-5 M 12) [OH-] = 4.3 x 10-13 M